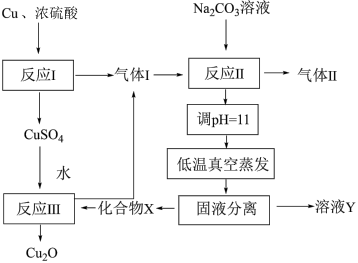
1 . 一种制备 的工艺路线如图所示。反应Ⅱ所得溶液pH在3~4之间,反应Ⅲ需及时补加NaOH以保持反应在pH=5条件下进行。
的工艺路线如图所示。反应Ⅱ所得溶液pH在3~4之间,反应Ⅲ需及时补加NaOH以保持反应在pH=5条件下进行。
已知:常温下, 的电离平衡常数
的电离平衡常数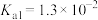 ,
,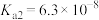 。
。
请回答: 的化学方程式为
的化学方程式为___________ 。
(2)反应 的离子反应方程式为
的离子反应方程式为___________ 。
(3)下列说法正确的是___________。
(4)反应 需及时补加NaOH以保持反应在pH=5条件下进行,原因是
需及时补加NaOH以保持反应在pH=5条件下进行,原因是___________ (结合离子反应方程式和必要的文字说明)。
(5)请用实验验证反应 后的溶液中存在的阳离子
后的溶液中存在的阳离子___________ 。
 的工艺路线如图所示。反应Ⅱ所得溶液pH在3~4之间,反应Ⅲ需及时补加NaOH以保持反应在pH=5条件下进行。
的工艺路线如图所示。反应Ⅱ所得溶液pH在3~4之间,反应Ⅲ需及时补加NaOH以保持反应在pH=5条件下进行。已知:常温下,
 的电离平衡常数
的电离平衡常数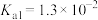 ,
,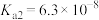 。
。请回答:
 的化学方程式为
的化学方程式为(2)反应
 的离子反应方程式为
的离子反应方程式为(3)下列说法正确的是___________。
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 分解 分解 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比 增大时,需补加NaOH的量减少 增大时,需补加NaOH的量减少 |
(4)反应
 需及时补加NaOH以保持反应在pH=5条件下进行,原因是
需及时补加NaOH以保持反应在pH=5条件下进行,原因是(5)请用实验验证反应
 后的溶液中存在的阳离子
后的溶液中存在的阳离子
您最近一年使用:0次
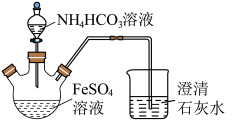
2 . 碳酸亚铁(FeCO3)难溶于水,常用于制取铁盐或补血剂。一种FeCO3的制备装置如图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得FeCO3沉淀。______________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:__________________ 。
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程_________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O
 =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
您最近一年使用:0次
名校
解题方法
3 . Ⅰ.现有某固体混合物,可能由 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分(如图),所加试剂均过量。
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分(如图),所加试剂均过量。
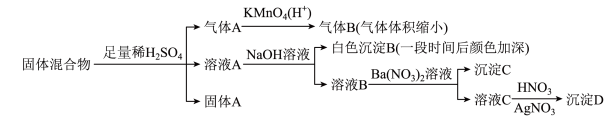
(1)该固体混合物中一定含有___________ 。
(2)写出气体A通入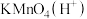 后,气体体积缩小所发生反应的离子方程式
后,气体体积缩小所发生反应的离子方程式___________ 。
(3)写出白色沉淀B放置在空气中发生反应的化学方程式___________ 。
Ⅱ.某溶液中只可能含有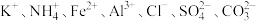 中的若干种离子,离子浓度均为
中的若干种离子,离子浓度均为 。某同学进行了如下实验:
。某同学进行了如下实验:
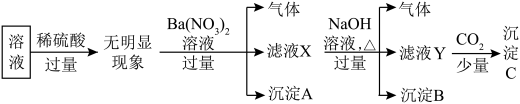
(4)原溶液中一定不存在的离子是___________ 。
(5)沉淀C的成分是___________ (写化学式)。
(6)写出加入过量 时产生气体的离子方程式
时产生气体的离子方程式___________ ,检验产物中的阳离子所用试剂及现象为___________ 。
 中的若干种物质组成,设计部分实验方案探究该固体混合物的成分(如图),所加试剂均过量。
中的若干种物质组成,设计部分实验方案探究该固体混合物的成分(如图),所加试剂均过量。
(1)该固体混合物中一定含有
(2)写出气体A通入
 后,气体体积缩小所发生反应的离子方程式
后,气体体积缩小所发生反应的离子方程式(3)写出白色沉淀B放置在空气中发生反应的化学方程式
Ⅱ.某溶液中只可能含有
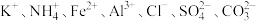 中的若干种离子,离子浓度均为
中的若干种离子,离子浓度均为 。某同学进行了如下实验:
。某同学进行了如下实验:
(4)原溶液中一定不存在的离子是
(5)沉淀C的成分是
(6)写出加入过量
 时产生气体的离子方程式
时产生气体的离子方程式
您最近一年使用:0次
名校
4 . 黄铜矿的主要成份为 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。
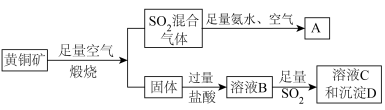
已知:沉淀D的摩尔质量为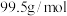 ,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
(1) 被足量氨水充分吸收后,再通入足量空气可得到一种氮肥
被足量氨水充分吸收后,再通入足量空气可得到一种氮肥 ,请写出
,请写出 的化学式:
的化学式:______ 。
(2)判断溶液B中溶质为______ 。
(3)试写出生成沉淀D的离子反应方程式:______ 。
(4)请设计实验检验溶液C中的阳离子______ 。
 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。
已知:沉淀D的摩尔质量为
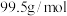 ,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:
,只含2种元素。忽略黄铜矿中其它杂质成分。请回答:(1)
 被足量氨水充分吸收后,再通入足量空气可得到一种氮肥
被足量氨水充分吸收后,再通入足量空气可得到一种氮肥 ,请写出
,请写出 的化学式:
的化学式:(2)判断溶液B中溶质为
(3)试写出生成沉淀D的离子反应方程式:
(4)请设计实验检验溶液C中的阳离子
您最近一年使用:0次
名校
5 . 一种由铜镉渣生产金属镉的流程如下:(铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。)
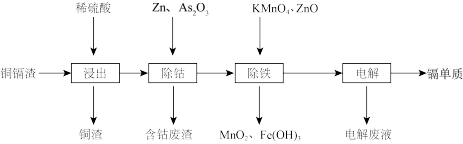
下表列出了相关金属离子生成氢氧化物沉淀的pH
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出。写出通空气将Cu氧化浸出的离子方程式___________ 。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3,该微电池的正极反应式为_______ 。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=___________ 。
②除铁时加入ZnO控制反应液pH的范围为___________ 。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:___________ 。
(5)净化后的溶液可电解获得镉单质。镉的金属性___________ 金属铜(填“强于”或“弱于”)。

下表列出了相关金属离子生成氢氧化物沉淀的pH
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3,该微电池的正极反应式为
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=
②除铁时加入ZnO控制反应液pH的范围为
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:
(5)净化后的溶液可电解获得镉单质。镉的金属性
您最近一年使用:0次
2023-06-02更新
|
88次组卷
|
2卷引用:江苏省海头高级中学2022-2023学年高一下学期模拟考试化学试题
6 . 化合物X由3种元素组成。某兴趣小组按如下流程进行实验:
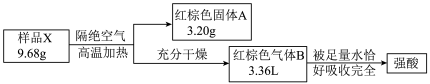
已知:气体B为2种气体组成的混合物,体积已折算为标准状况。
(1)组成X的元素有O和______ (填元素符号),B的成分为______ (需填化学式)。
(2)写出X隔绝空气加热分解反应的化学方程式______ 。
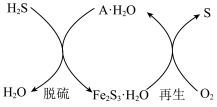
(3)在20℃~100℃之间,固体A对硫化氢有很高的脱除性能,常用作工业脱硫剂,写出再生过程发生反应的化学方程式______ (用具体的物质表示)。
(4)研究发现,控制温度、加热氯化铁的水溶液可得到 或FeOCl(难溶于水,易溶于硝酸)固体,设计验证产物只有
或FeOCl(难溶于水,易溶于硝酸)固体,设计验证产物只有 的实验方案
的实验方案______ 。

已知:气体B为2种气体组成的混合物,体积已折算为标准状况。
(1)组成X的元素有O和
(2)写出X隔绝空气加热分解反应的化学方程式
(3)在20℃~100℃之间,固体A对硫化氢有很高的脱除性能,常用作工业脱硫剂,写出再生过程发生反应的化学方程式

(4)研究发现,控制温度、加热氯化铁的水溶液可得到
 或FeOCl(难溶于水,易溶于硝酸)固体,设计验证产物只有
或FeOCl(难溶于水,易溶于硝酸)固体,设计验证产物只有 的实验方案
的实验方案
您最近一年使用:0次
名校
解题方法
7 . 某固体混合物中,可能含有Na+、K+、Fe2+、Cl-、SO 、CO
、CO 等离子,取少量固体溶于蒸馏水配成溶液,进行如图的实验:
等离子,取少量固体溶于蒸馏水配成溶液,进行如图的实验:
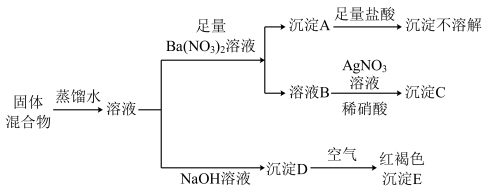
请回答下列问题:
(1)沉淀A的化学式为______ ,沉淀E的化学式为______ 。
(2)①混合物中,一定存在的离子有______ ,②一定不存在的离子有______ ,③可能存在的离子是______ ,若要检验是否存在,实验方法是______ 。
(3)沉淀D在空气中转化为E的化学方程式为______ 。
(4)某溶液中含有Na+、K+、Fe2+、Cl-、SO 五种离子,且c(K+):c(Fe2+):c(Na+):c(Cl-)=1:2:3:4,c(K+)=0.1mol/L,则c(SO
五种离子,且c(K+):c(Fe2+):c(Na+):c(Cl-)=1:2:3:4,c(K+)=0.1mol/L,则c(SO )=
)=______ mol/L。
 、CO
、CO 等离子,取少量固体溶于蒸馏水配成溶液,进行如图的实验:
等离子,取少量固体溶于蒸馏水配成溶液,进行如图的实验:
请回答下列问题:
(1)沉淀A的化学式为
(2)①混合物中,一定存在的离子有
(3)沉淀D在空气中转化为E的化学方程式为
(4)某溶液中含有Na+、K+、Fe2+、Cl-、SO
 五种离子,且c(K+):c(Fe2+):c(Na+):c(Cl-)=1:2:3:4,c(K+)=0.1mol/L,则c(SO
五种离子,且c(K+):c(Fe2+):c(Na+):c(Cl-)=1:2:3:4,c(K+)=0.1mol/L,则c(SO )=
)=
您最近一年使用:0次
2023-03-01更新
|
193次组卷
|
2卷引用:湖南省名校联考联合体2022-2023学年高一下学期入学考试化学试题
解题方法
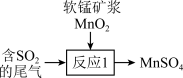
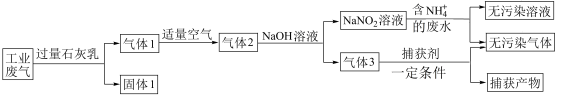
8 . 绿水青山就是金山银山。绿色发展、生态保护已成为中国展示给世界的一张新“名片”。回答下列问题:
(1)硫酸工业排出的尾气(主要含 )可用软锰矿浆吸收,写出如图所示“反应1”的化学方程式
)可用软锰矿浆吸收,写出如图所示“反应1”的化学方程式_______ 。 造成的一种常见环境污染为
造成的一种常见环境污染为_______ 。
(2)某种综合处理含 ,废水和工业废气(主要含
,废水和工业废气(主要含 、
、 、
、 、
、 、
、 )的流程如图:
)的流程如图:
已知: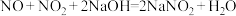 ,
,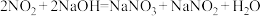 。
。
①固体1的主要成分有 、
、_______ (填化学式)。
②若实验室需要配制
 溶液1L进行模拟测试,需称取
溶液1L进行模拟测试,需称取 固体的质量为
固体的质量为_______ g。
③用 溶液处理含
溶液处理含 废水反应的离子方程式为
废水反应的离子方程式为_______ 。
④验证废水中 已基本除净的方法是
已基本除净的方法是_______ (写出操作、现象及结论)。
⑤捕获产物主要是_______ (填化学式)。
⑥气体1转化为气体2时空气不能过量的原因是_______ 。
(1)硫酸工业排出的尾气(主要含
 )可用软锰矿浆吸收,写出如图所示“反应1”的化学方程式
)可用软锰矿浆吸收,写出如图所示“反应1”的化学方程式 造成的一种常见环境污染为
造成的一种常见环境污染为
(2)某种综合处理含
 ,废水和工业废气(主要含
,废水和工业废气(主要含 、
、 、
、 、
、 、
、 )的流程如图:
)的流程如图:
已知:
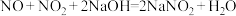 ,
,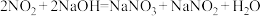 。
。①固体1的主要成分有
 、
、②若实验室需要配制

 溶液1L进行模拟测试,需称取
溶液1L进行模拟测试,需称取 固体的质量为
固体的质量为③用
 溶液处理含
溶液处理含 废水反应的离子方程式为
废水反应的离子方程式为④验证废水中
 已基本除净的方法是
已基本除净的方法是⑤捕获产物主要是
⑥气体1转化为气体2时空气不能过量的原因是
您最近一年使用:0次
2023-01-08更新
|
452次组卷
|
2卷引用:陕西省渭南市白水县2021-2022学年高一上学期期末考试化学试题
解题方法
9 . 某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO )=
)=___________ mol·L−1;
(2)某同学认为该溶液中一定存在K+,浓度是___________ ;
(3)根据以上实验,氯离子可能存在。检验该离子是否存在的方法是:___________ ;
(4)写出③中固体加入足量盐酸洗涤的离子方程式为___________ 。
 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO
 )=
)=(2)某同学认为该溶液中一定存在K+,浓度是
(3)根据以上实验,氯离子可能存在。检验该离子是否存在的方法是:
(4)写出③中固体加入足量盐酸洗涤的离子方程式为
您最近一年使用:0次
名校
10 . 某固体粉末样品中只可能含有Fe2+、Fe3+、Na+、 、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
①取适量样品加水溶解。
②取少量①中的待测液,滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变为血红色。
③另取少量①中的待测液,滴加过量的氢氧化钠溶液,除得到沉淀外,还有无色有刺激性气味的气体放出,该气体可使酚酞溶液变红。
(1)由上述实验可知,该样品中一定不含有的离子为_______ (填离子符号),一定含有的离子为_______ (填离子符号)。
(2)操作③中沉淀变化的现象为_______ 。
(3)操作③中生成刺激性气体的离子方程式为_______ 。
 、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:①取适量样品加水溶解。
②取少量①中的待测液,滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变为血红色。
③另取少量①中的待测液,滴加过量的氢氧化钠溶液,除得到沉淀外,还有无色有刺激性气味的气体放出,该气体可使酚酞溶液变红。
(1)由上述实验可知,该样品中一定不含有的离子为
(2)操作③中沉淀变化的现象为
(3)操作③中生成刺激性气体的离子方程式为
您最近一年使用:0次



