名校
解题方法
1 . 某无色混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Cl-、CO32-、SO42-,现各取 100mL 溶液三份进行如下实验:①向第一份加入 AgNO3 溶液,有白色沉淀产生;②向第二份加入足量 NaOH 溶液后加热,收集到气体 0.896L(标准状况)③向第三份加入足量 BaCl2 溶液,得到沉淀 6.63 克,经足量盐酸洗涤后,剩余 4.66 克。 试回答下列问题:
(1)肯定存在的离子有__________ ,肯定不存在的离子有__________ ;
(2)可能存在的离子是__________ ,判断该离子存在与否的方法是__________ ;
(3)肯定存在的阳离子在原溶液中的物质的量浓度__________ 。
(1)肯定存在的离子有
(2)可能存在的离子是
(3)肯定存在的阳离子在原溶液中的物质的量浓度
您最近一年使用:0次
2 . 以粉煤灰(主要含Al2O3、SiO2,还有少量的Fe2O3)为原料制取Al2O3的流程如下:

(1)操作Ⅰ的名称是__ 。
(2)用H2SO4“酸浸”时的离子方程式为__ (任写一个)。
(3)简述如何检验酸浸后溶液中是否有Fe3+__ 。
(4)“煅烧”时的化学方程式为__ 。
(5)沉淀A与氢氟酸反应的化学方程式为__ 。

(1)操作Ⅰ的名称是
(2)用H2SO4“酸浸”时的离子方程式为
(3)简述如何检验酸浸后溶液中是否有Fe3+
(4)“煅烧”时的化学方程式为
(5)沉淀A与氢氟酸反应的化学方程式为
您最近一年使用:0次
2020-01-15更新
|
228次组卷
|
2卷引用:江西省南昌市新建县第一中学2019-2020学年高一上学期期末考试(共建部)化学试题
3 . 有一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后滤液中 滴入硝酸酸化的AgNO3溶液,有白色沉淀生成;
③取②中有色沉淀加入足量稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤,往得到沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,判断粉末中一定含有的离子是_______ , 肯定没有的离子是_____ 不能确定是否含有的离子是___________ ,通过_________ 来进一步确定该离子。
(2)写出②中生成有色沉淀反应的离子方程式:______________________ 。
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后滤液中 滴入硝酸酸化的AgNO3溶液,有白色沉淀生成;
③取②中有色沉淀加入足量稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤,往得到沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,判断粉末中一定含有的离子是
(2)写出②中生成有色沉淀反应的离子方程式:
您最近一年使用:0次
2020-01-02更新
|
177次组卷
|
2卷引用:河南省许汝平九校联盟2018-2019学年高一上学期期末考试化学试题
名校
解题方法
4 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在 的离子是___ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是___ ,有关离子方程式为__ 。
(3)取(2)中的滤液,加入过量的NaOH,出现白色沉淀,说明原溶液中肯定有___ ,有关的离子方程式为__ 。
(4)原溶液可能大量存在的阴离子是下列的___ 。
A.Cl- B.NO3- C.CO32- D.OH-
(1)不做任何实验就可以肯定原溶液中
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是
(3)取(2)中的滤液,加入过量的NaOH,出现白色沉淀,说明原溶液中肯定有
(4)原溶液可能大量存在的阴离子是下列的
A.Cl- B.NO3- C.CO32- D.OH-
您最近一年使用:0次
2019-12-12更新
|
371次组卷
|
12卷引用:2016-2017学年湖北省蕲春县高一上学期期中化学试卷
2016-2017学年湖北省蕲春县高一上学期期中化学试卷广西陆川县中学2017-2018学年高一下学期3月月考化学试题湖南省益阳市第六中学2019-2020学年高一上学期期中考试化学试题吉林省延边朝鲜族自治州汪清县第四中学2019-2020学年高一上学期第二次阶段考试化学试题内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高一上学期第二次月考化学试题新疆伊犁哈萨克自治州伊宁市第八中学2019-2020学年高一上学期期中考试化学试题安徽省明光中学2021-2022学年高一上学期第一次月考化学试题江西省丰城市第九中学2021-2022学年高一上学期第一次月考(日新部)化学试题安徽省宿州市萧县凤山中学2022-2023学年高一上学期期末检测化学试题四川省绵阳市三台中学校2022-2023学年高一上学期第一次考试化学试题微专题(三) 离子反应的三大应用广东省汕尾市华大实验学校2023-2024学年高一上学期9月月考化学试题
5 . 摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:

滴定实验结果记录如下:
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________ 。
(2)步骤②的目的是_____________________________________________________ 。产生红褐色沉淀的离子方程式_____________________________________ 。
(3)步骤④中操作X为_________________________________ (按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______ (填“能”或“不能”),请说明理由__________________________________________________ 。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________ 。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________ 。
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)步骤①中需要的定量仪器为
(2)步骤②的目的是
(3)步骤④中操作X为
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将
(6)通过上述实验测定结果,推断摩尔盐化学式为
您最近一年使用:0次
6 . 某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下:
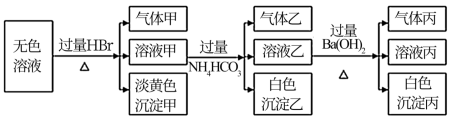
试回答下列问题:
(1)生成沉淀甲的离子方程式为:____________ 。
(2)生成气体丙和沉淀丙的离子方程式为_________ 。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表
(4)综上所述,该溶液肯定存在的离子有:_________ 。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是_________ 。

试回答下列问题:
(1)生成沉淀甲的离子方程式为:
(2)生成气体丙和沉淀丙的离子方程式为
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | |||
| 2 | |||
| 3 | 检验CO2 | 澄清石灰水 | 溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有:
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是
您最近一年使用:0次
名校
7 . 如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。

试回答下列问题:
(1)实验1中,溶液颜色由______ 色变为______ 色,写出溶液变色的化学反应方程式____________ 。
(2)实验2甲针筒内发生的化学反应方程式:_______________ 。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________ 溶液中。
(3)实验3中,甲中最后剩余的无色气体是_____ ,写出NO2与H2O反应的化学反应方程式_____________ 。
(4)实验4中能看见有白烟产生并生成一种气体(空气主要成分之一),该化学反应方程式______________ ,写出检验所得白色固体中阳离子的操作方法:___________ 。

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 溴水 | SO2 |
| 2 | H2S | SO2 |
| 3 | NO2(主要) | H2O(l) |
| 4 | 15mLCl2 | 40mLNH3 |
(1)实验1中,溶液颜色由
(2)实验2甲针筒内发生的化学反应方程式:
(3)实验3中,甲中最后剩余的无色气体是
(4)实验4中能看见有白烟产生并生成一种气体(空气主要成分之一),该化学反应方程式
您最近一年使用:0次
8 . 2019年4月,陨石坠落哥斯达黎加,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:

(1)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析 标明电子转移数目_____ .
(2)写出E与 NaOH溶液反应的离子方程式______
(3)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法:______
(4)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____ ;净化G胶体可采用图___ (填序号)的方法,此种方法叫_____ 。


(1)写出E与焦炭在高温下反应制取Z的化学方程式,并用
(2)写出E与 NaOH溶液反应的离子方程式
(3)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法:
(4)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做

您最近一年使用:0次
名校
解题方法
9 . 某固体混合物,仅含有以下阴、阳离子中的某几种(不考虑水的电离):
为了判断该混合物的组成,现依次进行如下实验,根据实验现象,回答下列问题:
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12.则混合物组成中肯定不存在的离子是_______ 。
(2)向(1)所得溶液中滴加盐酸,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。则肯定存在的离子是_______ ,可以排除的离子是_______ 。
(3)取以上实验的上层澄清液,滴加AgNO3溶液,有白色沉淀生成。你认为还有哪些离子尚待检验:_______ (填离子符号),请你对尚待检验的离子提出合理的检验方法(要求写出具体的步骤、现象与结论):_______
| 阳离子 | K+、Ba2+、Ag+、Mg2+ |
| 阴离子 | Cl-、 、 、 、 、 、 、 |
(1)取该固体混合物,加水后固体完全溶解得到无色溶液,用pH试纸测得溶液的pH为12.则混合物组成中肯定不存在的离子是
(2)向(1)所得溶液中滴加盐酸,开始有沉淀生成,继续滴加,沉淀消失,同时有无色无味气体逸出。则肯定存在的离子是
(3)取以上实验的上层澄清液,滴加AgNO3溶液,有白色沉淀生成。你认为还有哪些离子尚待检验:
您最近一年使用:0次
10 . (NH4)2Fe(SO4)2·6H2O(M=392g/mol)又称摩尔盐,简称FAS,它是浅蓝色绿色晶体,可溶于水,难溶于水乙醇。某小组利用工业废铁屑进行下列实验。请按要求回答下列问题:
Ⅰ. FAS的制取。流程如下:
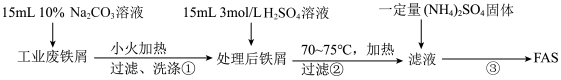
(1)步骤①加热的目的是_________________________ 。
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):______________ 。
Ⅱ.NH4+含量的测定。装置如图所示:
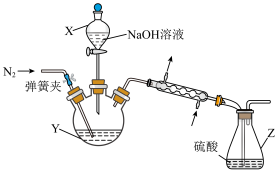
实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称______________ ;N2的电子式为______________ 。
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是__________________ ;NH4+质量百分含量为(用代数式表示)__________________ 。
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)_________ 。滴定中反应的离子方程式为____________________ 。
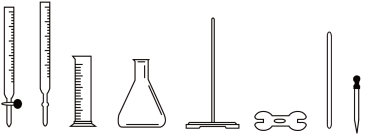
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液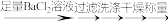 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________ 。
(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是_______________ ;为验证该猜测正确,设计后续实验操作为_________________ ,现象为______________ 。
Ⅰ. FAS的制取。流程如下:

(1)步骤①加热的目的是
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):
Ⅱ.NH4+含量的测定。装置如图所示:

实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)

① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液
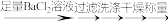 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是
您最近一年使用:0次
2019-04-28更新
|
289次组卷
|
2卷引用:【区级联考】天津市河西区2019届高三下学期二模考试化学试题



