名校
解题方法
1 . 某化学学习小组设计实验制取氨气并探究氨气的有关性质:
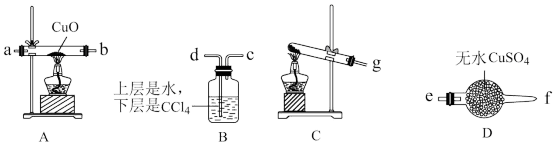
(1)已知NH3难溶于有机溶剂CCl4,该小组成员设计实验制备氨气并探究氨气的还原性及产物 ,提供实验装置如图:______
②根据上述提供的装置正确的连接顺序为______ (用各接口序号表示)
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________ 。
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式______
(3)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O___________ 。(已知:Cu2O+2H+=Cu+Cu2+ +H2O)
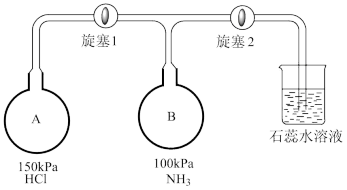
(4)按下图装置进行NH3性质实验。___________ ,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________ 。
(1)已知NH3难溶于有机溶剂CCl4,该小组成员设计实验制备氨气并探究
②根据上述提供的装置正确的连接顺序为
③该装置在设计上有一定的缺陷,你对该装置的改进措施是
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
(3)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。请你设计一个简单的实验检验该红色物质中是否含有Cu2O
(4)按下图装置进行NH3性质实验。
②再打开旋塞2,B瓶中的现象是
您最近一年使用:0次
2021-11-23更新
|
1534次组卷
|
13卷引用:浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题
浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题(已下线)5.2.2 氨和铵盐-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题第五章 化工生产中的重要非金属元素(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)新疆乌鲁木齐市第十二中学2023-2024学年高三上学期12月月考 化学试卷(已下线)第五章 化工生产中的重要非金属元素【单元测试A卷】山西省大同市2023-2024学年高一下学期3月月考化学试题陕西省安康市高新中学2023-2024学年高一下学期3月月考化学试题江西省宜春市丰城市第九中学2023-2024学年高一下学期期中考试化学试题安徽省太和中学2023-2024学年高一下学期4月期中考试化学试题黑龙江省绥化市绥棱县第一中学2023-2024学年高一下学期4月月考化学试题(已下线)清单02 氮及其化合物的性质 无机非金属材料(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
名校
2 . 现有一瓶澄清溶液,其中可能含有H+、NH 、Mg2+、Ba2+、Al3+、I-、NO
、Mg2+、Ba2+、Al3+、I-、NO 、CO
、CO 、SO
、SO 、AlO
、AlO 等。取该溶液进行以下实验:
等。取该溶液进行以下实验:
(1)取pH试纸检验,溶液呈酸性,可以排除___________ 的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,充分振荡后CCl4层呈紫色,可以排除___________ 的存在,用离子方程式说明原因___________ 。
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,又可排除___________ 的存在。
(4)取出部分上述碱性溶液,加Na2CO3溶液后,有白色沉淀生成,证明有___________ 的存在,又可以排除___________ 的存在。
(5)根据上述实验事实,还不能确定是否存在的离子是___________ 。
 、Mg2+、Ba2+、Al3+、I-、NO
、Mg2+、Ba2+、Al3+、I-、NO 、CO
、CO 、SO
、SO 、AlO
、AlO 等。取该溶液进行以下实验:
等。取该溶液进行以下实验:(1)取pH试纸检验,溶液呈酸性,可以排除
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,充分振荡后CCl4层呈紫色,可以排除
(3)另取出部分溶液,逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,反应过程中均无沉淀产生,又可排除
(4)取出部分上述碱性溶液,加Na2CO3溶液后,有白色沉淀生成,证明有
(5)根据上述实验事实,还不能确定是否存在的离子是
您最近一年使用:0次
解题方法
3 . 某固体混合物中,可能含有Na+、K+、NH 、Cl-、SO
、Cl-、SO 、CO
、CO 等离子,溶于水配成溶液,取两份该固体的溶液进行如图的实验:
等离子,溶于水配成溶液,取两份该固体的溶液进行如图的实验:
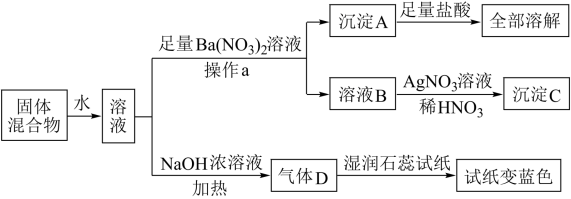
请回答下列问题:
(1)操作a的名称是___ 。
(2)沉淀A的化学式为___ ,沉淀C的化学式为___ 。
(3)混合物中,一定存在的离子有___ ,一定不存在的离子有___ ,可能存在的离子是__ 。
(4)生成气体D的离子方程式为___ 。
 、Cl-、SO
、Cl-、SO 、CO
、CO 等离子,溶于水配成溶液,取两份该固体的溶液进行如图的实验:
等离子,溶于水配成溶液,取两份该固体的溶液进行如图的实验:
请回答下列问题:
(1)操作a的名称是
(2)沉淀A的化学式为
(3)混合物中,一定存在的离子有
(4)生成气体D的离子方程式为
您最近一年使用:0次
4 . 某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol·L-1.
某同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②判断,溶液中一定不含有的阳离子是___________ (写离子符号)。
(2)③中加入少量盐酸生成无色气体的离子方程式是___________ 。
(3)该同学最终确定原溶液中所含阳离子是___________ (写离子符号)。
| 阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO 、NO 、NO 、SO 、SO 、SiO 、SiO |
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②判断,溶液中一定不含有的阳离子是
(2)③中加入少量盐酸生成无色气体的离子方程式是
(3)该同学最终确定原溶液中所含阳离子是
您最近一年使用:0次
解题方法
5 . 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为___________ 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________ 。
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):

①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是___________ 。
②反应一段时间后,装置D中观察到的现象___________ ;
装置D中发生反应的化学方程式为___________ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有___________ (填字母)。
a. NaOH溶液 b.KSCN溶液 c. Na2SO3溶液 d.碘水 e.氯水
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl
 SiHCl3+H2;
SiHCl3+H2;③SiHCl3与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为
(3)用SiHCl3与过量H2反应制备硅的装置如图(热源及夹持装置略去):

①装置B中的试剂是浓硫酸。装置C中的烧瓶需要加热,其目的是
②反应一段时间后,装置D中观察到的现象
装置D中发生反应的化学方程式为
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置中的空气。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有
a. NaOH溶液 b.KSCN溶液 c. Na2SO3溶液 d.碘水 e.氯水
您最近一年使用:0次
2021-03-30更新
|
356次组卷
|
3卷引用:广东省普宁市华美实验学校2020-2021学年高一下学期第一次月考化学试题
广东省普宁市华美实验学校2020-2021学年高一下学期第一次月考化学试题山西省怀仁市大地学校2020-2021学年高一下学期第三次月考化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
解题方法
6 . 某强酸性溶液X,含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是_______ ;对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_______ 。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的化学式为_______ ,沉淀G的化学式为_______ ,沉淀K的化学式为_______ ,实验中,可以观察到反应②的现象是_______ 。
(3)写出步骤①反应生成气体A的离子方程式_______ 。
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是
(2)气体F的化学式为
(3)写出步骤①反应生成气体A的离子方程式
(4)要使步骤③中,D、H2O、O2三种物质恰好发生化合反应,则D、H2O、O2物质的量之比是
您最近一年使用:0次
名校
7 . 已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
现进行如下实验操作(每次实验所加试剂均过量):
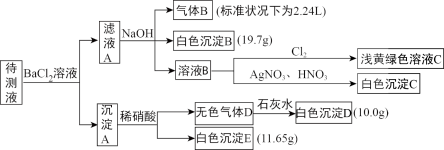
已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是___________ 。
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是___________ ,据此可以排除的离子是___________ 。
(3)由白色沉淀B可确定待测液中含有的离子是___________ 。
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是___________ 。
(5)综合分析,待测液中K+的最小浓度为___________ 。
| 阳离子 | K+、NH 、Mg2+、Ba2+、Fe3+ 、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、Br-、CO 、HCO 、HCO 、SO 、SO |

已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是
(3)由白色沉淀B可确定待测液中含有的离子是
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是
(5)综合分析,待测液中K+的最小浓度为
您最近一年使用:0次
2021-01-06更新
|
368次组卷
|
7卷引用:山西省实验中学2018届高三上学期学业质量监测化学试题
山西省实验中学2018届高三上学期学业质量监测化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题河北省辛集市高中2020-2021学年高二下学期期中考试化学试题(已下线)专题五 物质的量(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)吉林省长春市第五中学2022-2023学年高二下学期第三学程(期末)化学试题吉林省长春市实验中学2022-2023学年高二下学期期末考试化学试题
8 . 以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
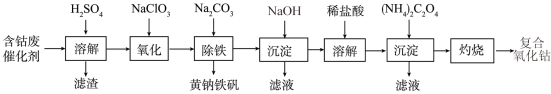
(1)用H2SO4溶解后过滤,得到的滤渣是____ (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是_________________________________ 。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是__________ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是_________________________________ 。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)已知CoCl2的溶解度曲线如图所示。
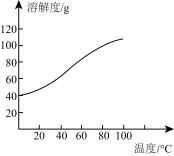
向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是_________________ 。

(1)用H2SO4溶解后过滤,得到的滤渣是
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(4)已知CoCl2的溶解度曲线如图所示。

向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是
您最近一年使用:0次
名校
9 . 某学习小组欲检测一失去标签的试剂瓶中固体物质的成分,将固体溶于水,形成的溶液中含有Na+、NH 、Mg2+、Fe2+、SO
、Mg2+、Fe2+、SO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种,取一定量待测液进行如下实验:
中的若干种,取一定量待测液进行如下实验:
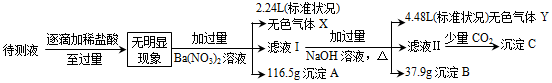
回答下列问题:
(1)该待测液中一定含有的离子是________ ;无法确定是否含有的离子是_______ ;
(2)沉淀B的成分及物质的量为___________________ (物质写化学式)。
(3)生成无色气体X时的离子方程式为________________ 。
(4)生成沉淀C时的离子反应方程式为________________ 。
(5)在催化剂、加热条件下气体X与气体Y可以反应转化为对环境无害的物质,该反应的化学方程式为__________ ,所得氧化产物与还原产物的质量之比为_________ 。
 、Mg2+、Fe2+、SO
、Mg2+、Fe2+、SO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种,取一定量待测液进行如下实验:
中的若干种,取一定量待测液进行如下实验:
回答下列问题:
(1)该待测液中一定含有的离子是
(2)沉淀B的成分及物质的量为
(3)生成无色气体X时的离子方程式为
(4)生成沉淀C时的离子反应方程式为
(5)在催化剂、加热条件下气体X与气体Y可以反应转化为对环境无害的物质,该反应的化学方程式为
您最近一年使用:0次
2020-12-02更新
|
265次组卷
|
4卷引用:山东省威海市威海文登区2021届高三上学期期中考试化学试题
山东省威海市威海文登区2021届高三上学期期中考试化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)吉林省吉化第一高级中学校2021-2022学年高二下学期复课检测化学试题
名校
10 . 二氧化铈 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
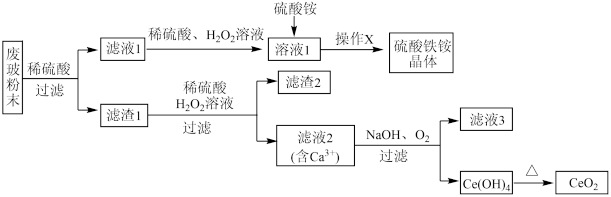
已知: 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。
回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、____ ;“操作X”是将溶液1______________ 、过滤、洗涤、干燥得到硫酸铁铵晶体。
(2)向滤液1中加入稀硫酸、 溶液的目的是
溶液的目的是______ 。滤渣1中加稀硫酸和溶液发生反应的离子方程式为_____________ 。
(3)要证明滤液1中含有 ,可选用的试剂为
,可选用的试剂为_________ 。
(4)由滤液2生成 的离子方程式为
的离子方程式为__________ 。
(5)取上述流程中得到的 产品
产品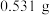 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为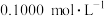 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗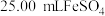 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为______ (结果保留两位有效数字)。
 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
已知:
 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、
(2)向滤液1中加入稀硫酸、
 溶液的目的是
溶液的目的是(3)要证明滤液1中含有
 ,可选用的试剂为
,可选用的试剂为(4)由滤液2生成
 的离子方程式为
的离子方程式为(5)取上述流程中得到的
 产品
产品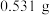 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为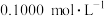 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗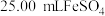 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-11-27更新
|
163次组卷
|
2卷引用:山东省济宁市泗水县2021届高三上学期期中考试化学试题



