解题方法
1 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子有_______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______ ,有关的离子方程式为_______ 。
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明液中肯定有_______ , 有关的离子方程式为_______ 。
(4)原溶液可能大量存在的阴离子是下列的_______ 。
A.Cl- B. C.
C.
(1)不做任何实验就可以肯定原溶液中不存在的离子有
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明液中肯定有
(4)原溶液可能大量存在的阴离子是下列的
A.Cl- B.
 C.
C.
您最近一年使用:0次
2022-09-17更新
|
477次组卷
|
4卷引用:吉林省乾安县第四中学2021-2022学年高一上学期期中考试化学试题
名校
2 . 某固体粉末样品中只可能含有Fe2+、Fe3+、Na+、 、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
①取适量样品加水溶解。
②取少量①中的待测液,滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变为血红色。
③另取少量①中的待测液,滴加过量的氢氧化钠溶液,除得到沉淀外,还有无色有刺激性气味的气体放出,该气体可使酚酞溶液变红。
(1)由上述实验可知,该样品中一定不含有的离子为_______ (填离子符号),一定含有的离子为_______ (填离子符号)。
(2)操作③中沉淀变化的现象为_______ 。
(3)操作③中生成刺激性气体的离子方程式为_______ 。
 、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:
、Cl﹣中的几种离子,某实验小组为确定其成分设计如下实验:①取适量样品加水溶解。
②取少量①中的待测液,滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变为血红色。
③另取少量①中的待测液,滴加过量的氢氧化钠溶液,除得到沉淀外,还有无色有刺激性气味的气体放出,该气体可使酚酞溶液变红。
(1)由上述实验可知,该样品中一定不含有的离子为
(2)操作③中沉淀变化的现象为
(3)操作③中生成刺激性气体的离子方程式为
您最近一年使用:0次
3 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
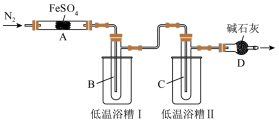
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)低温浴槽I收集的物质是_______ (填化学式),低温浴槽II控制的温度范围为_______ 。
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | -72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | -10 | -182.9 | -195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)低温浴槽I收集的物质是
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽I净增质量/g | 低温浴槽II净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
名校
4 . 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注。回答以下问题:
图1是工业上生产 的流程图:
的流程图:
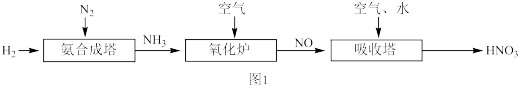
(1)与氮氧化物有关的全球性大气环境问题有_______。
(2)下列有关NH3的说法,不正确的是_______(填字母序号)。
(3) 极易溶于水,在标准状况下,用充满
极易溶于水,在标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为_______  。(保留3位有效数字)
。(保留3位有效数字)
(4)工业上常用氨气与硝酸反应制备化肥硝酸铵,写出检验铵根离子的实验方法:_______ 。
化学兴趣小组的同学利用下图进行 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
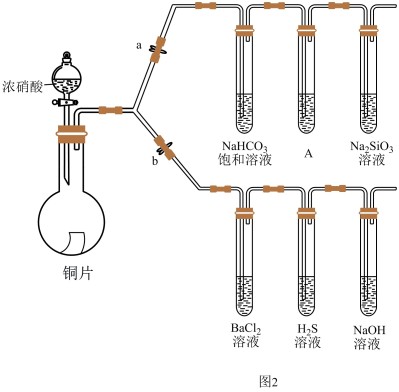
(5)首先,验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、检查装置气密性、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是_______ 。
③能说明碳的非金属性比硅强的实验现象是:_______ 。
(6)验证 的某些性质。
的某些性质。
①打开b,关闭a。
②硫化氢溶液中看到有淡黄色沉淀, 体现
体现_______ 。(选填“酸性氧化物”、“还原性”、“氧化性”)
③ 溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
写出其中 显示还原性生成沉淀的离子方程式:
显示还原性生成沉淀的离子方程式:_______ 。
图1是工业上生产
 的流程图:
的流程图:
(1)与氮氧化物有关的全球性大气环境问题有_______。
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
A.工业合成 属于人工固氮 属于人工固氮 | B. 易液化,液氨常用作制冷剂 易液化,液氨常用作制冷剂 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 | D. 制备NO体现了 制备NO体现了 的还原性 的还原性 |
 极易溶于水,在标准状况下,用充满
极易溶于水,在标准状况下,用充满 的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为
的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(4)工业上常用氨气与硝酸反应制备化肥硝酸铵,写出检验铵根离子的实验方法:
化学兴趣小组的同学利用下图进行
 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
(5)首先,验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、检查装置气密性、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。
②装置A中试剂是
③能说明碳的非金属性比硅强的实验现象是:
(6)验证
 的某些性质。
的某些性质。①打开b,关闭a。
②硫化氢溶液中看到有淡黄色沉淀,
 体现
体现③
 溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。
溶液中无明显现象,将其分成两份,分别滴加下列溶液,都产生了白色沉淀,将产生的沉淀的化学式填入下表相应位置。| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
写出其中
 显示还原性生成沉淀的离子方程式:
显示还原性生成沉淀的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 化合物X由3种元素组成。某兴趣小组按如下流程进行实验:

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有___________ ;X的化学式为___________ 。
(2)固体B的成分是___________ (用化学式表示)
(3)X化学性质相当活泼,1mol X吸收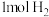 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式___________ 。
(4)设计实验证明溶液G中的阳离子___________ 。

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有
(2)固体B的成分是
(3)X化学性质相当活泼,1mol X吸收
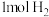 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式(4)设计实验证明溶液G中的阳离子
您最近一年使用:0次
2022-06-26更新
|
637次组卷
|
6卷引用:浙江省温州浙南名校联盟2021-2022学年高二下学期期末联考化学试题
浙江省温州浙南名校联盟2021-2022学年高二下学期期末联考化学试题浙江省舟山市普陀中学2023届高三返校考试化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷C 浙江省宁波市余姚中学2022-2023学年高二下学期3月月考化学试题 浙江省杭州市临平区杭州二中树兰高级中学2022-2023学年高二下学期第一次调研化学试题 (已下线)2019年高考浙江卷化学试题变式题(物质组成的测定)
6 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用下图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH·H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
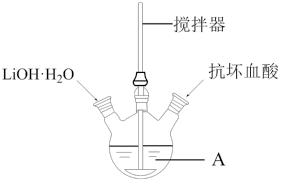
(1)仪器A的名称是_______ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为_______ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是_______ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是_______ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,_______ 、用蒸馏水洗涤沉淀、_______ 。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是_______ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为_______ %(保留小数点后1位)。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为
您最近一年使用:0次
7 . 某同学看到“利用零价铁还原 脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与
脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与 溶液的反应。实验过程如下:
溶液的反应。实验过程如下:

ⅰ.打开弹簧夹,缓慢通入 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行;
氛围中进行;
ⅱ.加入pH已调至2.5的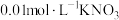 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
ⅳ.检测到滤液中存在 、
、 和
和 。
。
(1)通入 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是_______ 。
(2)白色物质是_______ ,用化学方程式解释其变为红褐色的原因:_______ 。
(3)用 ]检验滤液中
]检验滤液中 的实验方案是
的实验方案是_______ 。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是_______ 。
(5)该同学进一步查阅文献发现,用铁粉、碳粉混合物脱除硝酸盐,效果更佳。他用上述 溶液继续设计如下实验,探究碳粉的作用。
溶液继续设计如下实验,探究碳粉的作用。
③关于碳粉的作用,还可以提出的假设是_______ 。
 脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与
脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与 溶液的反应。实验过程如下:
溶液的反应。实验过程如下:
ⅰ.打开弹簧夹,缓慢通入
 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行;
氛围中进行;ⅱ.加入pH已调至2.5的
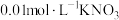 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
ⅳ.检测到滤液中存在
 、
、 和
和 。
。(1)通入
 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是(2)白色物质是
(3)用
 ]检验滤液中
]检验滤液中 的实验方案是
的实验方案是(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是
(5)该同学进一步查阅文献发现,用铁粉、碳粉混合物脱除硝酸盐,效果更佳。他用上述
 溶液继续设计如下实验,探究碳粉的作用。
溶液继续设计如下实验,探究碳粉的作用。| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 的浓度 的浓度 |  浓度无明显变化,说明假设1不成立 浓度无明显变化,说明假设1不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定 浓度 浓度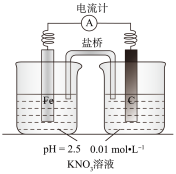 | ② |
您最近一年使用:0次
解题方法
8 . 从废旧磷酸铁锂电池正极材料(含 、铝箔、石墨粉等)中回收
、铝箔、石墨粉等)中回收 、
、 的工艺流程如下:
的工艺流程如下:

资料:
①碳酸锂及碳酸氢锂的溶解度随温度升高不断降低,杂质的溶解度相反。
②溴甲酚绿—甲基红是比甲基橙变色范围更小的指示剂, 以下为暗红色,
以下为暗红色,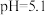 为灰绿色,
为灰绿色, 以上为绿色。
以上为绿色。
回答下列问题:
(1)“预处理”:旧电池拆解前进行放电处理有利于锂在正极的回收,其原因_______ 。
(2)“除铁”:向滤液1中加适量过氧化氢,得浅黄色溶液,滴入氢氧化钠,调节 ,搅拌1h后分离,得到固体沉淀铁黄(
,搅拌1h后分离,得到固体沉淀铁黄( )。除铁过程中发生反应的总离子反应方程式
)。除铁过程中发生反应的总离子反应方程式_______ ;检验浅黄色溶液中是否含 的操作是:
的操作是:_______ 。
(3)“沉锂”:向滤液2中加入饱和碳酸钠溶液沉锂。沉锂时的离子反应方程式为_______ ,得到碳酸锂沉淀的操作为_______ 。
a.静置,过滤b.加热后,趁热过滤c.蒸发浓缩、冷却结晶d.蒸发结晶
(4)“纯化”:选用碳化分解蒸发法纯化碳酸锂。机理如下:
碳化反应:
分解反应:

综合考虑,最适宜的碳化温度范围为_______ ,(“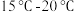 ”、“
”、“ ”、“
”、“ ”)。
”)。
解释二氧化碳流速一定时,碳酸锂回收率随温度升高而减小的原因:_______ 。
(5)碳酸锂纯度分析:取 碳酸锂产物配成
碳酸锂产物配成 溶液,取
溶液,取 于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的
于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的 的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸
的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸 ,冷却后继续滴定至暗红色,消耗盐酸
,冷却后继续滴定至暗红色,消耗盐酸 。实验中若不进行煮沸处理,则测定结果
。实验中若不进行煮沸处理,则测定结果_______ (“偏高”、“偏低”、“无影响”),计算样品纯度为_______ %(保留2位小数)。
 、铝箔、石墨粉等)中回收
、铝箔、石墨粉等)中回收 、
、 的工艺流程如下:
的工艺流程如下:
资料:
①碳酸锂及碳酸氢锂的溶解度随温度升高不断降低,杂质的溶解度相反。
②溴甲酚绿—甲基红是比甲基橙变色范围更小的指示剂,
 以下为暗红色,
以下为暗红色,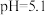 为灰绿色,
为灰绿色, 以上为绿色。
以上为绿色。回答下列问题:
(1)“预处理”:旧电池拆解前进行放电处理有利于锂在正极的回收,其原因
(2)“除铁”:向滤液1中加适量过氧化氢,得浅黄色溶液,滴入氢氧化钠,调节
 ,搅拌1h后分离,得到固体沉淀铁黄(
,搅拌1h后分离,得到固体沉淀铁黄( )。除铁过程中发生反应的总离子反应方程式
)。除铁过程中发生反应的总离子反应方程式 的操作是:
的操作是:(3)“沉锂”:向滤液2中加入饱和碳酸钠溶液沉锂。沉锂时的离子反应方程式为
a.静置,过滤b.加热后,趁热过滤c.蒸发浓缩、冷却结晶d.蒸发结晶
(4)“纯化”:选用碳化分解蒸发法纯化碳酸锂。机理如下:
碳化反应:

分解反应:


综合考虑,最适宜的碳化温度范围为
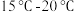 ”、“
”、“ ”、“
”、“ ”)。
”)。解释二氧化碳流速一定时,碳酸锂回收率随温度升高而减小的原因:
(5)碳酸锂纯度分析:取
 碳酸锂产物配成
碳酸锂产物配成 溶液,取
溶液,取 于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的
于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的 的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸
的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸 ,冷却后继续滴定至暗红色,消耗盐酸
,冷却后继续滴定至暗红色,消耗盐酸 。实验中若不进行煮沸处理,则测定结果
。实验中若不进行煮沸处理,则测定结果
您最近一年使用:0次
名校
解题方法
9 . 现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、 、Cl-、Ba2+、
、Cl-、Ba2+、 、
、 。现取3份100 mL该溶液分别进行如下实验:
。现取3份100 mL该溶液分别进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥,得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是_______ (填“一定存在”“一定不存在”或“不能确定”)。
(2)可以判断该待测液中一定含有的阴离子是_______ ,一定没有的阳离子是_______ 。还有一种阳离子没有检验,检验这种离子的实验方法是_______ ,确定该离子存在的现象是_______ 。
 、Cl-、Ba2+、
、Cl-、Ba2+、 、
、 。现取3份100 mL该溶液分别进行如下实验:
。现取3份100 mL该溶液分别进行如下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝;
第三份加入足量BaCl2溶液后,经过滤、洗涤、干燥,得到白色沉淀,再将沉淀经足量盐酸洗涤,发现沉淀部分溶解。
根据上述实验,试回答下列问题:
(1)由第一份进行的实验对Cl-是否存在的判断是
(2)可以判断该待测液中一定含有的阴离子是
您最近一年使用:0次
2021-12-29更新
|
153次组卷
|
2卷引用:江苏省徐州市第七中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
10 . 有5瓶白色固体试剂,分别是BaCl2、NaOH、Na2SO4、(NH4)2SO4、无水CuSO4,现只提供蒸馏水,通过下面的步骤就可以鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察到5种固体全部溶解,1支试管中得到蓝色溶液,被检出物质的化学式是___________ 。
(2)分别取四种未检出的溶液,往其中加入上述已检出的溶液,观察到1支试管中有白色沉淀生成,则被检出物质的化学式是___________ ,相应的离子方程式是___________ ;另1支试管中有蓝色沉淀生成,则被检出物质的化学式是___________ ,相应的离子方程式是___________ 。
(3)取(2)中产生蓝色沉淀的原无色溶液,分别加入尚未检出的最后两溶液中,并加热,有刺激性气味气体产生的原未知液是___________ 。
(1)各取适量固体试剂分别加入5支试管中,加入适量蒸馏水,振荡试管,观察到5种固体全部溶解,1支试管中得到蓝色溶液,被检出物质的化学式是
(2)分别取四种未检出的溶液,往其中加入上述已检出的溶液,观察到1支试管中有白色沉淀生成,则被检出物质的化学式是
(3)取(2)中产生蓝色沉淀的原无色溶液,分别加入尚未检出的最后两溶液中,并加热,有刺激性气味气体产生的原未知液是
您最近一年使用:0次
2021-12-02更新
|
80次组卷
|
3卷引用:吉林省长春市希望高中2021-2022学年高一上学期期中考试化学试题



