名校
1 . 硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:(已知:FeS2与H2SO4不反应)
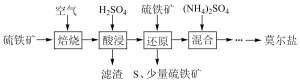
(1)莫尔盐属于____________ 。
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2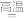 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________ ,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
(3)加H2SO4酸浸,发生反应的离子方程式为________________________________ 。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:_________________________________ 。
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中, _______________ 证明含有Fe2+和NH4+。

(1)莫尔盐属于
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2
 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有(3)加H2SO4酸浸,发生反应的离子方程式为
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于
您最近一年使用:0次
解题方法
2 . 某工业废催化剂含有 SiO2、ZnO、CuS、ZnS、Fe3O4 等物质,为落实“节约资源,变 废为宝”的环保理念,某课外兴趣小组的同学取 20g 该物质进行实验,回收其中的 Cu 和 Zn,实验方案如下:

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是______ 溶液。

(2)滤液Ⅰ中的 Fe2+最好用______ 来检验。
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是______ (填元素符号),由滤液Ⅱ、Ⅳ滤液获得 ZnSO4•7H2O 的操作是______________ 。
(4)第二次浸出时的化学方程式为_______________ 。
(5)加 A 调节溶液的 pH 约为______ 时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________ 。

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是

(2)滤液Ⅰ中的 Fe2+最好用
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是
(4)第二次浸出时的化学方程式为
(5)加 A 调节溶液的 pH 约为
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是
您最近一年使用:0次
名校
解题方法
3 . 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH 、Cl﹣、CO
、Cl﹣、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲;在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.{已知:NaAlO2+2H2O+CO2═NaHCO3+Al(OH)3↓}。根据上述实验回答:
(1)一定不存在的离子是____________ ,不能确定是否存在的离子是____________ .
(2)试确定溶液中肯定存在的离子及其浓度:
离子符号_________ ,浓度________________ ;
离子符号_________ ,浓度________________ ;
离子符号_________ ,浓度________________ .
(3)试确定K+是否存在________ ,判断的理由是________________________________
 、Cl﹣、CO
、Cl﹣、CO 、SO
、SO ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲;在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.{已知:NaAlO2+2H2O+CO2═NaHCO3+Al(OH)3↓}。根据上述实验回答:
(1)一定不存在的离子是
(2)试确定溶液中肯定存在的离子及其浓度:
离子符号
离子符号
离子符号
(3)试确定K+是否存在
您最近一年使用:0次
4 . 某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
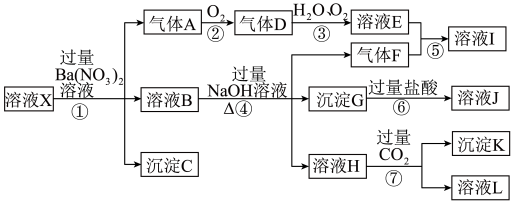
请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有______ 。
(2)产生气体A的离子方程式为____________ 。
(3)在实验室中收集气体A,可选择如图装置中的______ 。
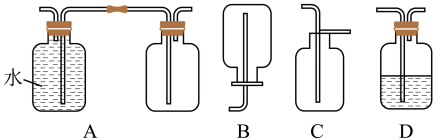
(4)写出④反应中生成溶液H的离子方程式____________ 。
(5)对不能确定是否存在的离子,请简述检测实验方案__________ 。

请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有
(2)产生气体A的离子方程式为
(3)在实验室中收集气体A,可选择如图装置中的

(4)写出④反应中生成溶液H的离子方程式
(5)对不能确定是否存在的离子,请简述检测实验方案
您最近一年使用:0次
2019-02-12更新
|
392次组卷
|
2卷引用:【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期末考试化学试题
10-11高二下·黑龙江哈尔滨·期末
解题方法
5 . 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 、Cl-、
、Cl-、 、
、 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是___________ ,不能确定是否存在的离子是___________ 。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号___________ ,浓度___________ ;
离子符号___________ ,浓度___________ ;
离子符号___________ ,浓度___________ 。
(3)试确定K+是否存在___________ (填“是”或“否”),判断的理由是___________ 。
 、Cl-、
、Cl-、 、
、 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验:①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):
离子符号
离子符号
离子符号
(3)试确定K+是否存在
您最近一年使用:0次
11-12高三上·黑龙江绥化·阶段练习
6 . 有一种白色粉末,含有下列阴离子和阳离子中的几种,阴离子:S2-、NO 、SO
、SO 、CO
、CO 、MnO
、MnO ,阳离子:Na+、Al3+、Ba2+、Fe3+、NH
,阳离子:Na+、Al3+、Ba2+、Fe3+、NH ,将该白色粉末进行下列实验,观察到的现象如下:
,将该白色粉末进行下列实验,观察到的现象如下:
a.取少量粉末加水振荡,现象是:全部溶解、溶液无色透明
b.向所得溶液中慢慢滴入苛性钠并加热,现象是:无明显现象
c.取少量粉末加盐酸,现象是:无明显现象
d.取少量粉末加稀硫酸和稀硝酸混合液,现象是:有不溶于稀硝酸的白色沉淀生成。
根据实验推断
(1)从a实验中可推断粉末中一定没有_______ 离子;
(2)从b实验中可推断粉末中一定没有_______ 离子;
(3)从c实验中可推断粉末中一定没有_______ 离子;
(4)从d实验中可推断粉末中必定含有_______ 离子;
(5)综上所述,粉末中还可能含有_______ 离子;
 、SO
、SO 、CO
、CO 、MnO
、MnO ,阳离子:Na+、Al3+、Ba2+、Fe3+、NH
,阳离子:Na+、Al3+、Ba2+、Fe3+、NH ,将该白色粉末进行下列实验,观察到的现象如下:
,将该白色粉末进行下列实验,观察到的现象如下:a.取少量粉末加水振荡,现象是:全部溶解、溶液无色透明
b.向所得溶液中慢慢滴入苛性钠并加热,现象是:无明显现象
c.取少量粉末加盐酸,现象是:无明显现象
d.取少量粉末加稀硫酸和稀硝酸混合液,现象是:有不溶于稀硝酸的白色沉淀生成。
根据实验推断
(1)从a实验中可推断粉末中一定没有
(2)从b实验中可推断粉末中一定没有
(3)从c实验中可推断粉末中一定没有
(4)从d实验中可推断粉末中必定含有
(5)综上所述,粉末中还可能含有
您最近一年使用:0次
7 . 某学习小组欲从含有[Cu(NH3)4]SO4、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵[CuSO4·(NH4)2SO4]固体,完成了如下实验:
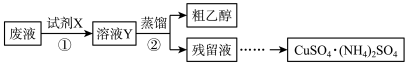
已知:[Cu(NH3)4]2++4H+==Cu2++4NH4+
请回答:
(1)步骤①中,试剂X应采用_____________________________________________ 。
(2)甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇含量明显偏低,可能的原因是_______________________________________________ 。
(3)设计实验方案验证硫酸铜铵固体中的NH4+___________________________________________

已知:[Cu(NH3)4]2++4H+==Cu2++4NH4+
请回答:
(1)步骤①中,试剂X应采用
(2)甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇含量明显偏低,可能的原因是
(3)设计实验方案验证硫酸铜铵固体中的NH4+
您最近一年使用:0次
2018-11-09更新
|
1173次组卷
|
3卷引用:浙江省普通高校招生选考科目2018年4月考试化学试题
浙江省普通高校招生选考科目2018年4月考试化学试题浙江省诸暨中学2019-2020学年高一下学期期中考试化学(学考)试题(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)
8 . 已知化合物X由3种元素组成,某学习小组进行了如下实验:
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是___________ (用元素符号表示);
(2)X与水反应的化学方程式是___________ ;
(3)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到Cl2O,写出该反应的化学方程式:___________ 。
①取适量X,加水完全溶解,无气体产生,溶液呈碱性;进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色;
②取1.685gX溶于水,加入含HCl 0.02000mol的盐酸恰好中和;中和后的溶液与硝酸酸化的过量AgNO3溶液反应,得到4.305g白色沉淀。
请回答:
(1)X中3种元素是
(2)X与水反应的化学方程式是
(3)X中一种元素对应的单质,可与足量的Na2CO3溶液反应得到Cl2O,写出该反应的化学方程式:
您最近一年使用:0次
2018-11-07更新
|
2369次组卷
|
6卷引用:2018年11月浙江省普通高校招生选考科目考试化学试题
2018年11月浙江省普通高校招生选考科目考试化学试题浙江省2019届高三11月选考科目考试化学试卷高一必修第一册(苏教2019版)专题3 C 高考挑战区 过模拟 2年模拟精编精练(已下线)【浙江新东方】8(已下线)【浙江新东方】高中化学20210513-030【2021】【高一下】(已下线)专题19.无机综合推断-十年(2012-2021)高考化学真题分项汇编(浙江专用)
9 . 氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
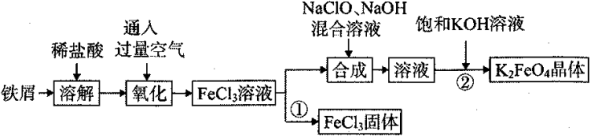
请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是____________ 。
(2)“合成”阶段生成Na2FeO4的离子方程式为___________________________ 。
(3)为了检验“氧化”过程中所得FeCl3 溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______ (填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性KMnO4溶液进行检验,请分析方案是否合理,并说明理由:____________ 。
(4)过程①制取FeCl3固体的具体操作步骤是__________________________ 。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于____ 。{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH 下,FeO42-的稳定性如下图所示:
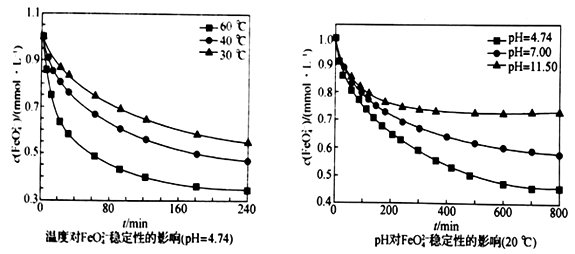
从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________ 。

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是
(2)“合成”阶段生成Na2FeO4的离子方程式为
(3)为了检验“氧化”过程中所得FeCl3 溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性KMnO4溶液进行检验,请分析方案是否合理,并说明理由:
(4)过程①制取FeCl3固体的具体操作步骤是
(5)在不同温度和不同pH 下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为
您最近一年使用:0次
2018-03-15更新
|
767次组卷
|
3卷引用:河北省衡水中学2018年高三下学期期初考试(3月)理综化学试题
名校
10 . 有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如图所示:
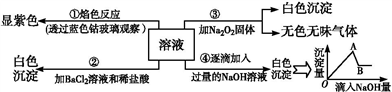
请你根据上图推断:
(1)原溶液中一定存在的阴离子有_______________ ,显___ (填“酸”“碱”或“中”)性。
(2)实验③中产生无色无味气体所发生的化学方程式为__________________________________ 。
(3)写出实验④中A点对应沉淀的化学式:__________ 。
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:________________________ 。

请你根据上图推断:
(1)原溶液中一定存在的阴离子有
(2)实验③中产生无色无味气体所发生的化学方程式为
(3)写出实验④中A点对应沉淀的化学式:
(4)写出实验④中,由A→B过程中所发生反应的离子方程式:
您最近一年使用:0次
2017-10-28更新
|
716次组卷
|
9卷引用:辽宁省实验中学分校2018届高三10月月考化学试题



