名校
解题方法
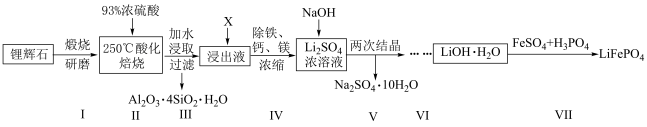
1 . 某课题组以锂辉石(主要成分为 ,还含有铁、钙、镁等元素)为原料,按下列流程制备
,还含有铁、钙、镁等元素)为原料,按下列流程制备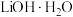 ,并制备锂离子电池正极材料
,并制备锂离子电池正极材料 。
。 不溶于水,能溶于强酸;
不溶于水,能溶于强酸;
② 晶体和
晶体和 晶体的溶解度随温度变化的曲线如图所示:
晶体的溶解度随温度变化的曲线如图所示:
(1)下列操作或描述不正确的是__________。
(2)步骤Ⅴ通过两次结晶,可得到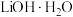 溶液和
溶液和 。需要用到下列操作:
。需要用到下列操作:
a.过滤; b.趁热过滤; c.冷却至0℃; d.用烧杯承接滤液;
e.在40℃时蒸发溶剂至溶液出现少量固体,停止加热;
f.在100℃时蒸发溶剂至溶液体积减小约原来一半,有固体析出,停止加热。
写出“两次结晶”的正确操作顺序_______ :____→____→d→____→____→____。
(3)在步骤Ⅶ,若将 和
和 的混合液滴加到
的混合液滴加到 溶液中,获得的产品纯度较低,请给出可能的原因:
溶液中,获得的产品纯度较低,请给出可能的原因:__________ 。
(4) 标准溶液浓度的测定:准确称取一定质量的硼砂
标准溶液浓度的测定:准确称取一定质量的硼砂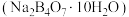 溶于水配成溶液,以如图装置测定
溶于水配成溶液,以如图装置测定 溶液的浓度。已知硼砂与
溶液的浓度。已知硼砂与 发生反应:
发生反应: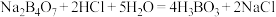 ,则锥形瓶内装入的溶液为
,则锥形瓶内装入的溶液为__________ ;若已知滴定终点pH为5.27,采用甲基橙作指示剂会导致 溶液浓度测定结果
溶液浓度测定结果__________ (填“偏高”、“偏低”或“无影响”)。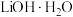 的质量分数(杂质主要为
的质量分数(杂质主要为 ,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为
,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为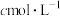 的标准
的标准 溶液滴定至溶液刚好褪色,消耗
溶液滴定至溶液刚好褪色,消耗 ,再加入甲基橙,继续用以上标准
,再加入甲基橙,继续用以上标准 溶液滴定至溶液刚好变色,又消耗
溶液滴定至溶液刚好变色,又消耗 。则样品中
。则样品中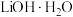 的质量分数为
的质量分数为__________ 。(已知: 溶液pH在8左右,且溶液的pH随浓度变化不大)
溶液pH在8左右,且溶液的pH随浓度变化不大)
 ,还含有铁、钙、镁等元素)为原料,按下列流程制备
,还含有铁、钙、镁等元素)为原料,按下列流程制备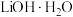 ,并制备锂离子电池正极材料
,并制备锂离子电池正极材料 。
。
 不溶于水,能溶于强酸;
不溶于水,能溶于强酸;②
 晶体和
晶体和 晶体的溶解度随温度变化的曲线如图所示:
晶体的溶解度随温度变化的曲线如图所示: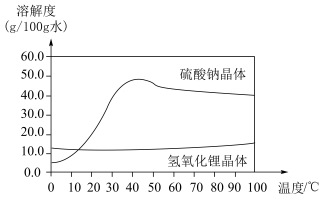
(1)下列操作或描述不正确的是__________。
A.步骤Ⅰ矿石研磨,可提高酸化焙烧效率,促进 的溶解 的溶解 |
B.步骤Ⅱ若减少浓硫酸用量,会导致 在步骤Ⅲ水解产生胶体吸附 在步骤Ⅲ水解产生胶体吸附 ,降低 ,降低 的浸出率 的浸出率 |
| C.模拟上述流程,步骤Ⅰ、Ⅲ所用的仪器有蒸发皿、烧杯、玻璃棒、耐酸过滤器及热源 |
D.步骤Ⅳ中加入的X可以是先加入 调节pH以除去 调节pH以除去 ,再加入 ,再加入 除尽 除尽 和 和 |
(2)步骤Ⅴ通过两次结晶,可得到
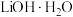 溶液和
溶液和 。需要用到下列操作:
。需要用到下列操作:a.过滤; b.趁热过滤; c.冷却至0℃; d.用烧杯承接滤液;
e.在40℃时蒸发溶剂至溶液出现少量固体,停止加热;
f.在100℃时蒸发溶剂至溶液体积减小约原来一半,有固体析出,停止加热。
写出“两次结晶”的正确操作顺序
(3)在步骤Ⅶ,若将
 和
和 的混合液滴加到
的混合液滴加到 溶液中,获得的产品纯度较低,请给出可能的原因:
溶液中,获得的产品纯度较低,请给出可能的原因:(4)
 标准溶液浓度的测定:准确称取一定质量的硼砂
标准溶液浓度的测定:准确称取一定质量的硼砂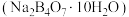 溶于水配成溶液,以如图装置测定
溶于水配成溶液,以如图装置测定 溶液的浓度。已知硼砂与
溶液的浓度。已知硼砂与 发生反应:
发生反应: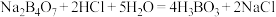 ,则锥形瓶内装入的溶液为
,则锥形瓶内装入的溶液为 溶液浓度测定结果
溶液浓度测定结果
 的质量分数(杂质主要为
的质量分数(杂质主要为 ,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为
,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为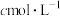 的标准
的标准 溶液滴定至溶液刚好褪色,消耗
溶液滴定至溶液刚好褪色,消耗 ,再加入甲基橙,继续用以上标准
,再加入甲基橙,继续用以上标准 溶液滴定至溶液刚好变色,又消耗
溶液滴定至溶液刚好变色,又消耗 。则样品中
。则样品中 的质量分数为
的质量分数为 溶液pH在8左右,且溶液的pH随浓度变化不大)
溶液pH在8左右,且溶液的pH随浓度变化不大)
您最近一年使用:0次
名校
2 . 某黄钾铁矾渣主要含有K2Fe6(SO4)4(OH)12及一定量的锌、铜、镉、镁等金属,为了综合利用减小污染,可用于制备锰锌铁氧体,其工艺流程如下图。

已知:溶液中FeSO4含量过高,在室温条件下容易发生结晶。常温下,相关物质的Ksp如下表。
回答下列问题:
(1)下列说法不正确的是___________。
(2)实验研究了温度、时间、铁粉用量等因素对浸出液还原的影响。实验中JJ-6数显直流恒速搅拌器转速为200 r/min,铁粉加入量是以溶液反应到pH=7时为理论量,此时铁粉加入比值量为1,实验结果如下图,通过对A、B点溶液中Fe3+的检测,Fe3+已经全部被还原。
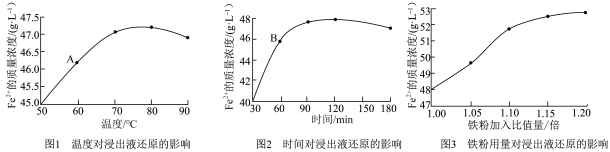
浸出液铁粉还原的最佳工艺条件___________ 。
(3)为确定调节成分时所需加入的ZnSO4、MnSO4的质量,需对除杂后溶液中的Zn2+进行检测。
准确量取25.00mL除杂后溶液,掩蔽铁后,用二甲酚橙作指示剂,用0.1000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为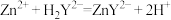 ),至滴定终点时消耗EDTA标准溶液22.50mL。通过计算确定该溶液中,Zn2+的浓度为
),至滴定终点时消耗EDTA标准溶液22.50mL。通过计算确定该溶液中,Zn2+的浓度为___________ g/L。
(4)用M2+表示Fe2+、Mn2+、Zn2+,共沉淀过程中,溶液pH与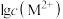 、
、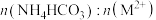 的关系如下图所示。为提高原料利用率,最好控制
的关系如下图所示。为提高原料利用率,最好控制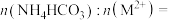
___________ 。

(5)锰锌铁氧体(MnxZn1-xFe2O4),,当x=0.2时具有较高的饱和磁场强度,用氧化物的形式可表示为___________ 。(最简整数比)。

已知:溶液中FeSO4含量过高,在室温条件下容易发生结晶。常温下,相关物质的Ksp如下表。
| 物质 | ZnS | FeS | CdS | MgF2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 1.3×10-24 | 6.3×10-18 | 8.0×10-27 | 7.42×10-11 | 3×10-39 | 8×10-16 | 1.2×10-11 |
(1)下列说法不正确的是___________。
| A.酸浸时,可通过增大酸的浓度及加热的方式加快酸浸速率 |
| B.浸出液中的Fe3+极易形成Fe(OH)3胶体造成过滤困难和带入大量杂质,因而需要加铁粉进行还原 |
| C.净化除杂过程中加入(NH4)2S的目的是除去溶液中的Cd2+,加入NH4F的目的是除去溶液中的Mg2+ |
| D.将滤液3蒸发结晶、过滤可获得纯净的(NH4)2SO4晶体 |

浸出液铁粉还原的最佳工艺条件
(3)为确定调节成分时所需加入的ZnSO4、MnSO4的质量,需对除杂后溶液中的Zn2+进行检测。
准确量取25.00mL除杂后溶液,掩蔽铁后,用二甲酚橙作指示剂,用0.1000mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Zn2+(反应原理为
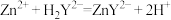 ),至滴定终点时消耗EDTA标准溶液22.50mL。通过计算确定该溶液中,Zn2+的浓度为
),至滴定终点时消耗EDTA标准溶液22.50mL。通过计算确定该溶液中,Zn2+的浓度为(4)用M2+表示Fe2+、Mn2+、Zn2+,共沉淀过程中,溶液pH与
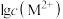 、
、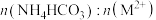 的关系如下图所示。为提高原料利用率,最好控制
的关系如下图所示。为提高原料利用率,最好控制

(5)锰锌铁氧体(MnxZn1-xFe2O4),,当x=0.2时具有较高的饱和磁场强度,用氧化物的形式可表示为
您最近一年使用:0次
2023-08-12更新
|
472次组卷
|
2卷引用:浙江省金丽衢十二校2022-2023学年高三上学期第一次联考化学试题
3 . 下列玻璃仪器在相应实验中选用不合理的是
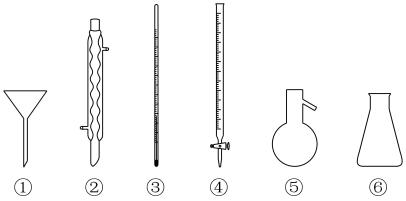
| A.重结晶法提纯苯甲酸:①②③ | B.蒸馏法分离CH2Cl2和CCl4:③⑤⑥ |
| C.浓硫酸催化乙醇制备乙烯:③⑤ | D.酸碱滴定法测定NaOH溶液浓度:④⑥ |
您最近一年使用:0次
2023-06-16更新
|
9718次组卷
|
20卷引用: 浙江省绍兴市诸暨市2023-2024学年高二上学期期末检测化学试题
浙江省绍兴市诸暨市2023-2024学年高二上学期期末检测化学试题2023年高考湖南卷化学真题(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)2023年湖南卷高考真题变式题(选择题1-5)(已下线)专题11 化学实验(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)第15讲物质的检验、分离和提纯(已下线)第14讲化学实验常用仪器及基本操作(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)实验04 强酸和强碱的中和滴定-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题(已下线)考点1 常见仪器使用和实验基本操作(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点3 物质的制备与性质实验 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第1讲 常用的仪器及基本操作(已下线)第3讲 物质制备实验的设计与评价(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省定远县育才学校2023-2024学年高二下学期期中化学试卷山东省淄博市2024届高三下学期三模化学试题
4 . 三氯化六氨合钴 在催化剂催化下的制备原理:
在催化剂催化下的制备原理: ,制备流程如下:
,制备流程如下:

已知:(1)三氯化六氨合钴相对分子质量267.5,不溶于乙醇,常温水中溶解度较小
(2)在强碱沸热的条件下分解,反应方程式为: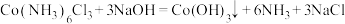
请回答:
(1) 除作为反应物外的作用是
除作为反应物外的作用是_______ 。
(2)下列说法不正确 的是_______ 。
A.活性炭是催化剂,固体2是活性炭
B.水溶液温度控制60℃,主要是控制反应速率
C.加入浓盐酸,析出产品的反应方程式为
D.抽滤时,开大水龙头,先转移溶液,再转移晶体
E.可用乙醇水溶液洗涤产品
(3)产品中 测定,用如图装置
测定,用如图装置
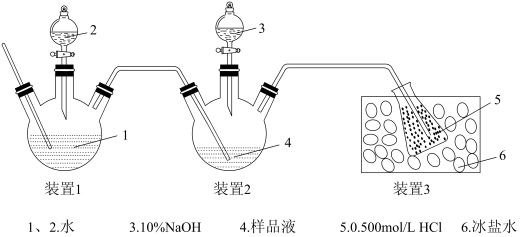
①选择正确的操作并排序_______ 。
A.加热装置2
B.检查装置气密性
C.称 产品和
产品和 水于三颈烧瓶,
水于三颈烧瓶, 于分液漏斗,将
于分液漏斗,将
 标准溶液于锥形瓶
标准溶液于锥形瓶
D.加热装置1,水蒸气通入装置2
E.用 标准溶液滴定盐酸,用酚酞作指示剂
标准溶液滴定盐酸,用酚酞作指示剂
F.用 标准溶液滴定盐酸,用甲橙红作指示剂
标准溶液滴定盐酸,用甲橙红作指示剂
②水蒸气的作用是_______ 。
(4)产品中 的测定:取上述已除
的测定:取上述已除 的样品液加入
的样品液加入 和适量盐酸溶液,于暗处放置5min,钴元素还原为
和适量盐酸溶液,于暗处放置5min,钴元素还原为 价,用
价,用 的
的 标准溶液滳定,用淀粉作指示剂,发应为
标准溶液滳定,用淀粉作指示剂,发应为 ,用去标准溶液
,用去标准溶液 。
。
①于暗处放置的原因是_______ 。
②滴定时 控制4左右,原因是
控制4左右,原因是_______ 。
③产品中钴的百分含量是_______ ,可能含有的杂质_______ 。
 在催化剂催化下的制备原理:
在催化剂催化下的制备原理: ,制备流程如下:
,制备流程如下:
已知:(1)三氯化六氨合钴相对分子质量267.5,不溶于乙醇,常温水中溶解度较小
(2)在强碱沸热的条件下分解,反应方程式为:
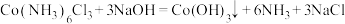
请回答:
(1)
 除作为反应物外的作用是
除作为反应物外的作用是(2)下列说法
A.活性炭是催化剂,固体2是活性炭
B.水溶液温度控制60℃,主要是控制反应速率
C.加入浓盐酸,析出产品的反应方程式为

D.抽滤时,开大水龙头,先转移溶液,再转移晶体
E.可用乙醇水溶液洗涤产品
(3)产品中
 测定,用如图装置
测定,用如图装置
①选择正确的操作并排序
A.加热装置2
B.检查装置气密性
C.称
 产品和
产品和 水于三颈烧瓶,
水于三颈烧瓶, 于分液漏斗,将
于分液漏斗,将
 标准溶液于锥形瓶
标准溶液于锥形瓶D.加热装置1,水蒸气通入装置2
E.用
 标准溶液滴定盐酸,用酚酞作指示剂
标准溶液滴定盐酸,用酚酞作指示剂F.用
 标准溶液滴定盐酸,用甲橙红作指示剂
标准溶液滴定盐酸,用甲橙红作指示剂②水蒸气的作用是
(4)产品中
 的测定:取上述已除
的测定:取上述已除 的样品液加入
的样品液加入 和适量盐酸溶液,于暗处放置5min,钴元素还原为
和适量盐酸溶液,于暗处放置5min,钴元素还原为 价,用
价,用 的
的 标准溶液滳定,用淀粉作指示剂,发应为
标准溶液滳定,用淀粉作指示剂,发应为 ,用去标准溶液
,用去标准溶液 。
。①于暗处放置的原因是
②滴定时
 控制4左右,原因是
控制4左右,原因是③产品中钴的百分含量是
您最近一年使用:0次
解题方法
5 . 下列有关实验的说法正确的是
| A.将乙醇和浓硫酸混合加热,产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明反应产生了乙烯 |
| B.用少量金属钠与胆矾晶体隔绝空气加热,产生红色固体,可证明金属性Na>Cu |
| C.用滴定法进行定量测定时,基准物应该具有性质稳定、相对分子质量较小等特点 |
| D.不慎溴腐蚀致伤时,先用酒精或甘油洗涤,再用水冲洗 |
您最近一年使用:0次
6 . 下列有关实验说法,正确的是
A.纸层析法分离 和 和 时,先将展开剂小心地沿试管内壁注入试管底部,然后将橡胶塞和点有试样的滤纸慢慢伸入试管内,使纸条末端浸入展开剂中,不要让试样点接触展开剂 时,先将展开剂小心地沿试管内壁注入试管底部,然后将橡胶塞和点有试样的滤纸慢慢伸入试管内,使纸条末端浸入展开剂中,不要让试样点接触展开剂 |
| B.氯化钠溶液含有少量硝酸钾,可用蒸发浓缩、冷却结晶来提纯氯化钠 |
| C.“静置”是实验过程中的常见操作,滴定管读数、移液管移液、萃取分液都有“静置”过程 |
D.可用 溶液区分NaCl、 溶液区分NaCl、 和 和 三种溶液 三种溶液 |
您最近一年使用:0次
名校
解题方法
7 .  (过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量
(过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量 等杂质)为原料制备过氧化钙及含量测定如下:
等杂质)为原料制备过氧化钙及含量测定如下:
(一)过氧化钙的制备流程
大理石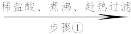 滤液
滤液
 滤渣
滤渣
 产品
产品
已知:
(1)仪器B的名称为___________
(2)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸,趁热过滤,将溶液煮沸的作用是___________
(3)步骤②的装置示意图如图,此步骤的关键是控制温度,步骤②涉及到的反应放热比较明显,所以通常用磁力搅拌、冷水浴、缓慢滴加反应物双氧水溶液,控制低温的目的是_____ (任说一点)

(二)过氧化钙的含量测定
(4)方法一:取0.1350g产品于锥形瓶中,先酸化生成 ,再用标准
,再用标准 溶液滴定生成的
溶液滴定生成的 ,平行测定多次。下列说法正确的是___________。
,平行测定多次。下列说法正确的是___________。
方法二:取0.1350g产品于硬质玻璃管中,加热,收集气体,平行测定多次。
(5)可用下图所示装置收集并测定气体的体积。

应该选择上述中的___________ (甲/乙)装置,原因是___________ 。
(6)方法二数据记录如下表(标况下),产品中过氧化钙的含量___________ (以质量分数表示)。
 (过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量
(过氧化钙)在医用防腐、消毒等方面应用广泛。它难溶于水、乙醇等溶剂,易溶于酸,温度过高易分解释放出氧气。实验室以大理石(含少量 等杂质)为原料制备过氧化钙及含量测定如下:
等杂质)为原料制备过氧化钙及含量测定如下:(一)过氧化钙的制备流程
大理石
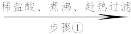 滤液
滤液
 滤渣
滤渣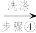
 产品
产品已知:

(1)仪器B的名称为
(2)步骤①的具体操作为逐滴加入适量稀盐酸,将溶液煮沸,趁热过滤,将溶液煮沸的作用是
(3)步骤②的装置示意图如图,此步骤的关键是控制温度,步骤②涉及到的反应放热比较明显,所以通常用磁力搅拌、冷水浴、缓慢滴加反应物双氧水溶液,控制低温的目的是

(二)过氧化钙的含量测定
(4)方法一:取0.1350g产品于锥形瓶中,先酸化生成
 ,再用标准
,再用标准 溶液滴定生成的
溶液滴定生成的 ,平行测定多次。下列说法正确的是___________。
,平行测定多次。下列说法正确的是___________。A. 溶液配制之后需要标定,标定 溶液配制之后需要标定,标定 溶液可以选择用配制的一定浓度的 溶液可以选择用配制的一定浓度的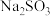 溶液进行滴定 溶液进行滴定 |
| B.称取0.1350g产品时,通电后,先将干燥、洁净的锥形瓶置于电子天平秤盘中央,待数字稳定后按归零键再缓缓加入所需质量的样品 |
C. 产品酸化在这里应该选择较低浓度的盐酸,若盐酸浓度过高会导致高锰酸钾氧化盐酸 产品酸化在这里应该选择较低浓度的盐酸,若盐酸浓度过高会导致高锰酸钾氧化盐酸 |
| D.读取滴定管中高锰酸钾溶液的体积的时候,可以把滴定管从滴定管夹上取下来,手持滴定管0刻度以上部分,读取管内液体的最高面 |
方法二:取0.1350g产品于硬质玻璃管中,加热,收集气体,平行测定多次。
(5)可用下图所示装置收集并测定气体的体积。

应该选择上述中的
(6)方法二数据记录如下表(标况下),产品中过氧化钙的含量
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 |  | 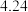 |
| 第2次 |  | 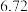 |
| 第3次 |  |  |
| 第4次 | 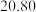 | 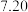 |
您最近一年使用:0次
8 . 磷酸铁(FePO4•2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列流程制备磷酸铁。已知:Na2HPO4溶液呈碱性

请回答:
(1)实验前废铁屑需用热的饱和碳酸钠溶液处理,其目的是___ 。
(2)步骤①要采用热水浴加热而不能用酒精灯直接加热,原因是___ 。
(3)①向步骤①滤液中加入H2O2之前应先精确量取一定体积的滤液用K2Cr2O7标准溶液滴定滤液中的Fe2+,其目的是___ 。
②滴定之前用来盛装K2Cr2O7标准溶液的滴定管需要润洗,润洗的具体操作是___ 。
③对于该滴定的相关操作叙述正确的是___ 。
A.可选用KSCN溶液做为滴定的指示剂,临近滴定终点时应缓慢滴加标准液或采用“半滴法”进行滴加
B.用移液管移取一定体积的待测液于用蒸馏水洗净的锥形瓶中,移液管使用完毕后应立即洗净并放在移液管架上
C.为了提高滴定结果的准确度,滴定过程中,滴定管尖嘴不能接触锥形瓶内壁
D.滴定过程中眼睛应注视锥形瓶内液体颜色变化以及标准液的流速
(4)步骤③中应将Na2HPO4溶液逐滴加入到溶液A中,如果将溶液A向Na2HPO4溶液中滴加得到的产品会有较多___ 杂质,产生该杂质的原因是___ 。

请回答:
(1)实验前废铁屑需用热的饱和碳酸钠溶液处理,其目的是
(2)步骤①要采用热水浴加热而不能用酒精灯直接加热,原因是
(3)①向步骤①滤液中加入H2O2之前应先精确量取一定体积的滤液用K2Cr2O7标准溶液滴定滤液中的Fe2+,其目的是
②滴定之前用来盛装K2Cr2O7标准溶液的滴定管需要润洗,润洗的具体操作是
③对于该滴定的相关操作叙述正确的是
A.可选用KSCN溶液做为滴定的指示剂,临近滴定终点时应缓慢滴加标准液或采用“半滴法”进行滴加
B.用移液管移取一定体积的待测液于用蒸馏水洗净的锥形瓶中,移液管使用完毕后应立即洗净并放在移液管架上
C.为了提高滴定结果的准确度,滴定过程中,滴定管尖嘴不能接触锥形瓶内壁
D.滴定过程中眼睛应注视锥形瓶内液体颜色变化以及标准液的流速
(4)步骤③中应将Na2HPO4溶液逐滴加入到溶液A中,如果将溶液A向Na2HPO4溶液中滴加得到的产品会有较多
您最近一年使用:0次
9 . 下列说法不正确的是
| A.棉短绒中的纤维素可在铜氨溶液中溶解,将形成的溶液压入酸中可得到质量更高的纤维 |
| B.实验室制备阿司匹林过程中加入饱和NaHCO3溶液的主要目的是除去未反应的水杨酸 |
| C.亚硝酸钠在建筑业中常用作混凝土掺加剂,在食品行业中不可作为食品添加剂 |
| D.在滴定实验中读取滴定管刻度数据,需先静置再取下滴定管读数 |
您最近一年使用:0次
解题方法
10 . 下列有关食醋总酸量测定过程中,不正确的是
| A.食醋的总酸量是指食醋中醋酸的总物质的量浓度 |
| B.配制待测食醋溶液时,用25mL移液管吸取市售食醋25mL,置于250mL容量瓶中,加水稀释至刻度,摇匀即得待测食醋溶液 |
| C.通常用酚酞作指示剂,滴至溶液呈粉红色且30s内不褪色,表明达到滴定终点 |
| D.为消除CO2对实验的影响,减少实验误差,配制NaOH溶液和稀释食醋的蒸馏水在实验前应加热煮沸2~3分钟,以尽可能除去溶解的CO2,并快速冷却至室温 |
您最近一年使用:0次



