名校
1 . 蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。
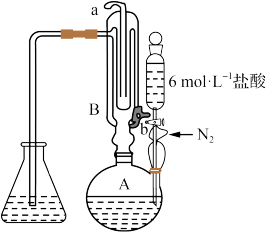
实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300mL;
锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液;
打开冷凝水,通氮气,滴入盐酸10mL;加热烧瓶A并保持微沸约3min后,用0.01000mol·L-1碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL。
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL。
(1)滴入盐酸前先通氮气一段时间作用是_________ ,测定过程中氮气的流速过快会导致测量结果__________ (填“偏大”“偏小”或“不变”)。
(2)滴定时锥形瓶中反应的离子方程式为________ ,滴定终点的现象是__________ 。
(3)空白实验的目的是___________ 。
(4)该中药中含SO2含量为_________ mg/kg。

实验步骤如下:
Ⅰ. SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300mL;
锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液;
打开冷凝水,通氮气,滴入盐酸10mL;加热烧瓶A并保持微沸约3min后,用0.01000mol·L-1碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL。
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL。
(1)滴入盐酸前先通氮气一段时间作用是
(2)滴定时锥形瓶中反应的离子方程式为
(3)空白实验的目的是
(4)该中药中含SO2含量为
您最近一年使用:0次
名校
2 . 研究小组用下图装置制取 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
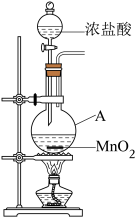
(1)仪器A的名称为____ ;A中反应的离子方程式为_____ 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为_____ 。
②不能证明产生的气体中含有 的实验是
的实验是____ (填字母序号).
(3)已知将 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:_____ 。
(4)已知: 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。
Ⅰ.测定X中溶解的 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用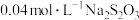 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。
Ⅱ.测定X中 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用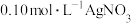 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。
由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有 ,则Ⅱ中消耗
,则Ⅱ中消耗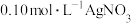 溶液的体积应大于
溶液的体积应大于___ mL(用含V的代数式表示)。
 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
(1)仪器A的名称为
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | ___________ |
| b |  溶液 溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有
 的实验是
的实验是(3)已知将
 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:(4)已知:
 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。Ⅰ.测定X中溶解的
 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用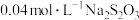 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。Ⅱ.测定X中
 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用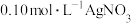 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有
 ,则Ⅱ中消耗
,则Ⅱ中消耗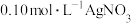 溶液的体积应大于
溶液的体积应大于
您最近一年使用:0次
名校
3 . 已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______ (填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______ (填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________ 。
(4)计算H2C2O4溶液的物质的量浓度为__________ mol/L。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
请回答:
(5)表中v1=______ 。
(6)实验中需要测量的数据是______________________________ 。
(7)实验中______ (填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________ 。
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/L KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会
(3)步骤②中到达滴定终点时的现象为
(4)计算H2C2O4溶液的物质的量浓度为
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
| 实验序号 | 体积V/mL | |||
| 0.1mol•L-1KMnO4溶液 | 0.11mol•L-1H2C2O4溶液 | 0.11mol•L-1H2SO4溶液 | H2O | |
| ① | 2.0 | 5.0 | 6.0 | 7.0 |
| ② | 2.0 | 8.0 | 6.0 | V1 |
| ③ | 2.0 | V2 | 6.0 | 2.0 |
(5)表中v1=
(6)实验中需要测量的数据是
(7)实验中
您最近一年使用:0次
2019-06-28更新
|
898次组卷
|
7卷引用:河北省衡水市滁州分校2018-2019学年高二上学期期中考试化学试题
名校
4 . 甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
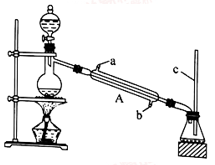
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
(1)装置中,仪器A的名称是_________________ ,长玻璃管c的作用是__________________________ 。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________ 。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________ 。
II.甲酸能脱水制取一氧化碳
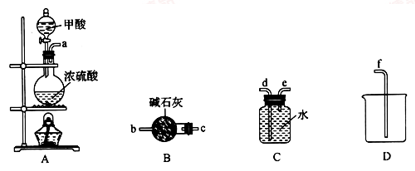
(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________ (按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________ 。
(3)一定条件下,CO能与NaOH 固体发生反应:CO+NaOH HCOONa。
HCOONa。
①为了证明“CO与NaOH 固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________ 。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0 g配制成100 mL溶液,量取20.00 mL该溶液于锥形瓶中,再加入___________ 作指示剂,用1.5 mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05 mL,则产物中甲酸钠的质量分数为_______ (计算结果精确到0.1%)。

I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
| 沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
| 甲醇 | 64.5 | 0.79 | 易溶 |
| 甲酸 | 100.7 | 1.22 | 易溶 |
| 甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(2)甲酸和甲醇进行酯化反应的化学方程式为
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→
(2)装置B的作用是
(3)一定条件下,CO能与NaOH 固体发生反应:CO+NaOH
 HCOONa。
HCOONa。①为了证明“CO与NaOH 固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0 g配制成100 mL溶液,量取20.00 mL该溶液于锥形瓶中,再加入
您最近一年使用:0次
2018-03-15更新
|
803次组卷
|
2卷引用:河北省衡水中学2018年高三下学期期初考试(3月)理综化学试题
5 . 三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。
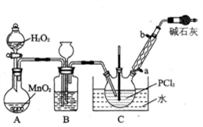
(1)仪器a的名称为_______________________________ ;
(2)装置C中生成POCl3的化学方程式为________________________________ ;
(3)实验中需控制通入O2的速率,对此采取的操作是_______________ ;
(4)装置B的作用除观察O2的流速之外,还有______________ ;
(5)反应温度应控制在60~65℃,原因是__________________________ ;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是_________________________________________ ;
(7)测得产品中n(POCl3)=___________________________ ;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将_______ 。(填偏高,偏低,或不变)
I.制备POCl3采用氧气氧化液态的PCl3法。实验装置(加热及夹持装置省略》及相关信息如下。

| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | ―112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈 水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置C中生成POCl3的化学方程式为
(3)实验中需控制通入O2的速率,对此采取的操作是
(4)装置B的作用除观察O2的流速之外,还有
(5)反应温度应控制在60~65℃,原因是
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液。
(6)达到终点时的现象是
(7)测得产品中n(POCl3)=
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,滴定结果将
您最近一年使用:0次
2018-02-06更新
|
632次组卷
|
2卷引用:河北省衡水中学2018届高三上学期九模考试理科综合化学试题
6 . 过氧化钙是一种在水产养殖中广泛使用的供氧剂。
(一)过氧化钙制备方法很多。
(1)【制备方法一】:
H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2· 8H2O,其化学方程式为________ 。
(2)【制备方法二】:
利用反应CaCl2+H2O2+2NH3· H2O+ 6 H2O =CaO2· 8H2O+ 2NH4Cl,在碱性环境中制取CaO2。用化学平衡原理解释NH3· H2O在Ca2+和H2O2的反应中所起的作用是_______ ;该反应需要在冰水浴条件下完成,原因是_______________ 。
(3)【制备方法三】
利用反应Ca(s)+O2 CaO2(s), 在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s), 在纯氧条件下制取CaO2,实验室模拟装置示意图如下:

请回答下列问题:
①装置A中反应的化学方程式为_____________ ;
②仪器a的名称为_____________ ;
③装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度:二是___________ 。
(二)水中溶氧量 ( DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg · L-1。测定原理为:
①碱性条件下,O2将Mn2+氧化为MnO(OH)2 : 2Mn2+ +O2+ 4OH-=2MnO(OH)2
②酸性条件下,MnO(OH)2将I-氧化为I2 : MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
③用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-
取加过一定量CaO2·8H2O的池塘水样l00.0mL,按上述方法测定水中溶氧量,消耗0.01mol/LNa2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是______________ 。
(2)该水样中的溶解氧量(DO)为______________ 。
(一)过氧化钙制备方法很多。
(1)【制备方法一】:
H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2· 8H2O,其化学方程式为
(2)【制备方法二】:
利用反应CaCl2+H2O2+2NH3· H2O+ 6 H2O =CaO2· 8H2O+ 2NH4Cl,在碱性环境中制取CaO2。用化学平衡原理解释NH3· H2O在Ca2+和H2O2的反应中所起的作用是
(3)【制备方法三】
利用反应Ca(s)+O2
 CaO2(s), 在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s), 在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
请回答下列问题:
①装置A中反应的化学方程式为
②仪器a的名称为
③装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度:二是
(二)水中溶氧量 ( DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg · L-1。测定原理为:
①碱性条件下,O2将Mn2+氧化为MnO(OH)2 : 2Mn2+ +O2+ 4OH-=2MnO(OH)2
②酸性条件下,MnO(OH)2将I-氧化为I2 : MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
③用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-
取加过一定量CaO2·8H2O的池塘水样l00.0mL,按上述方法测定水中溶氧量,消耗0.01mol/LNa2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是
(2)该水样中的溶解氧量(DO)为
您最近一年使用:0次
2017-08-30更新
|
329次组卷
|
2卷引用:河北省武邑中学2018届高三上学期第二次调研化学试题
2013·河北保定·一模
解题方法
7 . 重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO • Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如图,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
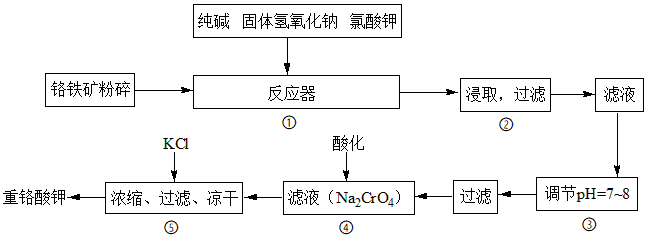
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_____ 。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:___ 。
(3)简要叙述操作③的目的:_______ 。
(4)操作④中,酸化时,CrO 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:
,写出平衡转化的离子方程式:_______ 。
(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度_______ (设整个过程中其它杂质不参与反应)。
 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
请回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Ai2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式:
(3)简要叙述操作③的目的:
(4)操作④中,酸化时,CrO
 转化为Cr2O
转化为Cr2O ,写出平衡转化的离子方程式:
,写出平衡转化的离子方程式:(5)称取重铬酸钾试样2. 5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O ),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
),若刚达到滴定终点共用去Na2S2O3标准溶液40.00mL,则所得产品重铬酸钾的纯度
您最近一年使用:0次



