1 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
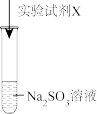 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
2 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_____ ,属于 S 元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是___________ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是___________ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于___________ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a 和 b 不是产生 S 的主要原因。
实验 iii:向 Na2S 溶液中加入___________ (填试剂),产生有臭鸡蛋气味的气体,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
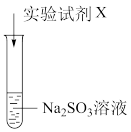 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a 和 b 不是产生 S 的主要原因。
实验 iii:向 Na2S 溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
2021-02-01更新
|
1108次组卷
|
4卷引用:甘肃省兰州第一中学2021-2022学年高一下学期4月月考化学试题
3 . 化学小组同学设计如下实验验证氯气的部分性质,并探究氯水的成分和性质。

回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)验证干燥的氯气没有漂白性的现象为_______ 。
(3)装置F的作用是_______ 。
(4)研究新制氯水的成分和性质。
以装置E的溶液进行下列实验:
资料:淀粉的特征反应——遇 变蓝色;
变蓝色; 。
。
①根据实验1可知,氧化性:
_______ (填“>”或“<”) 。
。
②实验2中证明溶液中含有_______ (填含氯微粒的分子式)。
③若用实验3证明氯水中含有氯离子,则实验操作为_______ 。
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭细口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是_______ (用化学方程式表示);保存氯水的方法为_______ 。


回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)验证干燥的氯气没有漂白性的现象为
(3)装置F的作用是
(4)研究新制氯水的成分和性质。
以装置E的溶液进行下列实验:
| 实验序号 | 实验1 | 实验2 | 实验3 |
| 实验操作 |  | 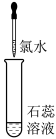 | |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 | 有白色沉淀生成 |
 变蓝色;
变蓝色; 。
。①根据实验1可知,氧化性:

 。
。②实验2中证明溶液中含有
③若用实验3证明氯水中含有氯离子,则实验操作为
(5)同学们发现久置的氯水会失去漂白性。为探究氯水失效的原因进行实验:用强光照射盛有氯水的密闭细口瓶,并用传感器测定数据,得到如图曲线。两图中曲线变化的原因是

您最近一年使用:0次
2022-11-15更新
|
99次组卷
|
2卷引用:甘肃省武威市民勤县第一中学2022-2023学年高一上学期期中考试化学试卷
4 . 某研究小组制备氯气并对产生氯气的条件进行探究。
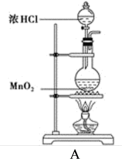
(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的_______ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是_______ 。(填写化学式)
(3)装置B用于吸收多余的Cl2,B中发生反应的离子方程式是_______ 。
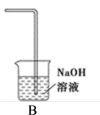
(4)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行探究:
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_______ 。
②Ⅱ中发生了分解反应,反应的化学方程式是_______ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:
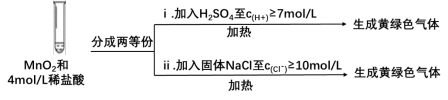
将实验Ⅲ、Ⅳ作对比,得出的结论是_______ ;
将ⅰ、ⅱ作对比,得出的结论是_______ 。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的
(2)A中产生的气体不纯,含有的杂质可能是
(3)装置B用于吸收多余的Cl2,B中发生反应的离子方程式是

(4)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行探究:
| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是
将ⅰ、ⅱ作对比,得出的结论是
您最近一年使用:0次
名校
解题方法
5 . 化学是以实验为基础的学科。下列根据实验操作和现象能得到相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下,将两块相同的未经打磨的铝片分别投入5.0mL饱和的 溶液和 溶液和 溶液中,前者无明显现象,后者迅速反应,现象明显 溶液中,前者无明显现象,后者迅速反应,现象明显 |  能加速破坏铝片表面的氧化膜 能加速破坏铝片表面的氧化膜 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口,木条复燃 溶液,将带火星的木条放在试管口,木条复燃 | 氧化性: |
| C | 向 溶液中加入 溶液中加入 溶液(pH=1),溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 溶液(pH=1),溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 |  和 和 的反应存在限度 的反应存在限度 |
| D | 将浓盐酸和亚硫酸钠反应产生的气体通入酸性 溶液中,溶液紫红色褪去 溶液中,溶液紫红色褪去 |  具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-27更新
|
492次组卷
|
6卷引用:选择题6-10
6 . 浓硫酸分别和三种钠盐反应,下列分析正确的是
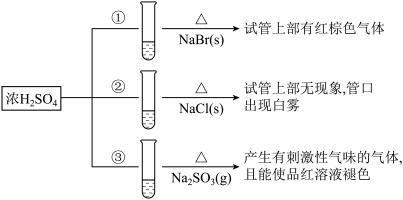
| A.对比①和②可以说明还原性Br->Cl- |
| B.①和③相比可说明氧化性Br2>SO2 |
| C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl |
| D.③中浓H2SO4被还原成SO2 |
您最近一年使用:0次
2020-11-07更新
|
1200次组卷
|
33卷引用:2016-2017学年甘肃省天水市第一中学高一下学期第一阶段考试化学试卷
2016-2017学年甘肃省天水市第一中学高一下学期第一阶段考试化学试卷上海市徐汇区2018届高三化学二模试卷(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质山西大学附中2020届高三上学期第二次模块诊断化学试题安徽省怀宁中学2020届高三上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的基本概念(基础过关)山东省淄博市2020届高三下学期第二次网考化学试题山东省济宁市汶上圣泽中学2019-2020学年高一下学期第二次月考化学试题北京首都师范大学第二附属中学2021届高三9月月考化学试题专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)广东省汕头市金山中学2021届高三下学期学科素养测试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高一下学期第一次考试化学试题河北省承德市隆化县存瑞中学2020-2021学年高二下学期期末联考化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省双鸭山市第一中学2020-2021学年高一下学期第一次月考化学试题新疆哈密市第十五中学2021-2022学年高三上学期第一次月考化学试题山东省泰安市2021-2022年高三上学期期中统考化学试题山东省泰安市2022届高三上学期期中考试化学试题(已下线)4.1.2 硫酸的工业制备 浓硫酸的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)上海外国语大学附属浦东外国语学校2021-2022学年高一下学期线上诊断化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题上海市川沙中学2020-2021学年高一下学期期中线上测试化学试题广州大学附属中学2021-2022学年高一下学期5月月考化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)3.1.2 浓硫酸和硫酸盐-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题(已下线)第15讲 硫酸-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第4讲 浓硫酸 不同价态含硫物质的转化上海市川沙中学2023-2024学年高一下学期期中考试化学试卷 吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷
7 . 浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( )


| A.①和③相比可说明氧化性:Br2>SO2 |
| B.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl |
| C.对比①和②可以说明还原性:Br->Cl- |
| D.③中的反应是利用浓硫酸的强氧化性 |
您最近一年使用:0次
2020-10-15更新
|
216次组卷
|
3卷引用:甘肃省武威第一中学2021届高三上学期第三次阶段性考试化学试题
名校
8 . 高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②FeO 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
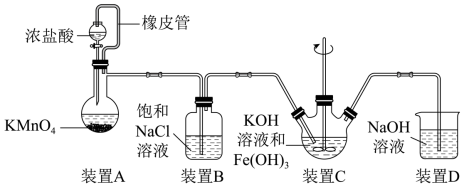
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是_______ ,橡胶管的作用是_______ 。
②装置B的作用是_______ 。
③装置C中的KOH溶液需过量,目的是_______ 。
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为_______
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该现象_______ (填“能”或“不能”)证明“酸性条件下FeO 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:_______ 。
(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为_______ 。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②FeO
 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是
②装置B的作用是
③装置C中的KOH溶液需过量,目的是
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2.该现象
 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为
您最近一年使用:0次
2021-09-07更新
|
316次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题
名校
9 . 高铁酸钾(K2FeO4)是一种绿色、高效的水处理剂。实验室设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
② 具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
(1)制备K2FeO4(夹持装置略)
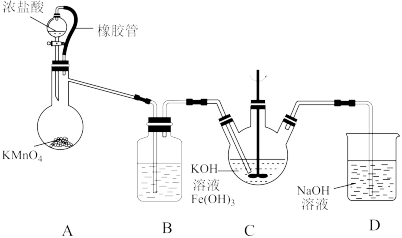
①如图所示,装置A为氯气发生装置,A中盛放KMnO4的仪器名称是__ ,橡胶管的作用是__ 。
②装置B中盛放的溶液是____ 。
③装置C中的KOH溶液需过量,目的是______ 。
④装置C中生成暗紫色固体K2FeO4的化学方程式为____ ,此外,氯气还与过量的KOH溶液反应,反应的离子方程式为____ 。
(2)探究K2FeO4的性质
某同学取装置C中的紫色溶液少许,加入稀硫酸,产生黄绿色气体,经检验气体中含有氯气。该现象________ (填“能”或“不能”)证明“酸性条件下 的氧化性强于Cl2”,理由是
的氧化性强于Cl2”,理由是________ 。
已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②
 具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:
具有强氧化性,在酸性或者中性溶液中能快速产生O2,在碱性溶液中较稳定。回答下列问题:(1)制备K2FeO4(夹持装置略)

①如图所示,装置A为氯气发生装置,A中盛放KMnO4的仪器名称是
②装置B中盛放的溶液是
③装置C中的KOH溶液需过量,目的是
④装置C中生成暗紫色固体K2FeO4的化学方程式为
(2)探究K2FeO4的性质
某同学取装置C中的紫色溶液少许,加入稀硫酸,产生黄绿色气体,经检验气体中含有氯气。该现象
 的氧化性强于Cl2”,理由是
的氧化性强于Cl2”,理由是
您最近一年使用:0次
10 . 某化学兴趣小组为探究铜跟浓硫酸的反应,用如下图所示装置进行有关实验。
(1)装置A中发生反应的化学方程式为_________________________________________ ;
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是________________ ,B中应放置的溶液是________ (填字母);
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(3)若装置C中盛有酸性KMnO4溶液,反应现象为_____________________ ,体现该气体的_____________ (填“氧化性”或“还原性”);
(4)装置D中试管口放置的棉花应浸一种溶液,这种溶液是_____________ ,其作用是___________ ;
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是________ 。

(1)装置A中发生反应的化学方程式为
(2)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(3)若装置C中盛有酸性KMnO4溶液,反应现象为
(4)装置D中试管口放置的棉花应浸一种溶液,这种溶液是
(5)实验中,取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是
您最近一年使用:0次



