名校
解题方法
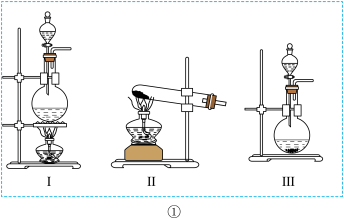
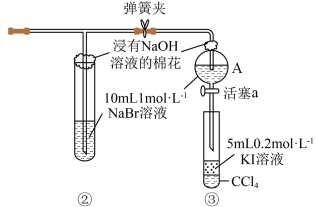
1 . 为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验。(夹持仪器已略去,气密性已检查)
i.打开弹簧夹,滴加浓盐酸,开始制备氯气。
ⅱ.当②中试管内和 处分液漏斗中的溶液都变为黄色时,夹紧弹簧夹。
处分液漏斗中的溶液都变为黄色时,夹紧弹簧夹。
ⅲ.当②中试管内溶液由黄色变为棕红色时,停止滴加浓盐酸。
ⅳ.……
(1)若以二氧化锰和浓盐酸为原料制取氯气,则装置①应选用___________ (填“I”“Ⅱ”或“Ⅲ”),其反应的离子方程式为___________ 。
(2)②中试管内发生反应的离子方程式是___________ 。
(3)为验证溴的氧化性强于碘,可进行的操作Ⅳ和预期的实验现象为___________ 。
(4)操作ⅲ实验的目的是___________ 。
(5)浸有 溶液的棉花可以吸收可能逸出的
溶液的棉花可以吸收可能逸出的 ,相关反应的离子方程式为
,相关反应的离子方程式为___________ 。
(6)解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
i.打开弹簧夹,滴加浓盐酸,开始制备氯气。
ⅱ.当②中试管内和
 处分液漏斗中的溶液都变为黄色时,夹紧弹簧夹。
处分液漏斗中的溶液都变为黄色时,夹紧弹簧夹。ⅲ.当②中试管内溶液由黄色变为棕红色时,停止滴加浓盐酸。
ⅳ.……
(1)若以二氧化锰和浓盐酸为原料制取氯气,则装置①应选用
(2)②中试管内发生反应的离子方程式是
(3)为验证溴的氧化性强于碘,可进行的操作Ⅳ和预期的实验现象为
(4)操作ⅲ实验的目的是
(5)浸有
 溶液的棉花可以吸收可能逸出的
溶液的棉花可以吸收可能逸出的 ,相关反应的离子方程式为
,相关反应的离子方程式为(6)解释氯、溴、碘单质的氧化性逐渐减弱的原因:
您最近一年使用:0次
7日内更新
|
16次组卷
|
2卷引用:山东省联考2023-2024学年高一下学期5月月考化学试题
名校
解题方法
2 . SO2是硫元素中一种重要物质。在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
a.写出SO2与FeCl3溶液反应的离子方程式:________________ 。
b.请设计实验方案检验溶液中是否还有 :
:_______________ 。
②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有________ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(熔点:SO2 ℃,SO3
℃,SO3 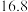 ℃,沸点SO2
℃,沸点SO2 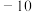 ℃,SO3 45℃)
℃,SO3 45℃)_____________ 。
②装置Ⅱ中冰水浴的作用是______________ ;若甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时酸性增强,则该反应的离子方程式是(忽略O2的影响)_____________ 。
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL 2.5mol/L NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是___________ 。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

a.写出SO2与FeCl3溶液反应的离子方程式:
b.请设计实验方案检验溶液中是否还有
 :
:②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有
A.浓硫酸 B.酸性KMnO4溶液
C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(熔点:SO2
 ℃,SO3
℃,SO3 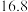 ℃,沸点SO2
℃,沸点SO2 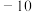 ℃,SO3 45℃)
℃,SO3 45℃)
②装置Ⅱ中冰水浴的作用是
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL 2.5mol/L NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
您最近一年使用:0次
名校
3 . 探究 与
与 对
对 分解的催化效率。
分解的催化效率。
(1)甲同学进行了如下的实验。
在两支试管中分别加入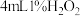 溶液,然后各滴加5滴
溶液,然后各滴加5滴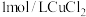 溶液和5滴
溶液和5滴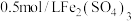 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。
甲由此得出了结论: 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。
乙同学认为甲的方案不太合理,做了如下的改进:
①乙认为甲方案不合理的理由有___________ (填选项符号)。
a. 溶液和
溶液和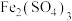 溶液的浓度不同
溶液的浓度不同
b.两种催化剂溶液中的阴离子不同
c. 溶液浓度过低
溶液浓度过低
②两支试管中产生气泡的速率先加快后又减慢的合理解释是:___________ 。
③根据实验结果,乙得出是结论是:___________ 。
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的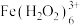 :
: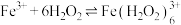 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:___________ 。
(3)乙同学在翻阅资料时还发现 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入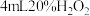 溶液,滴加几滴
溶液,滴加几滴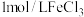 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入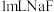 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
由此判断,下列说法正确的是___________ (填选项符号)。
a. 对
对 的分解几乎无催化作用
的分解几乎无催化作用
b.温度相同时,含相同浓度的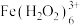 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大
c.颜色由棕褐色褪为无色时反应的离子方程式是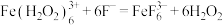
 与
与 对
对 分解的催化效率。
分解的催化效率。(1)甲同学进行了如下的实验。
在两支试管中分别加入
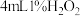 溶液,然后各滴加5滴
溶液,然后各滴加5滴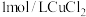 溶液和5滴
溶液和5滴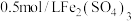 溶液。观察到两支试管中均只有极微量的气泡。
溶液。观察到两支试管中均只有极微量的气泡。甲由此得出了结论:
 与
与 对
对 分解的催化效率相似,且均不高。
分解的催化效率相似,且均不高。乙同学认为甲的方案不太合理,做了如下的改进:
| 试管1 | 试管2 | |
| 实验 | 在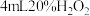 溶液中滴加5滴 溶液中滴加5滴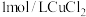 溶液 溶液 | 在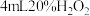 溶液中滴加5滴 溶液中滴加5滴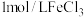 溶液 溶液 |
| 现象 | ⅰ.加入溶液后,产生气泡 ⅱ.生成气泡速率先加快后又减慢 ⅲ.整个过程中溶液始终保持浅蓝色。 ⅳ.且整个过程中产生气泡的速率低于试管2中。 | ⅰ.加入溶液后,试管内液体立即变为棕褐色,并产生气泡 ⅱ.生成气泡速率先加快后又减慢。 ⅲ.溶液棕褐色逐渐变浅,反应结束时变为浅黄色。 |
a.
 溶液和
溶液和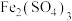 溶液的浓度不同
溶液的浓度不同b.两种催化剂溶液中的阴离子不同
c.
 溶液浓度过低
溶液浓度过低②两支试管中产生气泡的速率先加快后又减慢的合理解释是:
③根据实验结果,乙得出是结论是:
(2)研究试管2中出现“溶液变为棕褐色,最后变为浅黄色”的原因。
乙同学查阅文献,发现是因为
 会与
会与 发生如下反应生成棕褐色的
发生如下反应生成棕褐色的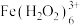 :
: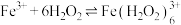 。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:
。结合化学反应原理解释“溶液颜色先变为棕褐色再变为黄色”的原因:(3)乙同学在翻阅资料时还发现
 与
与 能发生反应生成无色的
能发生反应生成无色的

他又做了如下的实验:
在一支试管中加入
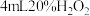 溶液,滴加几滴
溶液,滴加几滴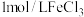 溶液,待出现大量气泡时,立即加入
溶液,待出现大量气泡时,立即加入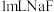 溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。
溶液,观察到溶液颜色立即由棕褐色褪为无色,且气泡立刻消失。由此判断,下列说法正确的是
a.
 对
对 的分解几乎无催化作用
的分解几乎无催化作用b.温度相同时,含相同浓度的
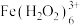 和
和 的溶液中
的溶液中 浓度后者的大
浓度后者的大c.颜色由棕褐色褪为无色时反应的离子方程式是
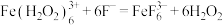
您最近一年使用:0次
名校
4 . 学习小组在实验室中利用如图所示装置制备 并进行相关性质的探究。回答下列问题:
并进行相关性质的探究。回答下列问题:_______ ,装置c中的现象是_______ ,可证明 具有
具有_______ 性。
(2)装置f的作用是_______ 。
(3)装置a中发生反应的化学方程式为_______ 。
(4)探究 在KI溶液体系中的反应产物。
在KI溶液体系中的反应产物。
实验开始后,发现装置d中的溶液迅速变黄,继续通入 ,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: 。但有同学提出上述可逆反应生成的
。但有同学提出上述可逆反应生成的 可与
可与 发生反应:
发生反应: 。为进一步探究体系中的产物,完成下列实验方案。
。为进一步探究体系中的产物,完成下列实验方案。
Ⅰ.取适量装置d中浊液,向其中滴加几滴_______ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,_______ ,出现白色沉淀,产物溶液中存在 。
。
综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_______ 。
 并进行相关性质的探究。回答下列问题:
并进行相关性质的探究。回答下列问题:
 具有
具有(2)装置f的作用是
(3)装置a中发生反应的化学方程式为
(4)探究
 在KI溶液体系中的反应产物。
在KI溶液体系中的反应产物。实验开始后,发现装置d中的溶液迅速变黄,继续通入
 ,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: 。但有同学提出上述可逆反应生成的
。但有同学提出上述可逆反应生成的 可与
可与 发生反应:
发生反应: 。为进一步探究体系中的产物,完成下列实验方案。
。为进一步探究体系中的产物,完成下列实验方案。Ⅰ.取适量装置d中浊液,向其中滴加几滴
Ⅱ.将装置d中浊液进行分离,得淡黄色固体和澄清溶液;取适量分离后的澄清溶液于试管中,
 。
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
名校
5 . 如图所示装置制备亚氯酸钠( )(已知:
)(已知: 与
与 在酸性条件下反应生成
在酸性条件下反应生成 )。回答下列问题。
)。回答下列问题。___________ 。
(2)写出A中的化学反应方程式___________ 。
(3)B中离子反应离子方程式为___________ 。
(4)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
方案I;向第一份溶液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
上述方案合理的是___________ (填“I”“II”或“III”);试管b中发生的离子方程式为___________ 。
②将气体X和 同时通入盛有
同时通入盛有 溶液的洗气瓶中,下列气体可能产生白色沉淀的是
溶液的洗气瓶中,下列气体可能产生白色沉淀的是___________ (填序号)。
① ②
② ③
③ ④
④
 )(已知:
)(已知: 与
与 在酸性条件下反应生成
在酸性条件下反应生成 )。回答下列问题。
)。回答下列问题。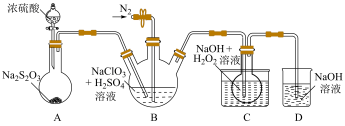
(2)写出A中的化学反应方程式
(3)B中离子反应离子方程式为
(4)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
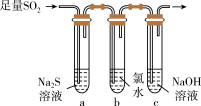
方案I;向第一份溶液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。上述方案合理的是
②将气体X和
 同时通入盛有
同时通入盛有 溶液的洗气瓶中,下列气体可能产生白色沉淀的是
溶液的洗气瓶中,下列气体可能产生白色沉淀的是①
 ②
② ③
③ ④
④
您最近一年使用:0次
名校
解题方法
6 . 某小组同学在室温下进行“碘钟实验”:将浓度均为0.01mol/L的H2O2、H2SO4、HI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。已知:“碘钟实验”的总反应的离子方程式为 ,反应分两步进行:
,反应分两步进行:
反应A:……;
反应B: 。
。
为探究溶液变蓝快慢的影响因素,进行实验I、Ⅱ(溶液浓度均为 ,试剂用量单位均为
,试剂用量单位均为 )。溶液从混合时的无色变为蓝色的时间:实验I是
)。溶液从混合时的无色变为蓝色的时间:实验I是 、实验Ⅱ是
、实验Ⅱ是 。
。
下列说法不正确的是
 ,反应分两步进行:
,反应分两步进行:反应A:……;
反应B:
 。
。为探究溶液变蓝快慢的影响因素,进行实验I、Ⅱ(溶液浓度均为
 ,试剂用量单位均为
,试剂用量单位均为 )。溶液从混合时的无色变为蓝色的时间:实验I是
)。溶液从混合时的无色变为蓝色的时间:实验I是 、实验Ⅱ是
、实验Ⅱ是 。
。下列说法不正确的是
| 试剂 实验序号 |  溶液 溶液 | 溶液 |  溶液 溶液 |  溶液(含淀粉) 溶液(含淀粉) |  |
| 实验I | 5 | 4 | 8 | 3 | 2 |
| 实验Ⅱ | 5 | 2 | x | y | z |
A.反应A的离子方程式是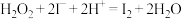 |
| B.对于总反应,I-的作用是催化剂 |
C.实验Ⅱ中,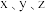 所对成的数值分别是8、3、2 所对成的数值分别是8、3、2 |
| D.对比实验I、Ⅱ,可得出的实验结论是其它条件不变,增大氢离子(或硫酸)浓度可以加快反应速率 |
您最近一年使用:0次
名校
7 .  具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备
具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备 并探究其性质,回答下列问题:
并探究其性质,回答下列问题: 的制备
的制备
实验小组设计如图11所示装置制备 ,反应原理为
,反应原理为 。
。
(1)仪器 的名称为
的名称为______ ,仪器 的作用为
的作用为______ 。
(2)写出实验室利用 固体和
固体和 固体制备
固体制备 的化学方程式:
的化学方程式:______
(3)已知 中含有一个
中含有一个 键,则其中硫元素的化合价为
键,则其中硫元素的化合价为______ 。
Ⅱ.探究 与KI的反应
与KI的反应
实验操作:取 溶液,滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,溶液颜色立即变蓝。
溶液,溶液颜色立即变蓝。
(4)经检验反应后的溶液中含 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式:______ 由此可得: 的氧化性
的氧化性______ (填“强于”或“弱于”) 。
。
(5)已知 可与
可与 发生反应:
发生反应: 。为进一步探究
。为进一步探究 与
与 反应的速率,该小组设计以下实验:
反应的速率,该小组设计以下实验:
实验ⅰ中溶液立即变色,实验ⅱ中溶液在 时变色。
时变色。
①实验中ⅱ
______ 。
②猜想加入 溶液后溶液变蓝的时间明显增长的可能原因:
溶液后溶液变蓝的时间明显增长的可能原因:
猜想一:______ ;
猜想二: 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。
 具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备
具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备 并探究其性质,回答下列问题:
并探究其性质,回答下列问题: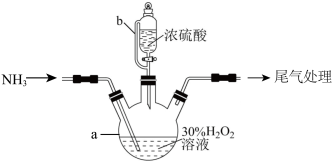
 的制备
的制备实验小组设计如图11所示装置制备
 ,反应原理为
,反应原理为 。
。(1)仪器
 的名称为
的名称为 的作用为
的作用为(2)写出实验室利用
 固体和
固体和 固体制备
固体制备 的化学方程式:
的化学方程式:(3)已知
 中含有一个
中含有一个 键,则其中硫元素的化合价为
键,则其中硫元素的化合价为Ⅱ.探究
 与KI的反应
与KI的反应实验操作:取
 溶液,滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,溶液颜色立即变蓝。
溶液,溶液颜色立即变蓝。(4)经检验反应后的溶液中含
 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式: 的氧化性
的氧化性 。
。(5)已知
 可与
可与 发生反应:
发生反应: 。为进一步探究
。为进一步探究 与
与 反应的速率,该小组设计以下实验:
反应的速率,该小组设计以下实验:试剂 | 实验ⅰ | 实验ⅱ |
| 4.0 | 4.0 |
| 0 | 1.0 |
蒸馏水的体积 | 4.0 |
|
| 2 | 2 |
|
| 2.0 |
 时变色。
时变色。①实验中ⅱ

②猜想加入
 溶液后溶液变蓝的时间明显增长的可能原因:
溶液后溶液变蓝的时间明显增长的可能原因:猜想一:
猜想二:
 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。
您最近一年使用:0次
8 . 下列方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 证明 和 和 光照下发生取代反应 光照下发生取代反应 | 将装有干燥 的集气瓶倒扣在装有干燥 的集气瓶倒扣在装有干燥 的集气瓶上,抽出玻璃片,置于光照条件下反应 的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则可证明 和 和 光照下发生取代反应 光照下发生取代反应 |
| B | 检验 溶液中是否含有 溶液中是否含有 | 将 溶液滴入到酸性 溶液滴入到酸性 溶液中 溶液中 | 观察到 溶液由紫红色变无色,证明 溶液由紫红色变无色,证明 溶液中含有 溶液中含有 |
| C | 探究 、 、 、 、 的氧化性强弱 的氧化性强弱 | 先向NaBr溶液中通入足量 ,再将通入 ,再将通入 后的溶液加入 后的溶液加入 淀粉溶液中 淀粉溶液中 | NaBr溶液变橙黄色,KI淀粉溶液变蓝色,证明氧化性 |
| D | 浓硫酸滴入蔗糖中,产生的气体通入澄清石灰水 | 蔗糖变黑、体积膨胀,澄清石灰水变浑浊 | 浓硫酸具有脱水性和强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 下列实验操作及现象能得出相应结论的是
| 选项 | 实验提作 | 现象 | 始论 |
| A | 在试管中加入少量淀粉和适量稀碳酸,加热一段时间,待溶液冷却后,加入新制氢氧化铜,加热 | 未观察到砖红色沉淀生成 | 淀粉未发生水解 |
| B | 向装有 和 和 的试管中分别滴加盐酸 的试管中分别滴加盐酸 | 装 的试管中产生黄绿色气体,装 的试管中产生黄绿色气体,装 的试管中无明显现象 的试管中无明显现象 | 氧化性: |
| C | 向蛋白质溶液中加入浓NaOH溶液 | 出现浑浊 | 蛋白质在NaOH溶液中发生了水解,生成了氨基酸 |
| D | 往75%的医用酒精中加入一小粒Na | 钠表面有大量气泡产生 | 钠能与 反应产生 反应产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 某科学小组为研究不同价态含硫物质的转化设计了如图实验,请回答有关问题。___________ 。该反应体现了浓硫酸的___________ 性。
(2)B处实验现象是___________ ,由此推测硫元素从+4价变为+6价。
(3)检验B处有 生成的方法是
生成的方法是___________ 。
(4)C处观察到蘸有Na2S溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是___________ 。
(5)D装置的作用是___________ ,发生反应的离子方程式为___________ 。

(2)B处实验现象是
(3)检验B处有
 生成的方法是
生成的方法是(4)C处观察到蘸有Na2S溶液的棉花上出现黄色固体,可推测此反应过程中硫元素的价态变化分别是
(5)D装置的作用是
您最近一年使用:0次

 溶液的体积
溶液的体积
 溶液的体积
溶液的体积
 淀粉溶液的体积/滴
淀粉溶液的体积/滴 溶液的体积
溶液的体积


