1 .  呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备
呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备 并探究其性质。
并探究其性质。
实验(一):制备
资料显示: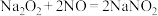 。
。 都能与酸性
都能与酸性 溶液反应。
溶液反应。
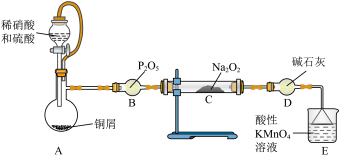
(1)D装置作用是___________ 。
(2)C装置中发生反应的现象是___________ 。
(3)已知: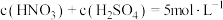 ,当
,当
___________ 时等体积混酸溶解铜的质量最大。
实验(二):测定产品纯度
称取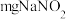 产品溶于蒸馏水配制成
产品溶于蒸馏水配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶,加入适量稀硫酸,用
配制的溶液于锥形瓶,加入适量稀硫酸,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 。
。
(4)该产品纯度为___________ (用含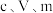 的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果
的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果___________ (填“偏高”“偏低”或“无影响”)。
实检(三):探究影响 水解程度的外界因素
水解程度的外界因素
为了探究外界条件对 水解程度的影响,设计如下实验:
水解程度的影响,设计如下实验:
(5)
___________ 。设计实验Ⅰ、Ⅱ的目的是___________ 。
(6)根据相关原理,小组预测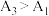 ,实验测得结果:
,实验测得结果: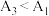 。理论预测和实验结果矛盾,其原因可能是
。理论预测和实验结果矛盾,其原因可能是___________ 。
 呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备
呈白色粉末状,是一种化工品,常用作腌制食品的防腐剂。某小组设计实验制备 并探究其性质。
并探究其性质。实验(一):制备

资料显示:
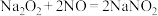 。
。 都能与酸性
都能与酸性 溶液反应。
溶液反应。
(1)D装置作用是
(2)C装置中发生反应的现象是
(3)已知:
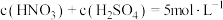 ,当
,当
实验(二):测定产品纯度
称取
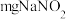 产品溶于蒸馏水配制成
产品溶于蒸馏水配制成 溶液,准确量取
溶液,准确量取 配制的溶液于锥形瓶,加入适量稀硫酸,用
配制的溶液于锥形瓶,加入适量稀硫酸,用 标准溶液滴定至终点,消耗滴定液
标准溶液滴定至终点,消耗滴定液 。
。(4)该产品纯度为
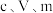 的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果
的代数式表示),若滴定前仰视读数,终点时俯视读数,测得结果实检(三):探究影响
 水解程度的外界因素
水解程度的外界因素为了探究外界条件对
 水解程度的影响,设计如下实验:
水解程度的影响,设计如下实验:| 原号 | 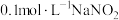 溶液 溶液 | 蒸馏水 | 水浴温度 | 溶液 |
| Ⅰ |  | 0 |  |  |
| Ⅱ |  |  |  |  |
| Ⅲ |  | 0 | 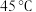 |  |
(5)

(6)根据相关原理,小组预测
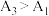 ,实验测得结果:
,实验测得结果: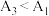 。理论预测和实验结果矛盾,其原因可能是
。理论预测和实验结果矛盾,其原因可能是
您最近一年使用:0次
名校
解题方法
2 . 某小组同学依据性质差异,采用比较的方法设计实验鉴别 和
和 。
。
(1)实验Ⅰ中,分别向两支试管中滴加几滴水, 中温度计示数略有降低,
中温度计示数略有降低, 中温度计示数升高。说明固体
中温度计示数升高。说明固体 溶解于水的过程中
溶解于水的过程中_______ (填“放出”或“吸收”)热量,可判断固体b为 。
。
(2)实验Ⅱ中,向试管 和
和 中分别加入
中分别加入 水,充分振荡,试管
水,充分振荡,试管 中固体有剩余,试管D中固体完全溶解。
中固体有剩余,试管D中固体完全溶解。
①判断固体 为
为_______ 。
②分别向两支试管中滴加2滴酚酞,_______ 试管中红色较深。
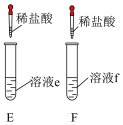
(3)实验Ⅲ中,分别向溶液 和溶液
和溶液 中逐滴加入稀盐酸,
中逐滴加入稀盐酸, 中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。用离子方程式解释E中开始无气泡产生的原因
中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。用离子方程式解释E中开始无气泡产生的原因_______ 。
(4)请你再设计一个鉴别固体 和
和 的实验方案
的实验方案_______ 。
(5)写出 在水中电离的方程式
在水中电离的方程式_______ 。
 和
和 。
。| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
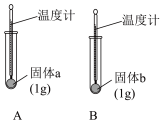 |  |  |
(1)实验Ⅰ中,分别向两支试管中滴加几滴水,
 中温度计示数略有降低,
中温度计示数略有降低, 中温度计示数升高。说明固体
中温度计示数升高。说明固体 溶解于水的过程中
溶解于水的过程中 。
。(2)实验Ⅱ中,向试管
 和
和 中分别加入
中分别加入 水,充分振荡,试管
水,充分振荡,试管 中固体有剩余,试管D中固体完全溶解。
中固体有剩余,试管D中固体完全溶解。①判断固体
 为
为②分别向两支试管中滴加2滴酚酞,
(3)实验Ⅲ中,分别向溶液
 和溶液
和溶液 中逐滴加入稀盐酸,
中逐滴加入稀盐酸, 中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。用离子方程式解释E中开始无气泡产生的原因
中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。用离子方程式解释E中开始无气泡产生的原因(4)请你再设计一个鉴别固体
 和
和 的实验方案
的实验方案(5)写出
 在水中电离的方程式
在水中电离的方程式
您最近一年使用:0次
3 . 小组同学用 晶体和蒸馏水、稀硫酸配制
晶体和蒸馏水、稀硫酸配制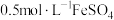 溶液(pH为3.3)。
溶液(pH为3.3)。 后,溶液变黄。
后,溶液变黄。 后,产生黄褐色沉淀,此时测得上层清液
后,产生黄褐色沉淀,此时测得上层清液 为1.4。
为1.4。
(1)取少量黄色溶液,_______ (填操作和现象),证明黄色溶液中含有 。
。
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为_______ 。
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的 将
将 氧化,反应的离子方程式为
氧化,反应的离子方程式为_______ 。
②用 和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
a.实验Ⅲ和Ⅳ说明_______ 对溶液变黄快慢有影响。
b.实验Ⅱ比Ⅰ更快变黄的原因是_______ 。
(4)检验黄褐色沉淀的成分。
通过进一步实验证实黄褐色沉淀为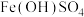 ,将反应的离子方程式补充完整:
,将反应的离子方程式补充完整:_______ 。
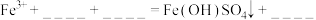 。
。
(5)根据以上实验,用 晶体和蒸馏水配制
晶体和蒸馏水配制 溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和
溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和_______ 。
 晶体和蒸馏水、稀硫酸配制
晶体和蒸馏水、稀硫酸配制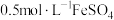 溶液(pH为3.3)。
溶液(pH为3.3)。 后,溶液变黄。
后,溶液变黄。 后,产生黄褐色沉淀,此时测得上层清液
后,产生黄褐色沉淀,此时测得上层清液 为1.4。
为1.4。(1)取少量黄色溶液,
 。
。(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的
 将
将 氧化,反应的离子方程式为
氧化,反应的离子方程式为②用
 和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
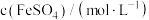 | 0.5 | 0.25 | 0.5 | 0.25 |
溶液 | 3.3 | 3.5 | 2.9 | 2.9 |
| 初始颜色 | 浅绿色 | 浅绿色,比Ⅰ浅 | 浅绿色,同Ⅰ | 浅绿色,同Ⅱ |
 颜色 颜色 | 浅绿色 | 黄绿色 | 浅绿色 | 浅绿色 |
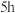 颜色 颜色 | 黄色 | 黄色 | 浅黄色 | 浅黄色(比Ⅲ浅) |
b.实验Ⅱ比Ⅰ更快变黄的原因是
(4)检验黄褐色沉淀的成分。
通过进一步实验证实黄褐色沉淀为
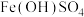 ,将反应的离子方程式补充完整:
,将反应的离子方程式补充完整: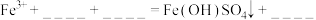 。
。(5)根据以上实验,用
 晶体和蒸馏水配制
晶体和蒸馏水配制 溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和
溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和
您最近一年使用:0次
名校
4 . 铁及其化合物在生产生活中具有重要的应用,高铁酸钾 是一种高效水处理剂,紫色固体.已知
是一种高效水处理剂,紫色固体.已知 具有下列性质:①可溶于水,溶液为紫色,微溶于浓
具有下列性质:①可溶于水,溶液为紫色,微溶于浓 溶液;②在
溶液;②在 、强碱性溶液中比较稳定.某实验小组制备并探究
、强碱性溶液中比较稳定.某实验小组制备并探究 性质,回答下列问题:
性质,回答下列问题:
(1)制备 (夹持装置略):
(夹持装置略):
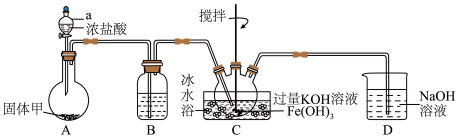
①A为氯气发生装置,其中仪器a的名称是______ ,固体甲的化学式为______ ,浓盐酸在该反应中表现的性质为______ ;将A中混合气体通过装置B可除去杂质,以免影响实验,B中的试剂是______ ;
②C为制备 的装置,采用冰水浴的原因是
的装置,采用冰水浴的原因是______ , 与
与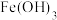 在碱性环境中反应生成
在碱性环境中反应生成 ,该氧化还原反应中氧化剂与还原剂的物质的量之比为
,该氧化还原反应中氧化剂与还原剂的物质的量之比为______ ;
③D为尾气处理装置,发生反应的离子方程式为______ 。
(2)探究 的性质:
的性质:
根据实验1和2的现象, 在酸性条件下发生反应,配平下列反应,用双线桥表示转移电子的方向和数目:
在酸性条件下发生反应,配平下列反应,用双线桥表示转移电子的方向和数目:______ 。
__ ___
___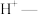 ___
___ ___
___ ___
___
 是一种高效水处理剂,紫色固体.已知
是一种高效水处理剂,紫色固体.已知 具有下列性质:①可溶于水,溶液为紫色,微溶于浓
具有下列性质:①可溶于水,溶液为紫色,微溶于浓 溶液;②在
溶液;②在 、强碱性溶液中比较稳定.某实验小组制备并探究
、强碱性溶液中比较稳定.某实验小组制备并探究 性质,回答下列问题:
性质,回答下列问题:(1)制备
 (夹持装置略):
(夹持装置略):
①A为氯气发生装置,其中仪器a的名称是
②C为制备
 的装置,采用冰水浴的原因是
的装置,采用冰水浴的原因是 与
与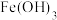 在碱性环境中反应生成
在碱性环境中反应生成 ,该氧化还原反应中氧化剂与还原剂的物质的量之比为
,该氧化还原反应中氧化剂与还原剂的物质的量之比为③D为尾气处理装置,发生反应的离子方程式为
(2)探究
 的性质:
的性质:| 实验1 | 取少量C中紫色溶液,加入过量稀硫酸,迅速产生大量气体,该气体能使带火星的木条复燃 |
| 实验2 | 取实验1中的溶液,滴加 溶液至过量,溶液呈红色. 溶液至过量,溶液呈红色. |
 在酸性条件下发生反应,配平下列反应,用双线桥表示转移电子的方向和数目:
在酸性条件下发生反应,配平下列反应,用双线桥表示转移电子的方向和数目:__
 ___
___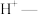 ___
___ ___
___ ___
___
您最近一年使用:0次
名校
5 . I.无水四氯化锡(SnCl4)用于制作FTO导电玻璃,FTO导电玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等领域,可用如图所示装置制备四氯化锡。
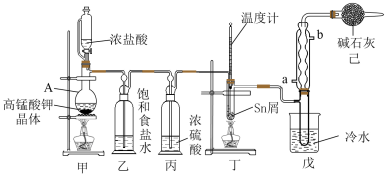
有关信息如下表所示:
(1)仪器A中发生反应的化学方程为_______ 。
(2)将装置按图示连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。装置已的作用是_______ 。
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是_______ 。
(4)下列有关配制过程的说法正确的是_______(填序号)。
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
(6)若假设2正确,向20L上述浓度的FeBr2溶液中通入标准状况下56LCl2,反应的离子方程式为_______ 。

有关信息如下表所示:
| 化学式 | Sn | SnCl2 | SnCl4 |
| 熔点/°C | 232 | 247 | -34 |
| 沸点/°C | 2602 | 623 | 114 |
| 其他性质 | 银白色固体 | 无色晶体,Sn2+易被Fe3+、I2等氧化为Sn4+ | 无色液体,易溶于水并能与水反应 |
(1)仪器A中发生反应的化学方程为
(2)将装置按图示连接好,先检查装置的气密性,再慢慢滴入浓盐酸,待观察到装置丁内充满黄绿色气体后,开始加热装置丁。装置已的作用是
II.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了以下实验:
i.实验需要90mL0.10mol·L-1FeBr2溶液
(3)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需要的玻璃仪器是
(4)下列有关配制过程的说法正确的是_______(填序号)。
| A.用托盘天平称量质量为2.16g的FeBr2 |
| B.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解 |
| C.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中 |
| D.容量瓶贴签存放配好的FeBr2溶液 |
ii.探究FeBr2的还原性。取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(5)请你完成下表,验证假设
已知:①Br2易溶于有机溶剂四氯化碳(CCl4)且所得溶液呈橙红色;②四氯化碳(CCl4)不溶于水且密度比水大。
| 实验步骤、预期现象 | 结论 |
| ①取适量溶液于试管中,向其中加入 现象:溶液分层,下层呈橙红色,上层呈无色 | 假设1正确 |
| ②另取适量溶液于试管中,向其中加入 现象:溶液变为红色 | 假设2正确 |
(6)若假设2正确,向20L上述浓度的FeBr2溶液中通入标准状况下56LCl2,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: (无色)
(无色) (白色)
(白色)
 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2) 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______  。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知, 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
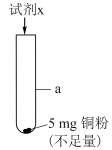
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为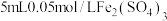 和
和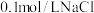 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
 (无色)
(无色) (白色)
(白色)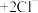
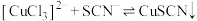 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 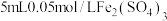 溶液 溶液 | 溶液变为浅蓝色, 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 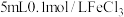 溶液 溶液 | 溶液变为蓝色, 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
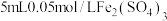 和
和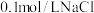 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近一年使用:0次
2024-01-20更新
|
152次组卷
|
2卷引用:北京市西城区2023-2024学年高三上学期化学期末考试题
名校
解题方法
7 . 某校化学兴趣小组学习了“氯气的实验室制法”后,利用如图所示实验装置对 的制备及性质进行探究。回答下列问题:
的制备及性质进行探究。回答下列问题:
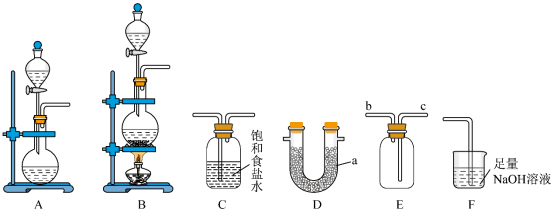
(1)仪器 的名称为
的名称为___________ 。
(2)实验室若选用 固体和浓盐酸在常温条件下制取干燥的
固体和浓盐酸在常温条件下制取干燥的 ,则选用的发生装置为
,则选用的发生装置为___________ (填“A”或“B”);该反应的化学方程式为___________ 。
(3)装置C的主要作用为___________ ;装置 是用于干燥
是用于干燥 ,故装置
,故装置 中的试剂为
中的试剂为___________ (填化学式)。
(4)用装置 收集
收集 ,进气口为
,进气口为___________ (填“b”或“c”)。
(5)装置F中发生反应的离子方程式为___________ 。
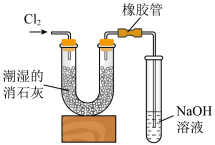
(6)工业上一般将 通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
已知:① 与潮湿的消石灰反应是放热反应;
与潮湿的消石灰反应是放热反应;
②温度较高时, 与潮湿
与潮湿 的反应方程式为
的反应方程式为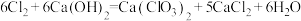 。
。
发现实验所得 产率较低,可能的原因是
产率较低,可能的原因是___________ 。
 的制备及性质进行探究。回答下列问题:
的制备及性质进行探究。回答下列问题:
(1)仪器
 的名称为
的名称为(2)实验室若选用
 固体和浓盐酸在常温条件下制取干燥的
固体和浓盐酸在常温条件下制取干燥的 ,则选用的发生装置为
,则选用的发生装置为(3)装置C的主要作用为
 是用于干燥
是用于干燥 ,故装置
,故装置 中的试剂为
中的试剂为(4)用装置
 收集
收集 ,进气口为
,进气口为(5)装置F中发生反应的离子方程式为
(6)工业上一般将
 通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
已知:①
 与潮湿的消石灰反应是放热反应;
与潮湿的消石灰反应是放热反应;②温度较高时,
 与潮湿
与潮湿 的反应方程式为
的反应方程式为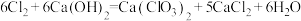 。
。发现实验所得
 产率较低,可能的原因是
产率较低,可能的原因是
您最近一年使用:0次
2024-01-20更新
|
72次组卷
|
2卷引用:安徽省淮南第四中学2023-2024学年高一上学期第二次段考化学试题
名校
8 . 实验室用如下装置制取氯气,并进行性质实验。回答下列问题;
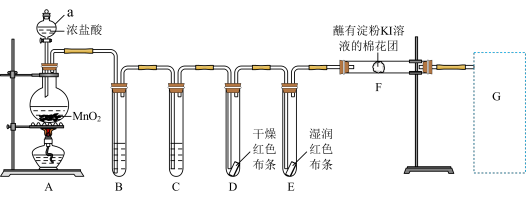
(1)写出A中反应的化学方程式________ 。装置中B盛装________ 装置中C盛装________ 。
(2)能证明氯气无漂白性的现象是________ 。
(3)F处观察到棉花团变蓝色,说明氯气具有________ 性(填“氧化”或“还原”)。
(4)写出G处尾气吸收的离子方程式________ 。
(5)实验室还可用 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;
( ) ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( ) ( )
( ) (未配平)。
(未配平)。
请写出该反应配平后的离子方程式:________ 。若生成等量的 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为________ 。

(1)写出A中反应的化学方程式
(2)能证明氯气无漂白性的现象是
(3)F处观察到棉花团变蓝色,说明氯气具有
(4)写出G处尾气吸收的离子方程式
(5)实验室还可用
 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;( )
 ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( ) ( )
( ) (未配平)。
(未配平)。请写出该反应配平后的离子方程式:
 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.小组探究 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因。
的原因。
【查阅资料】与致密的 相比
相比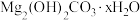 是质地疏松的难溶物。
是质地疏松的难溶物。
【实验过程】
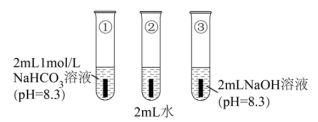
如图所示,将打磨后的镁条分别加入试管①~③中,观察到:①中镁表面持续产生大量气泡,溶液变浑浊[经检验该浑浊物为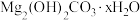 ],气体中检测到
],气体中检测到 ;②中镁表面有极微量气泡附着,滴加酚酞试液后,镁条附近溶液显红色;③中镁表面无明显气泡。
;②中镁表面有极微量气泡附着,滴加酚酞试液后,镁条附近溶液显红色;③中镁表面无明显气泡。
(1)镁和水反应的化学方程式为___________ 。
(2)设计实验③的目的是___________ 。
(3)将②中镁条取出,加入到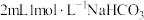 溶液中,观察到很快镁条表面开始产生大量气泡。综合上述实验,镁表面产生
溶液中,观察到很快镁条表面开始产生大量气泡。综合上述实验,镁表面产生 的快慢取决于
的快慢取决于___________ (填微粒符号)。Mg与 溶液能快速产生
溶液能快速产生 的原因:①该实验中涉及一个沉淀转化反应,试写出该反应的离子方程式:
的原因:①该实验中涉及一个沉淀转化反应,试写出该反应的离子方程式:___________ ;②该平衡正向移动使Mg与水的接触面积增大,故产生 速率加快。
速率加快。
Ⅱ.亚氯酸钠 是一种高效的漂白剂和氧化剂,某化学实验探究小组设计如下实验步骤测定样品中亚氯酸钠的纯度。
是一种高效的漂白剂和氧化剂,某化学实验探究小组设计如下实验步骤测定样品中亚氯酸钠的纯度。
步骤一:准确称取2.50g样品,加入适量蒸馏水和过量的 晶体,在酸性条件下完全反应,反应结束后将所得混合溶液稀释成250mL待测溶液。
晶体,在酸性条件下完全反应,反应结束后将所得混合溶液稀释成250mL待测溶液。
步骤二:量取25.00mL待测溶液置于锥形瓶中,并向其中再滴加几滴淀粉溶液。
步骤三:用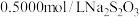 标准液滴定,达到滴定终点后,再重复进行实验。
标准液滴定,达到滴定终点后,再重复进行实验。
已知: 被还原为
被还原为 ,
, ,且杂质不参与反应。数据记录如下:
,且杂质不参与反应。数据记录如下:
(4)①步骤一中发生反应的离子方程式:___________ 。
②步骤二中量取25.00mL溶液时所使用的玻璃仪器为___________ 。
(5)步骤三中滴定达到终点的实验现象是___________ 。
(6)该样品中亚氯酸钠的纯度为___________ 。
 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因。
的原因。【查阅资料】与致密的
 相比
相比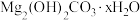 是质地疏松的难溶物。
是质地疏松的难溶物。
【实验过程】
如图所示,将打磨后的镁条分别加入试管①~③中,观察到:①中镁表面持续产生大量气泡,溶液变浑浊[经检验该浑浊物为
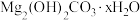 ],气体中检测到
],气体中检测到 ;②中镁表面有极微量气泡附着,滴加酚酞试液后,镁条附近溶液显红色;③中镁表面无明显气泡。
;②中镁表面有极微量气泡附着,滴加酚酞试液后,镁条附近溶液显红色;③中镁表面无明显气泡。(1)镁和水反应的化学方程式为
(2)设计实验③的目的是
(3)将②中镁条取出,加入到
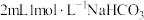 溶液中,观察到很快镁条表面开始产生大量气泡。综合上述实验,镁表面产生
溶液中,观察到很快镁条表面开始产生大量气泡。综合上述实验,镁表面产生 的快慢取决于
的快慢取决于 溶液能快速产生
溶液能快速产生 的原因:①该实验中涉及一个沉淀转化反应,试写出该反应的离子方程式:
的原因:①该实验中涉及一个沉淀转化反应,试写出该反应的离子方程式: 速率加快。
速率加快。Ⅱ.亚氯酸钠
 是一种高效的漂白剂和氧化剂,某化学实验探究小组设计如下实验步骤测定样品中亚氯酸钠的纯度。
是一种高效的漂白剂和氧化剂,某化学实验探究小组设计如下实验步骤测定样品中亚氯酸钠的纯度。步骤一:准确称取2.50g样品,加入适量蒸馏水和过量的
 晶体,在酸性条件下完全反应,反应结束后将所得混合溶液稀释成250mL待测溶液。
晶体,在酸性条件下完全反应,反应结束后将所得混合溶液稀释成250mL待测溶液。步骤二:量取25.00mL待测溶液置于锥形瓶中,并向其中再滴加几滴淀粉溶液。
步骤三:用
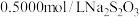 标准液滴定,达到滴定终点后,再重复进行实验。
标准液滴定,达到滴定终点后,再重复进行实验。已知:
 被还原为
被还原为 ,
, ,且杂质不参与反应。数据记录如下:
,且杂质不参与反应。数据记录如下:| 滴定次数 |  溶液起始读数/mL 溶液起始读数/mL |  溶液终点读数/mL 溶液终点读数/mL |
| 第一次 | 1.05 | 19.06 |
| 第二次 | 0.15 | 19.83 |
| 第三次 | 2.00 | 19.99 |
②步骤二中量取25.00mL溶液时所使用的玻璃仪器为
(5)步骤三中滴定达到终点的实验现象是
(6)该样品中亚氯酸钠的纯度为
您最近一年使用:0次
名校
解题方法
10 . 某实验室利用 和
和 反应合成硫酰氯
反应合成硫酰氯 ,并对
,并对 和
和 的酸性强弱进行探究。已知
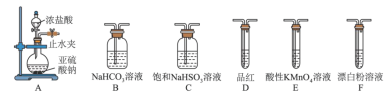
的酸性强弱进行探究。已知 的熔点为
的熔点为 ,沸点为
,沸点为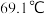 ,在空气中遇水蒸气发生剧烈反应,并产生大量
,在空气中遇水蒸气发生剧烈反应,并产生大量 白雾,
白雾, 以上分解生成
以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: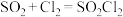 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
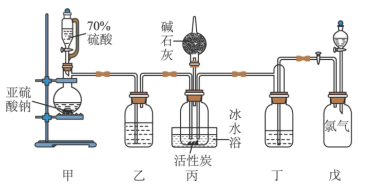
(1)盛装碱石灰固体的装置名称为:___________ ;碱石灰的作用为:___________ 。
(2)装置戊上方分液漏斗中最好选用___________ (填字母)。
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d. 盐酸
盐酸
(3) 的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式
的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式___________ 。
(4)装置丙放置在冰水浴中的原因是___________ 。
(5) 和水发生非氧化还原反应的化学方程式为
和水发生非氧化还原反应的化学方程式为___________ 。
(6)选用下面的装置探究酸性: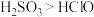 ,溶液均足量,其连接顺序为
,溶液均足量,其连接顺序为
___________ 。能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。信息: 可以使品红褪色,通常用来检验
可以使品红褪色,通常用来检验 ;
; 难溶于饱和的
难溶于饱和的 溶液;
溶液; 酸性大于
酸性大于
 和
和 反应合成硫酰氯
反应合成硫酰氯 ,并对
,并对 和
和 的酸性强弱进行探究。已知
的酸性强弱进行探究。已知 的熔点为
的熔点为 ,沸点为
,沸点为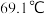 ,在空气中遇水蒸气发生剧烈反应,并产生大量
,在空气中遇水蒸气发生剧烈反应,并产生大量 白雾,
白雾, 以上分解生成
以上分解生成 和
和 。实验室合成
。实验室合成 的原理:
的原理: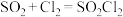 ,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
,且反应会放出大量的热。实验装置如图所示(夹持仪器已省略),请回答下列问题:
(1)盛装碱石灰固体的装置名称为:
(2)装置戊上方分液漏斗中最好选用
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.
 盐酸
盐酸(3)
 的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式
的实验室制备也可以用氯酸钾和浓盐酸在加热条件下反应,写出对应的离子反应方程式(4)装置丙放置在冰水浴中的原因是
(5)
 和水发生非氧化还原反应的化学方程式为
和水发生非氧化还原反应的化学方程式为(6)选用下面的装置探究酸性:
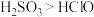 ,溶液均足量,其连接顺序为
,溶液均足量,其连接顺序为
 的酸性强于
的酸性强于 的实验现象为
的实验现象为 可以使品红褪色,通常用来检验
可以使品红褪色,通常用来检验 ;
; 难溶于饱和的
难溶于饱和的 溶液;
溶液; 酸性大于
酸性大于

您最近一年使用:0次