名校
解题方法
1 . 我国电池的年市场消费量约为80亿只,其中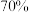 是锌锰干电池,利用废旧锌锰干电池的炭包(含碳粉、
是锌锰干电池,利用废旧锌锰干电池的炭包(含碳粉、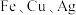 和
和 等物质)制备纯
等物质)制备纯 的工艺如下图所示:
的工艺如下图所示:

回答下列问题:
(1)在“酸浸”时为了加快浸出速率,可采取的措施有___________ 、___________ 。 (写出两点),“酸浸”过程中稀硝酸是过量的,Fe和稀硝酸反应生成 的离子方程式为
的离子方程式为___________ ,用于检验该反应生成的金属阳离子的试剂是___________ 。
(2)“焙炒”的目的是___________ 。
(3)在粗 溶解时,氧化剂与还原剂的物质的量之比为
溶解时,氧化剂与还原剂的物质的量之比为___________ ,溶解过程中所用的 高于理论用量,原因是
高于理论用量,原因是___________ 。
(4)沉锰后焙烧时,发生反应的化学方程式为___________ 。
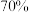 是锌锰干电池,利用废旧锌锰干电池的炭包(含碳粉、
是锌锰干电池,利用废旧锌锰干电池的炭包(含碳粉、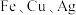 和
和 等物质)制备纯
等物质)制备纯 的工艺如下图所示:
的工艺如下图所示:
回答下列问题:
(1)在“酸浸”时为了加快浸出速率,可采取的措施有
 的离子方程式为
的离子方程式为(2)“焙炒”的目的是
(3)在粗
 溶解时,氧化剂与还原剂的物质的量之比为
溶解时,氧化剂与还原剂的物质的量之比为 高于理论用量,原因是
高于理论用量,原因是(4)沉锰后焙烧时,发生反应的化学方程式为
您最近一年使用:0次
2 . 二氧化氯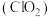 是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
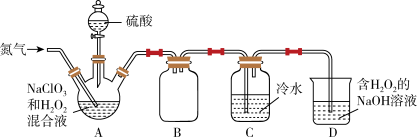
(1)装置B的作用是_______ ;制备 时,还有一种气体产生,该气体是
时,还有一种气体产生,该气体是_______ ;装置C使用冷水吸收二氧化氯的目的是_______ 。
(2)向装置A中通入氮气时流速不能过快,也不能过慢,其原因是_______ 。
(3)装置D吸收尾气,其产物之一是 。该反应的化学方程式为
。该反应的化学方程式为_______ 。
(4)测定装置C中二氧化氯溶液的浓度,步骤如下:
第一步:取20.00mL装置C中的溶液于锥形瓶中,向其中加入过量酸性KI溶液,发生反应: 。
。
第二步:加入淀粉作指示剂,向其中逐滴加入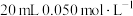 的
的 溶液至达到滴定终点,发生反应:
溶液至达到滴定终点,发生反应: 。
。
①第二步中滴定终点的标志是_______ 。
②装置C中二氧化氯溶液浓度为_______  。
。
③第二步若使用的 溶液配制已久,则测定的结果可能会
溶液配制已久,则测定的结果可能会_______ (填“偏低”、“偏高”或“无影响”)。
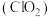 是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
是国际上公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,极易溶于水,高浓度时极易爆炸,低浓度时爆炸性降低。某化学兴趣小组设计如图装置制备二氧化氯。回答下列问题:
(1)装置B的作用是
 时,还有一种气体产生,该气体是
时,还有一种气体产生,该气体是(2)向装置A中通入氮气时流速不能过快,也不能过慢,其原因是
(3)装置D吸收尾气,其产物之一是
 。该反应的化学方程式为
。该反应的化学方程式为(4)测定装置C中二氧化氯溶液的浓度,步骤如下:
第一步:取20.00mL装置C中的溶液于锥形瓶中,向其中加入过量酸性KI溶液,发生反应:
 。
。第二步:加入淀粉作指示剂,向其中逐滴加入
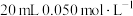 的
的 溶液至达到滴定终点,发生反应:
溶液至达到滴定终点,发生反应: 。
。①第二步中滴定终点的标志是
②装置C中二氧化氯溶液浓度为
 。
。③第二步若使用的
 溶液配制已久,则测定的结果可能会
溶液配制已久,则测定的结果可能会
您最近一年使用:0次
2022-04-12更新
|
418次组卷
|
3卷引用:山西省太原师范学院附属中学2022-2023学年高二上学期分班考试化学试题
名校
解题方法
3 . 已知镍(Ni)元素性质类似于铁。以Ni2O3为原料制备高纯NiCO3的流程如图所示,下列说法错误的是


| A.“酸浸”过程中加入H2O2的目的是将Ni3+还原为Ni2+ |
B.“沉镍”过程的离子方程式为Ni2++2HCO =NiCO3+CO2↑+H2O =NiCO3+CO2↑+H2O |
| C.可用稀硝酸酸化的BaCl2溶液检验NiCO3是否洗涤干净 |
D.产品NiCO3溶于醋酸的离子方程式是CO +2CH3COOH=CH3COO-+CO2↑+H2O +2CH3COOH=CH3COO-+CO2↑+H2O |
您最近一年使用:0次
2021-01-31更新
|
149次组卷
|
3卷引用:山西省晋中市榆次第一中学校2022-2023学年高二上学期开学考试化学试题
名校
解题方法
4 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
780次组卷
|
10卷引用:山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题
山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题2021年河北省高考化学试卷变式题10-18题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)河南省顶级名校2023届高三上学期10月月考化学试题(已下线)第1讲 钠及其重要化合物



