解题方法
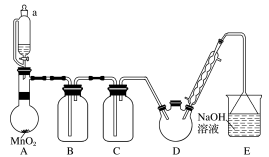
1 . 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为:______ 。
(2)装置B中的试剂是______ ,若撤去装置B,可能导致装置D中副产物______ (填化学式)的量增加;装置D可采用______ 加热的方法控制反应温度在70℃左右。
(3)装置D中球形冷凝管的作用为______ 。写出E中所有可能发生的无机反应的离子方程式:______ 。
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为______ 。(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是
(3)装置D中球形冷凝管的作用为
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。
您最近一年使用:0次
解题方法
2 . 工业上利用废镍催化剂(主要成分为Ni,还含有一定量的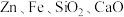 等)制备草酸镍晶体的流程如图:
等)制备草酸镍晶体的流程如图:

(1)请写出一种能提高“酸浸”速率的措施:___________ ﹔滤渣Ⅰ的成分是____________ .
(2)除铁时,控制不同的条件可以得到不同的滤渣.若控制温度为80℃、 ,可得到黄铁矾钠
,可得到黄铁矾钠 沉淀,写出生成黄铁矾钠的离子方程式:
沉淀,写出生成黄铁矾钠的离子方程式:___________ .
(3)加入有机萃取剂的作用是___________ .
(4)已知除铁后所得 溶液中
溶液中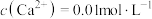 ,加入
,加入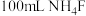 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中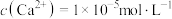 ,则所加溶液的
,则所加溶液的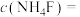
________  [已知
[已知 ].
].
 等)制备草酸镍晶体的流程如图:
等)制备草酸镍晶体的流程如图:
(1)请写出一种能提高“酸浸”速率的措施:
(2)除铁时,控制不同的条件可以得到不同的滤渣.若控制温度为80℃、
 ,可得到黄铁矾钠
,可得到黄铁矾钠 沉淀,写出生成黄铁矾钠的离子方程式:
沉淀,写出生成黄铁矾钠的离子方程式:(3)加入有机萃取剂的作用是
(4)已知除铁后所得
 溶液中
溶液中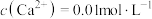 ,加入
,加入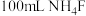 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中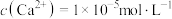 ,则所加溶液的
,则所加溶液的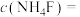
 [已知
[已知 ].
].
您最近一年使用:0次
11-12高三上·江苏无锡·阶段练习
名校
解题方法
3 . 用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应;②铜跟稀硝酸反应;③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是
| A.三种途径所消耗的铜的物质的量不相等 |
| B.三种途径所消耗的硝酸的物质的量相等 |
| C.所消耗铜的物质的量:途径③>途径①>途径② |
| D.所消耗硝酸的物质的量:途径①>途径②>途径③ |
您最近一年使用:0次
2021-04-02更新
|
901次组卷
|
20卷引用:云南省金平县一中2019-2020学年高二上学期开学考试化学试题
云南省金平县一中2019-2020学年高二上学期开学考试化学试题云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题云南省昆明市禄劝彝族苗族自治县第一中学2019-2020学年高一下学期期中考试化学(理科)试题云南省丽江润泽高级中学2023-2024学年高一下学期3月月中考试化学试题(已下线)2012届江苏省无锡一中高三9月初检测化学试卷(已下线)2018年12月16日 《每日一题》人教必修1- 每周一测(已下线)2019年12月15日 《每日一题》化学人教版(必修1)——每周一测贵州省长顺县二中2019-2020学年高一上学期期末考试化学试题广西壮族自治区河池市罗城县第二高级中学2019-2020学年高一上学期期末考试化学试题(已下线)5.2.3 硝酸(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)广西南宁市2020-2021学年高一上学期期末联考化学试题江苏省苏州市吴江区青云实验中学2020-2021学年高一下学期3月月考化学试题安徽省六安市舒城育才学校2020-2021学年高一3月月考化学试题江苏省仪征中学2020-2021学年高一下学期4月学情检测化学试题四川省凉山宁南中学2020-2021学年高一上学期期末考试化学试题课后-5.2.3 硝酸 酸雨及防治-人教2019必修第二册浙江省义乌中学2021-2022学年高一下学期第一次阶段性测试化学试题(已下线)专题03 硫酸和硝酸专讲(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)贵州省贵阳市白云区兴农中学2022-2023学年高一下学期期中考试化学试题(已下线)猜想02 氮及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
4 . 硫的化合物有重要用途。硫代硫酸钠(Na2S2O3) 可用于氰化物中毒的解毒、治疗荨麻疹等皮肤病,它在中性、碱性环境中稳定,在酸性较强的溶液中产生S和SO2。实验室可以利用如图装置制备Na2S2O3和焦亚硫酸钠(Na2S2O5 )。

(1)仪器a的名称为_______ ,a中试剂最好选择_______ (填标号)。
A.浓盐酸 B.70%硫酸 C.稀硫酸
(2) B的作用是_______ ,该装置中存在一处明显的缺陷,改进措施是_______ 。
(3)排尽装置内空气后,关闭K2、K4,打开K1、K3和仪器a的活塞,段时间后,C中有焦亚硫酸钠晶体析出,从C中分离出该晶体的操作是_______ 、_______ 、干燥。取少量焦亚硫酸钠晶体于试管中,加足量双氧水,再加BaCl2溶液,有白色沉淀生成,经检验该沉淀为BaSO4,说明焦亚硫酸钠具有_______ 性。
(4)关闭K1、K3打开K2、K4,一段时间后,D中有Na2S2O3生成。写出SO2与Na2S和Na2CO3发生反应的化学方程式_______ 。通入D中的SO2不宜过量的原因是_______ 。

(1)仪器a的名称为
A.浓盐酸 B.70%硫酸 C.稀硫酸
(2) B的作用是
(3)排尽装置内空气后,关闭K2、K4,打开K1、K3和仪器a的活塞,段时间后,C中有焦亚硫酸钠晶体析出,从C中分离出该晶体的操作是
(4)关闭K1、K3打开K2、K4,一段时间后,D中有Na2S2O3生成。写出SO2与Na2S和Na2CO3发生反应的化学方程式
您最近一年使用:0次
2021-01-26更新
|
520次组卷
|
9卷引用:云南省弥勒市第一中学2020-2021学年高二下学期开学测试化学试题
云南省弥勒市第一中学2020-2021学年高二下学期开学测试化学试题云南省玉溪市峨山县第一中学2020-2021学年高二下学期期中考试化学试题云南省昆明市2021届高三“三诊一模”摸底诊断测试理科综合能力测试化学试题河南省南阳市第一中学校2021-2022学年高三上学期第二次月考化学试题河南省温县第一高级中学2021-2022学年高三上学期9月月考化学试题河南省温县第一高级中学2021-2022学年高三上学期10月月考化学试题贵州省贵阳市五校2021-2022学年高三年级上学期联合考试(三)理科综合化学试题(已下线)题型53 多硫含氧酸盐的性质和用途河南省洛阳市栾川县第一高级中学2022-2023学年高三上学期期末考试化学试卷
5 . (1)已知由金属钠制得氧化钠,可用多种方法:a.4Na+O2=2Na2O,b.4Na+CO2=2Na2O+C,c.2NaNO2+6Na=4Na2O+N2↑。
①在上述三种方法中,最好的方法是___ (填序号),原因是_______ 。
②上述反应c中NaNO2作____ 剂,当有1 molNaNO2反应时,电子转移的数目是____ 。
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是______ ,其作用是_____ 。
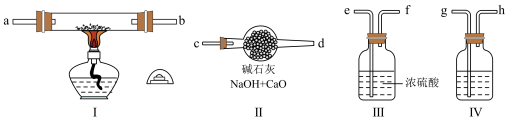
②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入_____ ,____ 接____ ,___ 接___ ,_____ 接_____ 。
③装置Ⅱ的作用______ 。
①在上述三种方法中,最好的方法是
②上述反应c中NaNO2作
(2)现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如图。回答下列问题(注:Na2O2可以与H2O、CO2反应):
①装置Ⅳ中盛放的药品是

②若规定气体的气流方向从左到右,则组合实验装置时各仪器接口的标号字母(a、b……)顺序:空气进入
③装置Ⅱ的作用
您最近一年使用:0次
名校
6 . 碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
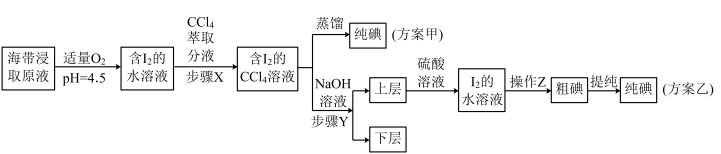
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________ 。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________ 。
(3)下列有关步骤Y的说法中正确的是_____ (填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____ ,操作Z的名称为________ 。
(5)方案甲中采用蒸馏不合理,理由是________ 。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为
(2)步骤X中,萃取后分液漏斗内观察到的现象是
(3)下列有关步骤Y的说法中正确的是
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为
(5)方案甲中采用蒸馏不合理,理由是
您最近一年使用:0次
2019-09-16更新
|
641次组卷
|
9卷引用:云南省玉溪元江民中2019-2020学年高二开学考试化学试题
云南省玉溪元江民中2019-2020学年高二开学考试化学试题云南省元阳县第一中学2019-2020学年高二上学期开学考试化学试题云南省南华县一中2019-2020学年高二上学期开学考试化学试题甘肃省武威市民勤县第一中学2023-2024学年高二上学期开学考试化学试题人教版高中化学必修二第四章《化学与自然资源的开发利用》测试卷2020年春季人教版高中化学必修2第四章《化学与自然资源的开发利用》测试卷第八章 化学与可持续发展 综合拓展——B拓展区 夯实基础(人教版(2019)第二册)第四章 化学与自然资源的开发利用 综合拓展——B拓展区 夯实基础(人教版必修2)必修第二册RJ第八章 B拓展区 综合拓展
7 . 硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:

(1)吸硫装置如图所示:
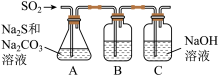
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________ ,表明SO2吸收效率低的实验现象是B中_________ 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________ 、________ 。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知: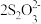 +I2=
+I2=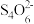 +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能____ (填“无影响”、“偏低”或“偏高”),原因是_________ 。

(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=
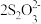 +I2=
+I2=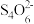 +2I-
+2I-(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能
您最近一年使用:0次
2019-06-28更新
|
149次组卷
|
8卷引用:云南省开远市第一中学校2021-2022学年高二下学期开学考试化学试题
2019·安徽·一模
名校
8 . 已知亚铁氰化钾(K4[Fe(CN)6],俗名黄血盐)是一种浅黄色结晶颗粒,其作为抗结剂加入食盐中,可以防止食盐结块。工业上可用NaCN废液为主要原料制备黄血盐流程如下:

(1)反应器中发生的主要反应的化学方程式为________ 。
(2)流程图中加入碳酸钠溶液主要目的是________ 。
(3)转化池中发生复分解反应生成K4[Fe(CN)6],说明该反应能发生的理由:________ 。
(4)系列操作B为________ 。
(5)黄血盐可与高锰酸钾溶液反应生成硝酸等,若有1mol K4[Fe(CN)6]被高锰酸钾氧化,则消耗高锰酸钾的物质的量为________ mol。
(6)黄血盐在超过400℃时会分解,试配平该反应的化学方程式:
__ K4[Fe(CN)6] 
___ KCN+___ Fe3C+___ C+___ N2↑

(1)反应器中发生的主要反应的化学方程式为
(2)流程图中加入碳酸钠溶液主要目的是
(3)转化池中发生复分解反应生成K4[Fe(CN)6],说明该反应能发生的理由:
(4)系列操作B为
(5)黄血盐可与高锰酸钾溶液反应生成硝酸等,若有1mol K4[Fe(CN)6]被高锰酸钾氧化,则消耗高锰酸钾的物质的量为
(6)黄血盐在超过400℃时会分解,试配平该反应的化学方程式:

您最近一年使用:0次
9 . 某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__ (填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__ 。不能在K2的导管末端连接图乙中的__ 装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__ 试剂和__ 试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__ 。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__ 溶液(填化学式),反应的离子方程式为__ 。

(1)装置A中烧瓶内试剂可选用
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放
您最近一年使用:0次
2019-01-15更新
|
235次组卷
|
6卷引用:云南省河口县一中2019-2020学年高二上学期开学考试化学试题
10 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
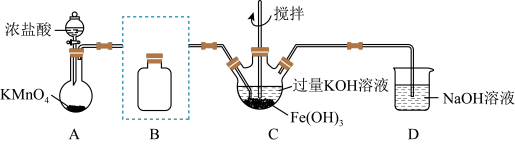
①A为氯气发生装置。A中反应方程式是___________________________________ (锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 :______________________________
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有____________________________________ (写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
i.由方案Ⅰ中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________________________________________ 产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________________________ 。
②根据K2FeO4的制备实验得出:氧化性Cl2_______ FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
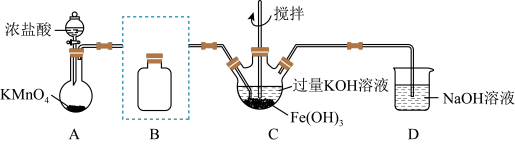
①A为氯气发生装置。A中反应方程式是
②将除杂装置B补充完整并标明所用试剂 :
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH
 2K2FeO4+6KCl+8H2O,另外还有
2K2FeO4+6KCl+8H2O,另外还有(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
您最近一年使用:0次
2018-09-20更新
|
629次组卷
|
4卷引用:云南省昆明市官渡区第一中学2019-2020学年高二上学期开学考试化学试题



