解题方法
1 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
回答下列问题:
(1)“碱浸”中NaOH溶液可以有效地除去金属铝及其氧化物,写出NaOH溶液除去铝单质的离子方程式___________ 。
(2)“滤液②”中含有的金属离子有Fe2+和___________ ,检验Fe2+的试剂是铁氰化钾溶液,写出Fe2+和铁氰化钾溶液反应的离子方程式___________ 。
(3)利用上述表格数据,计算 的
的
___________ (写出计算结果)。如果“转化”后的溶液中 浓度为
浓度为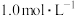 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式
。写出该反应的离子方程式___________ 。
 ):
):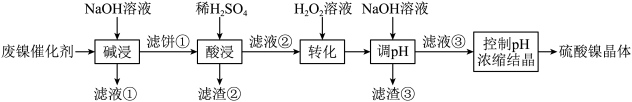
| 金属离子 |  |  | Fe3+ |  |
开始沉淀时(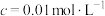 )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH溶液可以有效地除去金属铝及其氧化物,写出NaOH溶液除去铝单质的离子方程式
(2)“滤液②”中含有的金属离子有Fe2+和
(3)利用上述表格数据,计算
 的
的
 浓度为
浓度为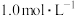 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的
 。写出该反应的离子方程式
。写出该反应的离子方程式
您最近一年使用:0次
解题方法
2 . 氮化钡(Ba3N2)是一种主要用于制备LED照明器件的材料,在空气中易被氧化,遇水会发生剧烈反应。实验室常用Ba与N2在加热条件下反应制得,某实验小组设计装置如下图所示(夹持装置略去)。

回答下列问题:
(1)仪器a的名称为___________ ,B装置中的试剂为___________ 。
(2)A装置中反应一段时间后,再点燃C处和E处酒精灯的目的是___________ 。
(3)C装置中发生反应的化学方程式为___________ 。
(4)F装置的作用为___________ 。
(5)Ba3N2和水反应生成一种强碱和一种碱性气体,该反应的离子方程式为___________ 。

回答下列问题:
(1)仪器a的名称为
(2)A装置中反应一段时间后,再点燃C处和E处酒精灯的目的是
(3)C装置中发生反应的化学方程式为
(4)F装置的作用为
(5)Ba3N2和水反应生成一种强碱和一种碱性气体,该反应的离子方程式为
您最近一年使用:0次
3 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
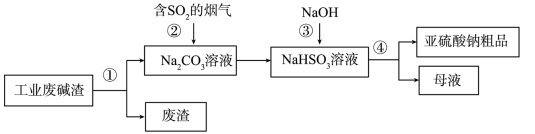
(1)为加快工业废碱渣中 的溶解,可采取的措施是
的溶解,可采取的措施是___________ (写出一种即可)。
(2)过程①进行的操作是___________ ,若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要___________ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为___________ 。
(4)亚硫酸钠粗品中含有少量 ,原因是
,原因是___________ (用化学方程式表示)。
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,___________ ,出现白色沉淀,则证明含有 。
。
(6) 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:___________ 。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
(1)为加快工业废碱渣中
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)过程①进行的操作是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量
 ,原因是
,原因是(5)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(6)
 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:
您最近一年使用:0次
2023-05-29更新
|
109次组卷
|
3卷引用:山东省郓城第一中学2023-2024学年高二上学期开学考试化学试题
名校
4 . 氮是粮食作物生长必需的元素,20世纪初德国化学家哈伯在实验室首次利用氮气和氢气合成了氨:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ•mol-1。从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。实验室以废铁屑、氨气和稀硫酸为原料,可制备少量摩尔盐[(NH4)2Fe(SO4)2•6H2O]。如图所示装置和原理能达到实验目的的是
2NH3(g) △H=-92.4kJ•mol-1。从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。实验室以废铁屑、氨气和稀硫酸为原料,可制备少量摩尔盐[(NH4)2Fe(SO4)2•6H2O]。如图所示装置和原理能达到实验目的的是
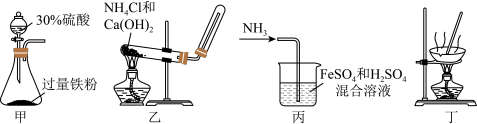
 2NH3(g) △H=-92.4kJ•mol-1。从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。实验室以废铁屑、氨气和稀硫酸为原料,可制备少量摩尔盐[(NH4)2Fe(SO4)2•6H2O]。如图所示装置和原理能达到实验目的的是
2NH3(g) △H=-92.4kJ•mol-1。从此人类进入了新的农业时代,化肥的使用大大提高了粮食产量。实验室以废铁屑、氨气和稀硫酸为原料,可制备少量摩尔盐[(NH4)2Fe(SO4)2•6H2O]。如图所示装置和原理能达到实验目的的是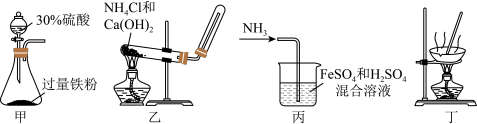
| A.用装置甲制取FeSO4溶液 |
| B.用装置乙制取NH3 |
| C.用装置丙将氨气通入FeSO4和H2SO4的混合溶液中 |
| D.用装置丁蒸干溶液得到(NH4)2Fe(SO4)2•6H2O |
您最近一年使用:0次
2023-04-25更新
|
215次组卷
|
3卷引用:山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题
解题方法
5 . 三氯化钉( )和硫化铋(
)和硫化铋( )用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、
)用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、 、
、 )回收
)回收 和
和 的工艺流程如下。
的工艺流程如下。

已知:I.滤液1中Ru元素和Bi元素存在形式为 、
、 ;
;
II. 。
。
回答下列问题:
(1)“氧化碱浸”过程中,Ru发生反应的离子方程式为_______ 。该过程中,NaClO的利用率与温度的关系如图所示。温度高于25℃时,NaClO的利用率开始下降,主要原因可能是_______ 。

(2)滤液2的主要成分有NaCl、 、
、_______ (填化学式)。
(3)“蒸馏”过程中, 与
与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(4)盐酸“吸收” 过程中产生的
过程中产生的 ,经进一步处理可以转化为两种盐
,经进一步处理可以转化为两种盐_______ 、_______ (填名称),可在本工艺流程中循环使用。
(5)“沉淀”时,向 溶液中加入
溶液中加入 溶液,反应后混合溶液中
溶液,反应后混合溶液中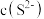 为
为 ,则
,则 的沉淀率为
的沉淀率为_______ (忽略溶液混合引起的体积变化)。
 )和硫化铋(
)和硫化铋( )用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、
)用途广泛。利用某含钌、铋的废催化剂(主要成分为Ru、 、
、 )回收
)回收 和
和 的工艺流程如下。
的工艺流程如下。
已知:I.滤液1中Ru元素和Bi元素存在形式为
 、
、 ;
;II.
 。
。回答下列问题:
(1)“氧化碱浸”过程中,Ru发生反应的离子方程式为

(2)滤液2的主要成分有NaCl、
 、
、(3)“蒸馏”过程中,
 与
与 发生反应的化学方程式为
发生反应的化学方程式为(4)盐酸“吸收”
 过程中产生的
过程中产生的 ,经进一步处理可以转化为两种盐
,经进一步处理可以转化为两种盐(5)“沉淀”时,向
 溶液中加入
溶液中加入 溶液,反应后混合溶液中
溶液,反应后混合溶液中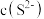 为
为 ,则
,则 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-04-22更新
|
180次组卷
|
2卷引用:山东省滨州市2022-2023学年高二下学期2月开学考试化学试题
名校
解题方法
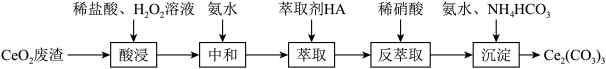
6 . 实验室以二氧化铈( )废渣为原料制备
)废渣为原料制备 含量少的
含量少的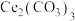 ,部分实验过程如下:
,部分实验过程如下:
已知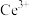 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为 ,下列说法正确的是
,下列说法正确的是
 )废渣为原料制备
)废渣为原料制备 含量少的
含量少的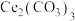 ,部分实验过程如下:
,部分实验过程如下:
已知
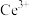 能被有机萃取剂(简称HA)萃取,其萃取原理可表示为
能被有机萃取剂(简称HA)萃取,其萃取原理可表示为 ,下列说法正确的是
,下列说法正确的是A.“酸浸”过程中 做氧化剂 做氧化剂 |
B.加氨水“中和”去除过量盐酸,目的是提高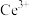 的萃取率 的萃取率 |
C.“反萃取”中用适量萃取剂分多次萃取,有利于将水层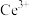 尽可能多地转移到有机层 尽可能多地转移到有机层 |
D.“沉淀”时反应的离子方程式为 |
您最近一年使用:0次
2022-12-14更新
|
263次组卷
|
3卷引用:山东省威海乳山市第一中学2022-2023学年高二下学期开学考试化学试题
解题方法
7 . 三草酸合铁(Ⅲ)酸钾( ),溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中用铁屑为原料,先利用如图所示装置制取
),溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中用铁屑为原料,先利用如图所示装置制取 (夹持装置略去),再制取三草酸合铁(Ⅲ)酸钾。
(夹持装置略去),再制取三草酸合铁(Ⅲ)酸钾。

回答下列问题:
(1)仪器 的名称是
的名称是_______ 。
(2)实验操作步骤如下:(实验开始前 、
、 、
、 和
和 都处于关闭状态)
都处于关闭状态)
①打开 ,向
,向 中滴加稀硫酸;②打开
中滴加稀硫酸;②打开 和
和 ;③关闭
;③关闭 、
、 ;④打开
;④打开 和
和 ;⑤关闭
;⑤关闭 、
、 。
。
步骤①,装置 中发生反应的离子方程式为
中发生反应的离子方程式为_______ ,步骤②的目的是_______ ,步骤④,打开 和
和 ,
, 中溶液能够流入
中溶液能够流入 中的原因是
中的原因是_______ 。
(3)将得到的 加入反应装置(装置略去)发生反应:
加入反应装置(装置略去)发生反应: ,制得
,制得 。
。
①该反应过程中要进行“微热、搅拌”操作,“微热、搅拌”的目的是_______ ;若加热温度太高,对反应造成的主要影响是_______ 。
②为从反应后的溶液中得到纯净、干燥的 晶体,应采取的实验操作是
晶体,应采取的实验操作是_______ (不要求写详细的实验操作)。
 ),溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中用铁屑为原料,先利用如图所示装置制取
),溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中用铁屑为原料,先利用如图所示装置制取 (夹持装置略去),再制取三草酸合铁(Ⅲ)酸钾。
(夹持装置略去),再制取三草酸合铁(Ⅲ)酸钾。
回答下列问题:
(1)仪器
 的名称是
的名称是(2)实验操作步骤如下:(实验开始前
 、
、 、
、 和
和 都处于关闭状态)
都处于关闭状态)①打开
 ,向
,向 中滴加稀硫酸;②打开
中滴加稀硫酸;②打开 和
和 ;③关闭
;③关闭 、
、 ;④打开
;④打开 和
和 ;⑤关闭
;⑤关闭 、
、 。
。步骤①,装置
 中发生反应的离子方程式为
中发生反应的离子方程式为 和
和 ,
, 中溶液能够流入
中溶液能够流入 中的原因是
中的原因是(3)将得到的
 加入反应装置(装置略去)发生反应:
加入反应装置(装置略去)发生反应: ,制得
,制得 。
。①该反应过程中要进行“微热、搅拌”操作,“微热、搅拌”的目的是
②为从反应后的溶液中得到纯净、干燥的
 晶体,应采取的实验操作是
晶体,应采取的实验操作是
您最近一年使用:0次
8 . 下列选项中的气体能用如图装置制备,且所选试剂、干燥剂均正确的是
| 气体 | 所用试剂 | 干燥剂 | 装置(可加热) | |
| A |  | 过氧化氢和二氧化锰 | 五氧化二磷 | 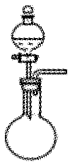 |
| B |  | 浓氨水和生石灰 | 无水氯化钙 | |
| C |  | 稀硝酸和锌粒 | 浓硫酸 | |
| D |  | 浓盐酸和亚硫酸钠 | 碱石灰 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 正丁醇常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如图:

反应物和产物的相关数据如表:
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯;
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
请回答:
(1)加热A前,需先从_________ (填“a”或“b”)口向B中通入水。
(2)写出步骤②中制备正丁醚的化学方程式____________________________________ 。
(3)步骤③的目的是初步洗去____________________ ,振摇后静置,粗产物应从分液漏斗的_____ (填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为_______________________________________ 。
(5)步骤⑤中,加热蒸馏时应收集________ (填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃
(6)本实验中,正丁醚的产率为_____________________ 。

反应物和产物的相关数据如表:
| 相对分子质量 | 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间,分离提纯;
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40mL水、20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g。
请回答:
(1)加热A前,需先从
(2)写出步骤②中制备正丁醚的化学方程式
(3)步骤③的目的是初步洗去
(4)步骤④中最后一次水洗的目的为
(5)步骤⑤中,加热蒸馏时应收集
a.100℃b.117℃c.135℃d.142℃
(6)本实验中,正丁醚的产率为
您最近一年使用:0次



