1 . 金属材料在日常生活、工农业生产和科学研究中有着广泛的用途。
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁属于_______ (填“混合物”或“纯净物”)。
(2)在钢中加入不同的合金元素可以提高其性能,例如,加入钨可以增强合金钢的耐磨性等。用黑钨矿制备钨的过程如图所示:
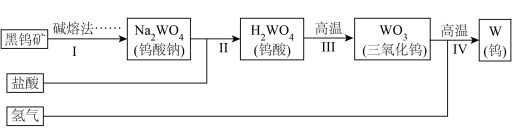
(注:钨酸是难溶于水的黄色固体。)
①钨酸钠中钨元素的化合价为_______ 。
②填写下表:
(1)钢铁是使用最多的金属材料。生铁和钢是含碳量不同的两种铁合金,其中生铁属于
(2)在钢中加入不同的合金元素可以提高其性能,例如,加入钨可以增强合金钢的耐磨性等。用黑钨矿制备钨的过程如图所示:

(注:钨酸是难溶于水的黄色固体。)
①钨酸钠中钨元素的化合价为
②填写下表:
| 步骤 | 化学方程式 | 基本反应类型 |
| Ⅱ | 复分解反应 | |
| Ⅲ | 分解反应 | |
| Ⅳ | 置换反应 |
您最近一年使用:0次
2 . 现对一批已生锈的弹壳进行回收利用,主要流程如下:
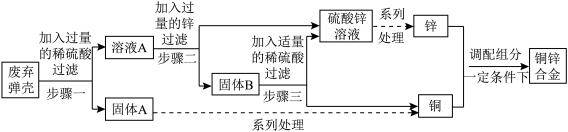
(资料)①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
(1)为加快步骤一的反应速率,可采用的方法是___________ (填一种即可);
(2)溶液A中的溶质是(写化学式)___________ ;固体B含有的物质为(写化学式)___________ ;
(3)步骤三中发生反应的化学方程式为___________ ;
(4)回收锌的质量___________ 废弃弹壳中锌元素的质量(选填“大于”、“小于”或“等于”);
(5)改变铜锌合金中锌的含量可以得到不同机械性能的黄铜。现欲制备120吨(t)含锌量小于35%的黄铜,该类黄铜具有良好的塑性,能承受冷热加工,但在200℃~700℃之间热加工时易断裂。下列符合原料配比及热加工条件的是___________ (填字母序号)。
a.锌44t 铜76t 750℃ b.锌38t 铜82t 500℃
c.锌55t 铜65t 190℃ d.锌25t 铜95t 750℃

(资料)①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
(1)为加快步骤一的反应速率,可采用的方法是
(2)溶液A中的溶质是(写化学式)
(3)步骤三中发生反应的化学方程式为
(4)回收锌的质量
(5)改变铜锌合金中锌的含量可以得到不同机械性能的黄铜。现欲制备120吨(t)含锌量小于35%的黄铜,该类黄铜具有良好的塑性,能承受冷热加工,但在200℃~700℃之间热加工时易断裂。下列符合原料配比及热加工条件的是
a.锌44t 铜76t 750℃ b.锌38t 铜82t 500℃
c.锌55t 铜65t 190℃ d.锌25t 铜95t 750℃
您最近一年使用:0次
名校
解题方法
3 . 铁合金有下列数据:
取15g某碳素钢样品,按下列实验流程进行操作;
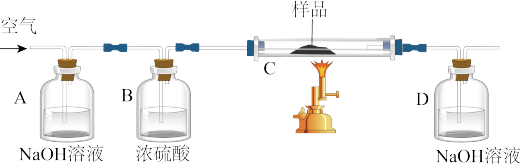
请回答:
(1)A、B的作用分别为_______ ,_______ 。
(2)D中的发生反应的离子方程式为_______ 。
(3)充分加热完全反应后,D装置质量增加0.022g,该样品含碳量为_______ ,属于_______ 碳铜。(填“低”、“中”、“高”)
(4)没有A装置,实验结果_______ (填“偏高”、“偏低”成“不影响”)
| 碳素钢(Fe、C、Mn、Si) | ||
| 低碳钢 | 中碳钢 | 高碳钢 |
| 含碳量<0.3% | 含碳量0.3%-0.6% | 含碳量>0.6% |

请回答:
(1)A、B的作用分别为
(2)D中的发生反应的离子方程式为
(3)充分加热完全反应后,D装置质量增加0.022g,该样品含碳量为
(4)没有A装置,实验结果
您最近一年使用:0次
名校
解题方法
4 . A、B、C是由短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
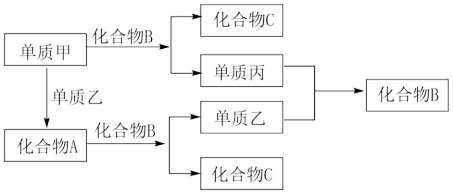
(1)单质甲的原子结构示意图_______ 。
(2)单质甲与化合物B反应的离子方程式为_______ ,5.05 g单质甲-钾合金溶于200 mL水生成0.075 mol H2,确定该合金的化学式为_______ 。
(3)向50 mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1 mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。

①由A确定滴加前60 mL的盐酸时,发生所有反应的离子方程式是_______ 。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为_______ 。
③原化合物C溶液的物质的量浓度为_______ 。
④由A、B可知,两次实验通入的CO2的体积比为_______ 。

(1)单质甲的原子结构示意图
(2)单质甲与化合物B反应的离子方程式为
(3)向50 mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1 mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。

①由A确定滴加前60 mL的盐酸时,发生所有反应的离子方程式是
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为
③原化合物C溶液的物质的量浓度为
④由A、B可知,两次实验通入的CO2的体积比为
您最近一年使用:0次
名校
5 . 铝、铁是生产、生活中常见的金属,其合金与盐在各领域都有着广泛的应用。
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
(2)铝元素在周期表中的位置是_______ 。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式_______ 。铁粉与水蒸气在高温条件下反应,生成的固态产物是_______ 。
(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。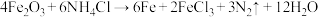 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为_______ 个,有同学认为,该反应产物中不应该有Fe生成,他的理由是(用化学方程式表示原因)_______ 。
(4)现有仪器和药品:试管和胶头滴管,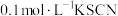 溶液、
溶液、 酸性
酸性 溶液、
溶液、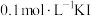 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
(1)铝合金是一种建筑装潢材料,它具有坚硬、轻巧、耐用的特性。铝合金的下列性质与这些特性无关的是
| A.不易生锈 | B.导电性好 | C.密度小 | D.硬度大 |
 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式(3)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
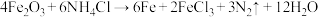 ;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为
;上述反应中当生成3.36L氮气(标准状况)时,转移的电子数为(4)现有仪器和药品:试管和胶头滴管,
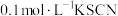 溶液、
溶液、 酸性
酸性 溶液、
溶液、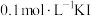 溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:
溶液、氯水等。请你设计一个简单实验,探究铁与稀硝酸完全反应后铁可能的价态,填写下列实验报告:| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴 溶液。 溶液。 | |
| 第二步 |  。 。 |
您最近一年使用:0次
2022-06-28更新
|
225次组卷
|
2卷引用:上海市宜川中学2021-2022学年高一下学期期末考试化学试题
6 . 某合金X由常见的两种元素组成。为探究该合金X的元素组成和性质,设计并进行如下实验:

根据上述信息,回答下列问题:
(1)X的化学式为_______ 。
(2)实验过程中无色气体A的收集方法为_______ 。
(3)用离子方程式解释溶液中滴加H2O2后呈血红色的原因_______ 。

根据上述信息,回答下列问题:
(1)X的化学式为
(2)实验过程中无色气体A的收集方法为
(3)用离子方程式解释溶液中滴加H2O2后呈血红色的原因
您最近一年使用:0次
2022-06-11更新
|
220次组卷
|
2卷引用:浙江省杭嘉湖金四县区2021-2022学年高一下学期学考模拟化学试题
名校
7 . 金属矿物资源以及海水资源的综合利用有着非常重要的意义。
(1)高炉炼铁的主要反应是: 。生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用之一:与
。生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用之一:与 反应生成
反应生成 ,提供还原剂。焦炭的另一作用:
,提供还原剂。焦炭的另一作用:_______ 。
(2)从海带中提取碘的实验过程如下图所示:
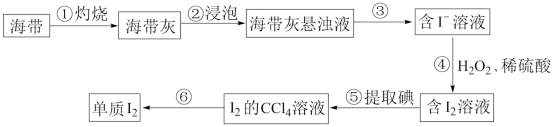
步骤①用到的仪器除酒精灯、三脚架外,还需要__ ,步骤③的操作名称为__ ,步骤④中发生反应的离子方程式为_ 。
(3)冶炼得到的铁粉和海带中提取的碘可以用于生产KI,其工艺流程如图所示:

①操作A包括____ 、____ 、过滤。
②用冰水洗涤的目的是除去附着在KI表面的可溶性杂质,同时___
③反应I生成了铁与碘的化合物X,测得X中铁元素与碘元素的质量比为 ,则X的化学式为
,则X的化学式为____ ;II中1molX完全反应生成89.6L (标准状况下)CO2,写出反应II的化学方程式___ 。
(1)高炉炼铁的主要反应是:
 。生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用之一:与
。生产中所需焦炭的量远远高于按照方程式计算所需的量。焦炭的作用之一:与 反应生成
反应生成 ,提供还原剂。焦炭的另一作用:
,提供还原剂。焦炭的另一作用:(2)从海带中提取碘的实验过程如下图所示:

步骤①用到的仪器除酒精灯、三脚架外,还需要
(3)冶炼得到的铁粉和海带中提取的碘可以用于生产KI,其工艺流程如图所示:

①操作A包括
②用冰水洗涤的目的是除去附着在KI表面的可溶性杂质,同时
③反应I生成了铁与碘的化合物X,测得X中铁元素与碘元素的质量比为
 ,则X的化学式为
,则X的化学式为
您最近一年使用:0次
解题方法
8 . 某学习小组用如图所示装置测定铝镁合金(不含其他杂质)中铝的质量分数和铝的相对原子质量。
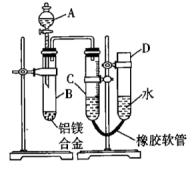
(1)A中试剂为____ 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____ 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
上述操作的顺序是_____ (填序号);记录C的液面位置时,除视线平视外,还应____ 。
(4)B中发生反应的化学反应方程式_____ 。
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___ (填“偏大”、“偏小”或“不受影响”)。

(1)A中试剂为
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂;
上述操作的顺序是
(4)B中发生反应的化学反应方程式
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
您最近一年使用:0次
名校
解题方法
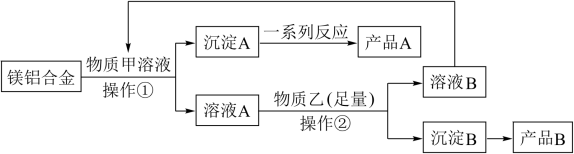
9 . MgO、Al2O3都是常用的耐火材料,某研究小组取100kg含60%Al的报废汽车的镁铝合金材料来制备MgO、Al2O3,其中甲可由溶液B转化再生,工艺流程如图所示。
请回答下列问题:
(1)下列对合金材料的说法正确的是___________ (填字母代号)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是___________ (化学式),产品A是___________ (化学式)。
(3)操作①、②所需的玻璃仪器是___________ 。
(4)足量物质乙与溶液A发生的主要反应的离子方程式为___________ 。
(5)假设不计损耗,可得产品B的质量为___________ kg。(保留一位小数)

请回答下列问题:
(1)下列对合金材料的说法正确的是
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是
(3)操作①、②所需的玻璃仪器是
(4)足量物质乙与溶液A发生的主要反应的离子方程式为
(5)假设不计损耗,可得产品B的质量为
您最近一年使用:0次
名校
解题方法
10 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
①反应在t1min内的平均速率:v(H2)=____ mol·L-1·min-1。
②t2时刻,该反应的正反应速率___ 逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
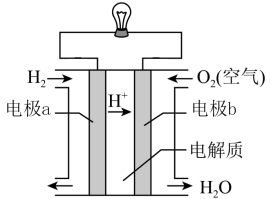
①该电池供电时,____ 能转化为____ 能。
②写出该电池供电时的总反应方程式________ 。
③电极b上发生______ 反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________ 。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______ 。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______ 。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):| 反应时间/min | 0 | t1 | t2 |
| n(CO)/mol | 1.20 | 0.80 | 0.80 |
②t2时刻,该反应的正反应速率
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。

①该电池供电时,
②写出该电池供电时的总反应方程式
③电极b上发生
④在外电路中,电子流动的方向为
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为
您最近一年使用:0次
2019-06-18更新
|
322次组卷
|
2卷引用:【全国百强校】江苏省海安高级中学2018-2019学年高一6月月考化学试题



