1 . 溴、碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。
海带→灼烧→溶解→过滤→氧化→萃取、分液→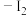 的
的 溶液
溶液
(1)上述实验流程中灼烧用到的仪器是_______ (从下列图中选择,写出名称,下同),萃取分液在_______ 中进行。

(2)“氧化”时加入 和
和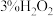 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_______ 。
(3)检验氧化后的溶液中存在碘单质,可选用的试剂是_______ (填名称)溶液。
Ⅱ.某化学兴趣小组模拟工业上以浓缩海水为原料提取溴的流程设计了如图所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
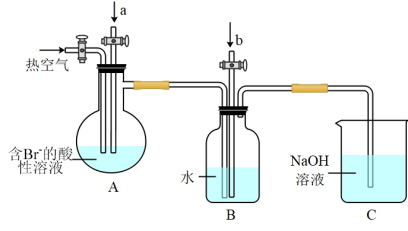
(4)A装置中通入a气体通常为_______ ,发生反应的离子方程式为_______ 。
(5)A装置中通入a气体一段时间后,停止通入,改通入热空气。通入热空气的目的是_______ 。
(6)B装置的作用是收集并还原溴,则气体b为_______ 。
(7)C装置的作用是_______ 。
Ⅰ.实验室按如下实验流程提取海带中的碘。
海带→灼烧→溶解→过滤→氧化→萃取、分液→
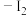 的
的 溶液
溶液(1)上述实验流程中灼烧用到的仪器是

(2)“氧化”时加入
 和
和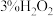 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为(3)检验氧化后的溶液中存在碘单质,可选用的试剂是
Ⅱ.某化学兴趣小组模拟工业上以浓缩海水为原料提取溴的流程设计了如图所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。

(4)A装置中通入a气体通常为
(5)A装置中通入a气体一段时间后,停止通入,改通入热空气。通入热空气的目的是
(6)B装置的作用是收集并还原溴,则气体b为
(7)C装置的作用是
您最近一年使用:0次
名校
解题方法
2 . 海带提碘是工业碘的主要来源之一,下列说法错误的是:
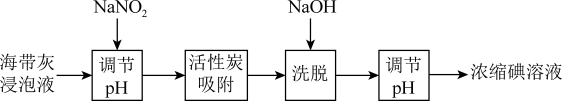

| A.NaNO2可将I-氧化为I2 |
B.“洗脱”时发生3I2+6OH-=IO +5I-+3H2O +5I-+3H2O |
| C.活性炭不仅能够吸附I2还可以循环使用 |
| D.浓缩碘溶液中的碘可以用酒精萃取 |
您最近一年使用:0次
2022-01-20更新
|
279次组卷
|
3卷引用:湖南省株洲市醴陵市第一中学2021-2022学年高三下学期期中考试化学试题
湖南省株洲市醴陵市第一中学2021-2022学年高三下学期期中考试化学试题福建省福州市2021-2022学年高三上学期期末质量抽测化学试卷(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)
解题方法
3 . 海藻中含有丰富的碘元素。如图是实验室模拟从海藻里提取碘的流程的一部分,下列判断错误的是
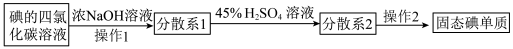
已知:四氯化碳沸点76.8℃;碘的沸点184.4℃,在45℃左右开始升华。
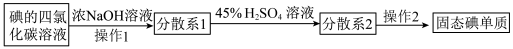
已知:四氯化碳沸点76.8℃;碘的沸点184.4℃,在45℃左右开始升华。
| A.操作1是振荡、静置、分液,从上口倒出的液体是分散系1 |
B.加入“45%H2SO4溶液”发生的反应为:IO +5I-+6H+=3I2+3H2O +5I-+6H+=3I2+3H2O |
| C.分散系2是含碘的悬浊液,操作2是升华 |
| D.四氯化碳气化与碘单质升华时均需克服范德华力 |
您最近一年使用:0次
4 . 人类的生产、生活离不开化学。
(1)从海水中提取溴的工业流程如图:

①请列举两种海水淡化的方法:___________ 、___________ 。
②步骤Ⅰ中发生反应的离子方程式为___________ 。
③已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是___________ 。
④吹出塔中通入热空气吹出 ,利用了
,利用了 的
的___________ (填序号);吸收塔中吸收 ,利用了
,利用了 的
的___________ (填序号)。
a.氧化性b.还原性c.挥发性d.腐蚀性
(2)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①由海带转化成海带灰,需要的主要仪器是___________ (填写序号并写出仪器名称)。

②若过程Ⅰ用 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为___________
③过程Ⅱ采用的分离方法和操作是___________ 、___________ 。
此过程中可以选用的溶剂是___________ (填序号)。
a.乙醇b.四氯化碳c.水d.苯
(1)从海水中提取溴的工业流程如图:

①请列举两种海水淡化的方法:
②步骤Ⅰ中发生反应的离子方程式为
③已知步骤Ⅰ中已获得游离态的溴,通过步骤Ⅱ在吸收塔中得到化合态的溴,其目的是
④吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的a.氧化性b.还原性c.挥发性d.腐蚀性
(2)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①由海带转化成海带灰,需要的主要仪器是

②若过程Ⅰ用
 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为③过程Ⅱ采用的分离方法和操作是
此过程中可以选用的溶剂是
a.乙醇b.四氯化碳c.水d.苯
您最近一年使用:0次
解题方法
5 . 请分析海水提镁、海带提碘的主要过程,按要求回答下列问题。
(1)海水提镁
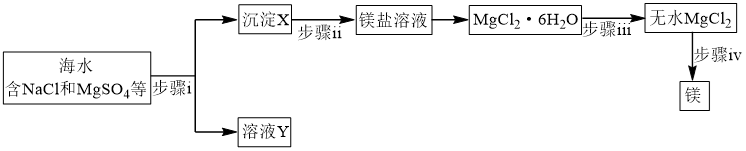
① 在周期表中位于
在周期表中位于_______ 区。
②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)_______ 溶液。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ系列操作中需在 氛围中进行原因为
氛围中进行原因为_______ 。
⑤步骤ⅳ惰性电极电解熔融 时,在
时,在_______ 极每产生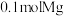 时,电路中转移电子数目为
时,电路中转移电子数目为_______ 。
(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)
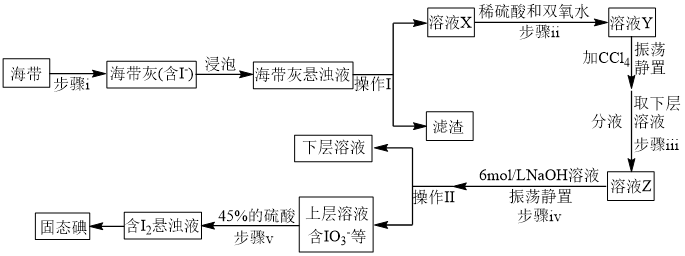
①步骤ⅰ不会用到下列仪器中的_______ (填字母)
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为_______ 、_______ 。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ到步骤Ⅴ的目的是_______ 。
⑤步骤Ⅴ中 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(1)海水提镁

①
 在周期表中位于
在周期表中位于②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)
③步骤ⅱ反应的离子方程式为
④步骤ⅲ系列操作中需在
 氛围中进行原因为
氛围中进行原因为⑤步骤ⅳ惰性电极电解熔融
 时,在
时,在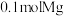 时,电路中转移电子数目为
时,电路中转移电子数目为(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)

①步骤ⅰ不会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为
③步骤ⅱ反应的离子方程式为
④步骤ⅲ到步骤Ⅴ的目的是
⑤步骤Ⅴ中
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
6 . 海带、紫菜等藻类植物含有丰富的碘元素。某化学实验小组同学从海带中提取碘并计算海带中的碘元素含量,进行以下实验:
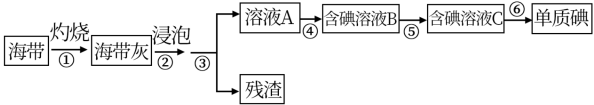
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。乙同学认为甲的操作不合理,其理由是___________ 。
(2)海带提碘的一系列操作中需要过滤的步骤是___________ 。
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由___________ 。
(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填写字母)。
a.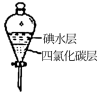 b.
b.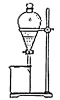
c. d.
d.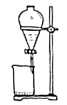
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:___________ 。
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为___________ 。

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)海带提碘的一系列操作中需要过滤的步骤是
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是
 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是
a.
 b.
b.
c.
 d.
d.
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为
您最近一年使用:0次
2021-05-06更新
|
470次组卷
|
5卷引用:山东省枣庄市2020-2021学年高一下学期期中考试化学试题
山东省枣庄市2020-2021学年高一下学期期中考试化学试题陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题
名校
7 . 碘主要用于制药物、染料和碘化合物等,海带、紫菜等藻类植物中富含碘元素。实验室中从海带中提取碘的流程如图。
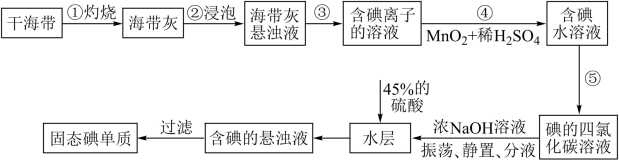
已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在___________________ (填仪器名称) 进行加热。
(2)步骤④发生反应的离子方程式为__________________ 。
(3)“过滤”操作用到的主要玻璃仪器有________________________ 。
(4)下列有关步骤⑤的叙述正确的是_________ (填序号)。
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为________________________ 。
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是______ (用离子方程式表示)。
②请用原子结构知识解释Cl2的氧化性强于I2的原因______________ 。

已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在
(2)步骤④发生反应的离子方程式为
(3)“过滤”操作用到的主要玻璃仪器有
(4)下列有关步骤⑤的叙述正确的是
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是
②请用原子结构知识解释Cl2的氧化性强于I2的原因
您最近一年使用:0次
解题方法
8 . 实验室里从海带中提取碘的流程如下:
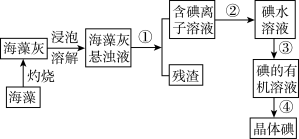
(1)提取碘的过程中有关实验的操作名称①_______ 、②_______ 、③_______ 、④_______ 。
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和_______ 。进行步骤③操作时,需要用到的主要仪器是_______ 。
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:_______ ,该反应中的氧化剂是_______ 。
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)

(1)提取碘的过程中有关实验的操作名称①
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)
| 方案 | 选用试剂(填标号) | 主要现象 |
| 1 | 未知溶液、 | |
| 2 | 未知溶液、 |
您最近一年使用:0次
名校
9 . 下列叙述不正确的是
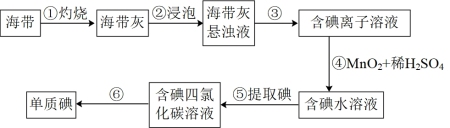

| A.步骤③的分离操作为过滤 |
| B.步骤④中理论上每产生1molI2,需要1molMnO2被氧化 |
| C.步骤⑥操作可以为先加入浓碱过滤,向水层再加入45%硫酸溶液分液,将碘提取出来 |
| D.步骤⑤中加入萃取剂后现象是溶液分层,下层为四氯化碳层呈紫色 |
您最近一年使用:0次
2022-05-15更新
|
196次组卷
|
3卷引用:北京市昌平区第一中学2021-2022学年高一下学期线上期中学情调研化学试题
北京市昌平区第一中学2021-2022学年高一下学期线上期中学情调研化学试题北京市昌平区第一中学2022-2023学年高一上学期期中考试化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
解题方法
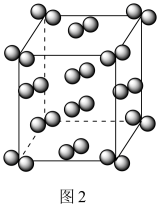
10 . 工业上一种从海水中制备碘的方法为:取净化除氯后的含碘海水,加入AgNO3溶液,富集得到AgI悬浊液,进而制得粗碘。从AgI悬浊液中回收I2的流程如图1所示。
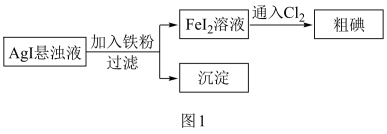
下列有关说法正确的是


下列有关说法正确的是
| A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2Ag+=Ag+Fe2+ |
| B.可在含碘海水中直接通入Cl2制备粗碘 |
| C.如图2所示I2的晶胞中有14个I2分子 |
| D.流程中沉淀可进一步转化,实现AgNO3的循环使用 |
您最近一年使用:0次
2021-11-12更新
|
384次组卷
|
3卷引用:江苏省盐城市2021-2022学年高三上学期期中考试化学试题
江苏省盐城市2021-2022学年高三上学期期中考试化学试题(已下线)化学-2022年高考押题预测卷01(江苏卷)辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题



