1 . 碘元素被称为“智力元素”,海洋植物如海带、海藻中存在丰富的碘元素,一般以碘离子形式存在。某小组设计实验从20.00g海藻中提取碘单质,实验流程如下:
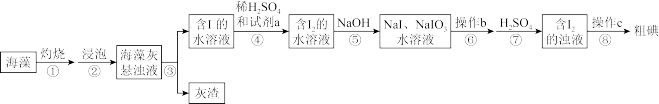
试回答下列问题:
(1)灼烧海藻时,将海藻用___________ (填化学式)润湿后,置于___________ (填装置名称)中烧成灰烬。
(2)从下列试剂中选择可做试剂a的是___________ (填序号)。
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为___________
(3)操作b是___________ ,滴加稀硫酸时发生的离子反应方程式为___________ 操作c为过滤,滤液可返回至___________ (填步骤序号)操作后溶液中循环利用。
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为___________ mg/kg;若滴定时溶液酸性过强,会导致测量结果___________ (填“偏高”或“偏低”)。

试回答下列问题:
(1)灼烧海藻时,将海藻用
(2)从下列试剂中选择可做试剂a的是
A.H2O2 B.MnO2 C.FeCl2 D.SO2
有人提出试剂a可以是Cl2,但是使用时必须控制用量,否则生成的I2,又被Cl2氧化为+5价,该反应的化学方程式为
(3)操作b是
(4)碘量法常用于测量草药中可能残余的有毒元素As的含量:
①取1000g草药样品进行前期处理制得待测溶液1000mL,此时样品中含有的砷元素转化为H3AsO3;
②转移100mL待测液至250mL锥形瓶中,加入1.000×10-3mol·L-1标准I2溶液20.00mL(H3AsO3转化为H3AsO4),并加入少量的淀粉溶液;
③用1.000×103mol·L-1的硫代硫酸钠标准溶液滴定过量的碘(已知:2
 +I2=2I-+
+I2=2I-+ )。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
)。滴定终点时消耗22.00mL硫代硫酸钠标准溶液,则草药中砷的含量为
您最近一年使用:0次
名校
2 . 下列有关海水综合利用的说法正确的是
| A.海水中含有溴和钾元素,只需经过物理变化就可以得到溴和钾单质 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
您最近一年使用:0次
2021-08-06更新
|
190次组卷
|
4卷引用:安徽省安庆市第九中学2021-2022学年高二上学期开学考试化学试题
3 . 海海洋资源的利用具有广阔前景。
(1)如图是从海水中提取镁的简单流程。
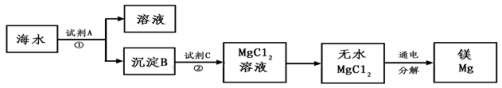
①为使海水中Mg2+转化为沉淀B___ (填化学式,下同),试剂A可以选用___ 。
②写出加入试剂C发生的离子反应方程式___ 。
③由无水MgCl2在熔融状态下制取Mg的化学反应方程式是___
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带 海带灰
海带灰 滤液
滤液
 I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是___ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式___ 。
③反应结束后,加入CCl4作萃取剂,采用萃取—分液的方法从碘水中提取碘,主要操作步骤如图:
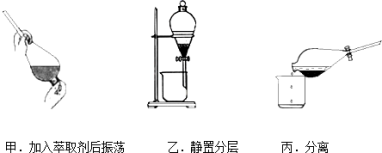
甲、乙、丙3步实验操作中,不正确的是___ (填“甲”、“乙”或“丙”)。
(1)如图是从海水中提取镁的简单流程。

①为使海水中Mg2+转化为沉淀B
②写出加入试剂C发生的离子反应方程式
③由无水MgCl2在熔融状态下制取Mg的化学反应方程式是
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示:
干海带
 海带灰
海带灰 滤液
滤液
 I2
I2①灼烧海带至灰烬时所用的主要仪器名称是
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
③反应结束后,加入CCl4作萃取剂,采用萃取—分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是
您最近一年使用:0次
2021-06-24更新
|
138次组卷
|
2卷引用:安徽省安庆市白泽湖中学2021-2022学年下学期高一分班考试化学试卷
名校
解题方法
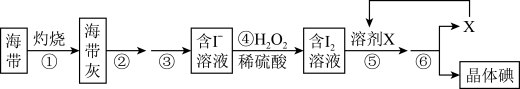
4 . 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请回答下列问题:
(1)实验时灼烧海带通常应在__________ (填仪器名称)内进行。
(2)步骤④中反应的离子方程式是___________________________________ 。
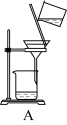
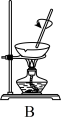
(3)上述流程③、⑤中的实验操作分别包括下图中的__________ 、__________ (按操作顺序选填字母代号)。

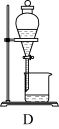
(4)检验提取碘后的溶液中没有单质碘残留,所用试剂是_______ ,现象是______ 。

请回答下列问题:
(1)实验时灼烧海带通常应在
(2)步骤④中反应的离子方程式是
(3)上述流程③、⑤中的实验操作分别包括下图中的




(4)检验提取碘后的溶液中没有单质碘残留,所用试剂是
您最近一年使用:0次
名校
解题方法
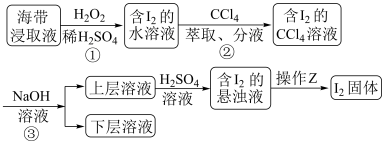
5 . 为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是( )

下列说法正确的是( )
A.①中反应的离子方程式:2I-+ H2O2 I2+ 2OH- I2+ 2OH- |
| B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出 |
| C.③操作使用的是反萃取法,得到的上层溶液中含有I- |
| D.操作Z的名称是加热 |
您最近一年使用:0次
2020-04-27更新
|
568次组卷
|
16卷引用:【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题
【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题安徽省滁州市定远县民族中学2017-2018学年高二下学期期末考试化学试题安徽省合肥市庐江县2019-2020学年高一下学期期末考试化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期末考试化学试题2017届北京市海淀区高三上学期期末化学试卷广西南宁市第二中学2018届高三2月月考理综化学试题甘肃省武威第一中学2018-2019学年高二下学期第一次阶段测试化学试题山东省泰安第一中学2019-2020学年高一下学期期中考试化学试题北京市清华附中2019-2020学年高一下学期居家自主学习在线检测化学试题(已下线)第6单元 常见的非金属元素(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷(人教版2019)必修第二册 第八章 化学与可持续发展 章末综合检测卷山东省泰安市宁阳一中2020-2021学年高一下学期第一次考试化学试题湖北省咸丰春晖学校2020-2021学年高一下学期第三次月考化学试题北京师范大学附属实验中学2020-2021学年高一下学期期中考试化学测试A卷(已下线)第5周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)第9周 晚练题-备战2022年高考化学周测与晚练(新高考专用)
名校
解题方法
6 . 海带中含有丰富的碘。为了从海中提取碘,某研究性学习小姐设计并进行了以下实验,请填写下列空白:
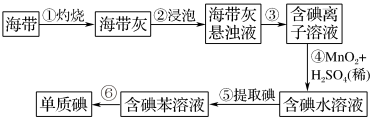
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是___ (用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是___ ,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是__ 。
(3)步骤④反应的离子方程式是___ 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是__ 、___ 。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___ 。

(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是
(3)步骤④反应的离子方程式是
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
您最近一年使用:0次
2020-02-28更新
|
1305次组卷
|
19卷引用:2015-2016学年安徽合肥168中高一上开学考试化学试卷
2015-2016学年安徽合肥168中高一上开学考试化学试卷(已下线)2011-2012学年湖南省望城一中高一下学期期末考试化学试卷(已下线)2012年鲁科版高中化学选修6 1.2 植物中某些成分的提取练习卷广东省佛山市超盈实验中学2016-2017学年高一下学期期末模拟化学试题贵州省毕节市威宁县黑石中学2017-2018学年高一下学期6月份考试化学试题云南省建水县民中2017-2018学年高一下学期6月份考试化学试题甘肃省酒泉市敦煌中学2019届高三一诊化学试题湖南省长沙市铁路一中2017-2018学年高一上学期期末考试化学试题湖南省长沙市铁路一中2017-2018学年高一下学期期末考试化学试题【全国百强校】山西省晋中市平遥2019届高三上学期九月质检化学试题2020年春季人教版高中化学必修2第四章《化学与自然资源的开发利用》测试卷(已下线)【新东方】2020-31(已下线)【南昌新东方】2019 安义中学、南昌十九中 高一上第一次月考广东省梅州市五华县2018-2019学年高一上学期第五次质量监测化学试题广西钦州市2019-2020学年高一下学期期末教学质量监测化学(理)试题山西省大同一中2019-2020学年高一下学期6月月考化学试题(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)湖南省长沙市第一中学2021-2022学年高一下学期第三次阶段性检测化学试题(已下线)第2讲 卤素及海水提溴、提碘
7 . 海洋资源的利用具有广阔前景。
(1)海水淡化的方法有_____ (选填一种即可)。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是____ 。
(3)下图是从海水中提取镁的简单流程。
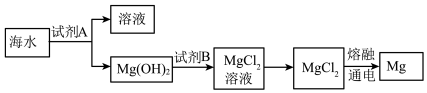
工业上常用于沉淀Mg2+的试剂A 的俗名是___ ,Mg(OH)2转化为MgCl2的离子方程式是_______ 。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
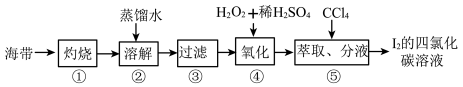
①灼烧海带至灰烬时所用的主要仪器名称是_______ 。步骤②加热煮沸一会的目的是______________ 。
② 步骤④向滤液中加H2O2和稀H2SO4溶液,写出该反应的离子方程式_______________ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈____________ 色。
(1)海水淡化的方法有
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是
(3)下图是从海水中提取镁的简单流程。

工业上常用于沉淀Mg2+的试剂A 的俗名是
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
② 步骤④向滤液中加H2O2和稀H2SO4溶液,写出该反应的离子方程式
您最近一年使用:0次
8 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___ (填序号)
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)如图是从海水中提取镁的简单流程。
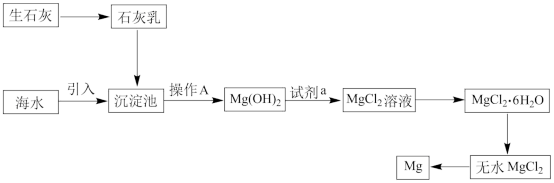
①操作 A是___ 。
②海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?___
(3)利用海底的“可燃冰”制作的酸性燃料电池的总反应式为:CH4+2O2=CO2+2H2O,则该燃料电池负极的电极反应式为____ 。
(4)海带灰中富含以 I- 形式存在的碘元素,实验室提取 I2的途径如图所示:
干海带 海带灰
海带灰 滤液
滤液
 I2
I2
①灼烧海带至灰烬时所用的主要仪器是____ (填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式____ 。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)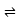 CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
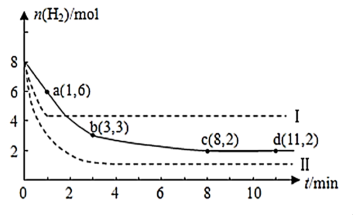
①a点正反应速率___ (填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是____ mol/L。
③能够说明该反应达到化学平衡状态的标志是___ 。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(1)无需经过化学变化就能从海水中获得的物质是
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)如图是从海水中提取镁的简单流程。

①操作 A是
②海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
(3)利用海底的“可燃冰”制作的酸性燃料电池的总反应式为:CH4+2O2=CO2+2H2O,则该燃料电池负极的电极反应式为
(4)海带灰中富含以 I- 形式存在的碘元素,实验室提取 I2的途径如图所示:
干海带
 海带灰
海带灰 滤液
滤液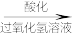
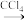
 I2
I2①灼烧海带至灰烬时所用的主要仪器是
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
CH3OH(g)+H2O(g),某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示,a,b,c,d 括号内数据表示坐标。
①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
您最近一年使用:0次
名校
9 . 实验室从含碘废液(除H2O外,含有CCl4、I2、I−等)中回收碘,其实验过程如下:
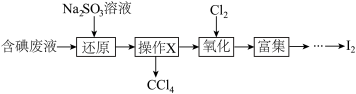
下列叙述不正确的是

下列叙述不正确的是
| A.“操作X”的名称为萃取,可在分液漏斗中进行 |
| B.“还原”步骤发生的反应为:SO32−+I2+H2O == 2I−+SO42−+2H+ |
| C.“氧化”过程中,可用双氧水替代氯气 |
| D.“富集”即I2富集于有机溶剂,同时除去某些杂质离子 |
您最近一年使用:0次
2019-07-20更新
|
661次组卷
|
10卷引用:安徽省合肥一六八中学、铜陵一中等四校2019-2020学年高二上学期开学联考
安徽省合肥一六八中学、铜陵一中等四校2019-2020学年高二上学期开学联考安徽省滁州市明光中学2019-2020学年高二上学期开学考试化学试题【校级联考】浙江省“温州十五校联合体”2018-2019学年高一下学期期中考试化学试题甘肃省兰州市第一中学2018-2019学年高一下学期期末考试化学试题甘肃省张掖市临泽县第一中学2018-2019学年高一下学期期末考试化学试题高一必修第二册(人教2019版)第八章 第一节 自然资源的开发利用 综合训练(已下线)易错21 化学工艺流程类选择题-备战2021年高考化学一轮复习易错题(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用广西钦州市2020-2021学年高一下学期期末考试化学(理)试题(已下线)专题八工艺流程图(讲)
名校
10 . 下列表示对应化学反应的离子方程式不正确 的是
A.向Al2(SO4)3溶液中加入过量氨水:Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH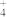 |
| B.Cl2与H2O反应:Cl2+H2O=2H++ClO-+Cl- |
| C.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O |
D.碳酸氢钙溶液中加入足量烧碱溶液:Ca2+ +2HCO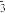 +2OH-=CaCO3 ↓+CO +2OH-=CaCO3 ↓+CO +2H2O +2H2O |
您最近一年使用:0次
2018-08-28更新
|
218次组卷
|
3卷引用:安徽省宣城市郎溪县郎溪中学2018-2019学年高二上学期直升部返校考化学试题



