河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题
河南
高三
阶段练习
2021-11-02
345次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、有机化学基础、化学实验基础、物质结构与性质
河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题
河南
高三
阶段练习
2021-11-02
345次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、有机化学基础、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 北京时间2021年6月17日9时22分,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射。北京时间2021年6月17日18时48分,航天员聂海胜、刘伯明、汤洪波先后进入天和核心舱,标志着中国人首次进入自己的空间站。下列说法正确的是
| A.空间站舷窗使用的耐辐射石英玻璃的主要成分为SiO2 |
| B.火箭外层耐高温材料为AlCl3 |
| C.航天员出舱活动时所穿的舱外航天服全由纯棉纺织而成 |
| D.长征火箭的推进剂中只含有液氢一种物质 |
【知识点】 二氧化硅的用途解读 化学科学对人类文明发展的意义解读
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
2. 在下列过程中对应的离子方程式正确的是
A.银单质溶于稀硝酸:Ag+2H++ =Ag++NO↑+H2O =Ag++NO↑+H2O |
B.用标准草酸溶液滴定KMnO4:2 +16H++5 +16H++5 =2Mn2++10CO2↑+8H2O =2Mn2++10CO2↑+8H2O |
| C.醋酸钠溶液显碱性:H2O+CH3COO-=OH-+CH3COOH |
D.实验室用硫酸铜和碳酸钠溶液制备碱式碳酸铜:H2O+2Cu2++2 =Cu2(OH)2CO3↓+CO2↑ =Cu2(OH)2CO3↓+CO2↑ |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 在实验室中,下列除杂试剂和操作都正确的是
| 选项 | 物质 | 杂质 | 试剂 | 操作 |
| A | CO2 | HCl | NaOH溶液 | 洗气 |
| B | HBr | Br2 | 氨水 | 洗气 |
| C | 苯甲酸 | 砂子 | 水 | 重结晶 |
| D | 乙酸乙酯 | 乙酸、乙醇 | 饱和Na2CO3溶液 | 过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. 在2020年第七十五届联合国大会上,我国向世界郑重承诺力争在2030年前实现碳达峰,努力争取在2060年前实现碳中和。将CO2与甲醇直接合成碳酸二甲酯,不仅能有效减少CO2的排放,还可以得到重要有机中间体碳酸二甲酯。一种利用含铈(Ce)催化剂实现该反应的催化循环原理如下图所示,有关说法正确的是
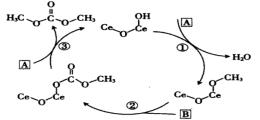

| A.物质A为CO2 |
| B.反应②的类型为取代反应 |
| C.总反应式为:CO2+2CH3OH→H2O+O=C(OCH3)2 |
| D.反应过程中Ce的化合价发生了变化 |
您最近一年使用:0次
2021-11-01更新
|
276次组卷
|
2卷引用:河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题
单选题
|
适中(0.65)
解题方法
5. 短周期元素X、Y、Z、W的原子序数依次增大,其中Z、W的单质是常见的消毒剂。由这四种元素组成的化合物A是一种重要的脱氢剂,A与氢气反应可以生成B,其过程如下图所示。下列说法错误的是
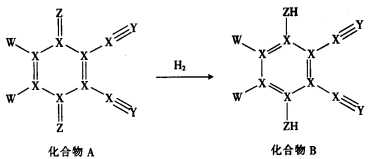

| A.W的最高价氧化物对应的水化物是一种强酸 |
| B.Y、Z与氢组成的化合物一定是共价化合物 |
| C.A分子中所有原子可能共平面 |
| D.B的同分异构体中与B官能团的种类和数目完全相同的还有10种 |
您最近一年使用:0次
单选题
|
适中(0.65)
6. 有机电合成是用电化学的方法进行有机合成的技术。下图是在KI-CH3OK-CH3OH体系中,以石墨为电极电解2-丁酮制备中间体3-碘-2-丁酮的原理图。下列说法错误的是
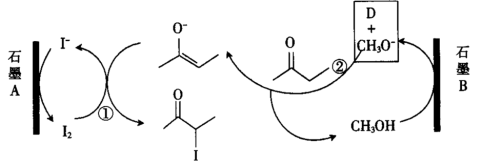

| A.石墨A为阳极 |
| B.物质D是氢气 |
C.反应①的方程式为: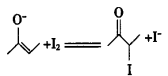 |
D.整个过程的总反应为: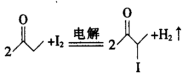 |
您最近一年使用:0次
2021-11-01更新
|
157次组卷
|
2卷引用:河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题
单选题
|
较难(0.4)
名校
解题方法
7. HA是一元弱酸,微溶盐MA2的饱和溶液中c(M2+)随c(H+)而变化,M2+不发生水解。定义如下关系:pM=-lgc(M2+),δ(A-)= 。25℃时,实验测得pM与δ(A-)的关系如下图所示,其中D点对应的pH=5.0.已知lg2≈0.3,则下列说法正确的是
。25℃时,实验测得pM与δ(A-)的关系如下图所示,其中D点对应的pH=5.0.已知lg2≈0.3,则下列说法正确的是
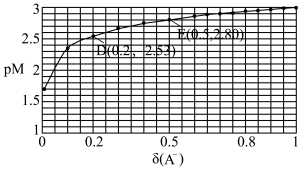
 。25℃时,实验测得pM与δ(A-)的关系如下图所示,其中D点对应的pH=5.0.已知lg2≈0.3,则下列说法正确的是
。25℃时,实验测得pM与δ(A-)的关系如下图所示,其中D点对应的pH=5.0.已知lg2≈0.3,则下列说法正确的是
| A.D点存在2c(M2+)=3c(HA) |
| B.E点的pH≈5.6 |
| C.25℃时,Ksp(MA2)的数量级为10-10 |
| D.25℃时,HA的电离常数:Ka为2.5×10-5 |
您最近一年使用:0次
2021-11-01更新
|
710次组卷
|
6卷引用:河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题
河南省部分名校2021-2022学年高三上学期第一次阶段性测试理综化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)新疆岳普湖县2021-2022学年高二下学期第一次学情调研测试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第54讲 水溶液中四大平衡常数的综合应用(已下线)微专题 水溶液中四大平衡常数的综合应用四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
8. 一种从废旧锂离子电池正极极片(主要为LiCoO2,金属铜,石墨以及少量的铁和铝)回收制备Co3O4和Li2CO3的工艺流程如图所示,回答相应问题。
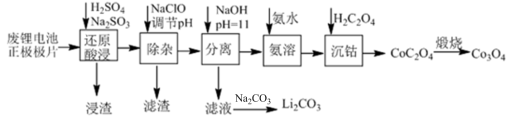
(1)还原酸浸时能提高浸出率的合理方法有___________ (答出2点),写出LiCoO2发生的化学方程式___________ 。
(2)除杂步骤中NaClO的作用为___________ 。调节pH的合理范围为___________ 。
(3)浸渣中除了未完全反应的LiCoO2和石墨还有_______ 。滤渣的主要成分为_______ 。
(4)氨溶过程中Co以[Co(NH3)6]2+形式存在,写出氨溶时发生的离子方程式_________ 。
(5)写出煅烧步骤的化学方程式___________ 。

| Fe2+ | Fe3+ | Al3+ | Co2+ | |
| 开始沉淀时pH | 7.5 | 2.1 | 3.5 | 7.9 |
| 完全沉淀时pH | 9.7 | 3.2 | 4.7 | 9.2 |
| 沉淀开始溶解pH | - | - | 7.8 | - |
| 沉淀溶解完全pH | - | - | 10.8 | - |
(1)还原酸浸时能提高浸出率的合理方法有
(2)除杂步骤中NaClO的作用为
(3)浸渣中除了未完全反应的LiCoO2和石墨还有
(4)氨溶过程中Co以[Co(NH3)6]2+形式存在,写出氨溶时发生的离子方程式
(5)写出煅烧步骤的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
9. 由于钠资源储量丰富,便于开采,价格便宜,钠离子电池有望成为下一代大规模储能电池。NaV2(PO4)2O2F和Na3V2(PO4)2O2F是我国化学家最近研制的钠离子电池的正极材料。Na3V2(PO4)2O2F可以通过下列方法制备。
I.称取4.55gV2O5固体于烧杯中,加入稍过量的草酸溶液,待固体完全溶解,得到蓝色的VOC2O4溶液。
II.将步骤I所得蓝色溶液全部转移至塑料瓶中,加入适量NaH2PO4和NaF固体,用28%氨水调节pH至7,在70℃的条件下搅拌2h,产生浅绿色固体,停止加热。
III.冷却,经一系列操作,称量得到绿色粉末状产品8.56g。
已知:VO2+为蓝色,能水解为VO(OH)2,在碱性条件下易被空气氧化。
回答下列问题:
(1)写出生成VOC2O4的化学方程式___________ ;草酸稍过量的原因___________ 。
(2)步骤II用塑料瓶的原因___________ ;控制反应温度的方法为___________ 。
(3)为使反应达到最佳转化率则加入的NaH2PO4和NaF的物质的量之比为___________ ;若反应过程中pH过小,可能造成的后果是___________ 。
(4)步骤III中一系列操作为___________ 。
(5)计算本实验的产率为___________ 。(用百分数表示,精确到整数)
(6)一种钠离子电池以金属钠为负极,NaV2(PO4)2O2F和Na3V2(PO4)2O2F掺杂石墨作正极,电解质为NaPF6的有机溶液,则该电池放电时正极电极反应为:___________ 。
I.称取4.55gV2O5固体于烧杯中,加入稍过量的草酸溶液,待固体完全溶解,得到蓝色的VOC2O4溶液。
II.将步骤I所得蓝色溶液全部转移至塑料瓶中,加入适量NaH2PO4和NaF固体,用28%氨水调节pH至7,在70℃的条件下搅拌2h,产生浅绿色固体,停止加热。
III.冷却,经一系列操作,称量得到绿色粉末状产品8.56g。
已知:VO2+为蓝色,能水解为VO(OH)2,在碱性条件下易被空气氧化。
回答下列问题:
(1)写出生成VOC2O4的化学方程式
(2)步骤II用塑料瓶的原因
(3)为使反应达到最佳转化率则加入的NaH2PO4和NaF的物质的量之比为
(4)步骤III中一系列操作为
(5)计算本实验的产率为
(6)一种钠离子电池以金属钠为负极,NaV2(PO4)2O2F和Na3V2(PO4)2O2F掺杂石墨作正极,电解质为NaPF6的有机溶液,则该电池放电时正极电极反应为:
您最近一年使用:0次
10. 氢的热值高、无污染使其成为理想的能源。工业制取氢气的主要方法有煤转化、天然气转化等方法。
煤制取氢的主要原理可简化为如下反应:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) △H1=-131.5kJ·mol-1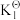
反应②:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.2kJ·mol-1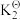
反应③:CaO(s)+CO2(g)⇌CaCO3(s) △H3=-179.2kJ·mol-1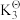
对于反应:aA(g)+bB(g)⇌cC(g)+dD(g)其标准平衡常数: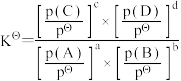
在温度恒定为1120K,压强恒定为16pΘ的反应炉内加入2molC(s)、2molH2O(g)、2molCaO(s),发生上述3个反应,平衡时CO的分压p(CO)=5pΘ。已知:PΘ=105Pa。该温度下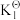 =20,
=20,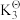 =1。
=1。
(1)写出反应③的标准平衡常数表达式: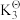 =
=___________ 。
(2)反应④:C(s)+CO2(g)⇌2CO(g) △H4=___________ 。
(3)求该温度下反应②的标准平衡常数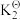 =
=___________ 。
(4)平衡时H2的分压p(H2)=___________ Pa,平衡时剩余C(s)的质量=___________ g。
(5)简述CaO(s)的作用___________ 。平衡后再加入2molCaO(s)对最终氢气的产率有何影响___________ 。
A.增大 B.减小 C.无影响 D.无法判断
(6)利用CO2作为生产各种燃料和化学物质的来源,是实现碳中和的有效策略之一、其中,电催化还原CO2具有易于直接控制、以可再生的电能驱动、能将CO2转化为多种碳产物、通常在室温常压下进行等优点,受到广泛的研究。在铜电极上将CO2还原为CO的机理如图所示:
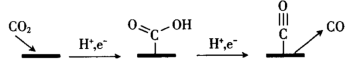
写出该机理过程总的电极方程式:___________ 。
煤制取氢的主要原理可简化为如下反应:
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) △H1=-131.5kJ·mol-1
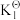
反应②:CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=-41.2kJ·mol-1
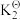
反应③:CaO(s)+CO2(g)⇌CaCO3(s) △H3=-179.2kJ·mol-1
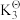
对于反应:aA(g)+bB(g)⇌cC(g)+dD(g)其标准平衡常数:
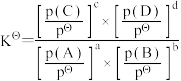
在温度恒定为1120K,压强恒定为16pΘ的反应炉内加入2molC(s)、2molH2O(g)、2molCaO(s),发生上述3个反应,平衡时CO的分压p(CO)=5pΘ。已知:PΘ=105Pa。该温度下
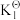 =20,
=20,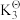 =1。
=1。(1)写出反应③的标准平衡常数表达式:
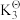 =
=(2)反应④:C(s)+CO2(g)⇌2CO(g) △H4=
(3)求该温度下反应②的标准平衡常数
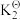 =
=(4)平衡时H2的分压p(H2)=
(5)简述CaO(s)的作用
A.增大 B.减小 C.无影响 D.无法判断
(6)利用CO2作为生产各种燃料和化学物质的来源,是实现碳中和的有效策略之一、其中,电催化还原CO2具有易于直接控制、以可再生的电能驱动、能将CO2转化为多种碳产物、通常在室温常压下进行等优点,受到广泛的研究。在铜电极上将CO2还原为CO的机理如图所示:

写出该机理过程总的电极方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
11. 贵重金属铜、银、金在元素周期表中处于同一族。它们自古以来就用作货币,故该族元素又称为“货币元素”。回答相关问题。
(1)写出基态铜原子的价电子排布式___________ 。
(2)CuSO4在碱性条件下加入双缩脲HN(CONH2)2,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。
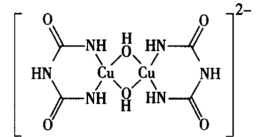
该离子中非金属元素的电负性由大到小的排列为___________ 。1mol该离子含有配位键的数目为___________ NA。
(3)无水Cu(NO3)2在很长的时间内都没有制备成功,因而认为不存在,直到后来利用单质Cu和液态N2O4反应成功制备。已知液态N2O4会发生类似水的自耦电离N2O4⇌NO++ 。
。
①写出该反应的化学方程式___________ ;
②写出与NO+互为等电子体的1种分子___________ 和1种离子___________ 。
(4)Ag+与SCN-反应得到一种白色难溶固体,该物质实际上是一种聚合结构,如图所示。
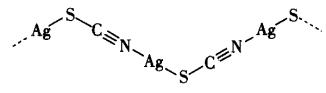
指出该结构中S的杂化方式___________ ,写出该白色固体的最简式___________ 。
(5)Au的原子序数为79,则其在元素周期表中的位置为___________ ;Au与F2和O2在一定条件下可以生成[O2]+[AuF6]-。则该物质的晶体类型为___________ 。
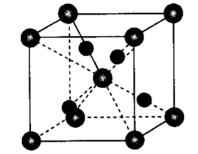
(6)氧化亚铜的晶胞如图,属于立方晶系。其密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,则晶胞参数a=___________ pm,铜与铜原子的最短距离为___________ apm。
(1)写出基态铜原子的价电子排布式
(2)CuSO4在碱性条件下加入双缩脲HN(CONH2)2,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

该离子中非金属元素的电负性由大到小的排列为
(3)无水Cu(NO3)2在很长的时间内都没有制备成功,因而认为不存在,直到后来利用单质Cu和液态N2O4反应成功制备。已知液态N2O4会发生类似水的自耦电离N2O4⇌NO++
 。
。①写出该反应的化学方程式
②写出与NO+互为等电子体的1种分子
(4)Ag+与SCN-反应得到一种白色难溶固体,该物质实际上是一种聚合结构,如图所示。

指出该结构中S的杂化方式
(5)Au的原子序数为79,则其在元素周期表中的位置为
(6)氧化亚铜的晶胞如图,属于立方晶系。其密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,则晶胞参数a=

您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
12. 奈韦拉平是HIV—1的非核苷类逆转录酶抑制剂。以化合物A为原料的一种合成路线如
图所示,回答相关问题。
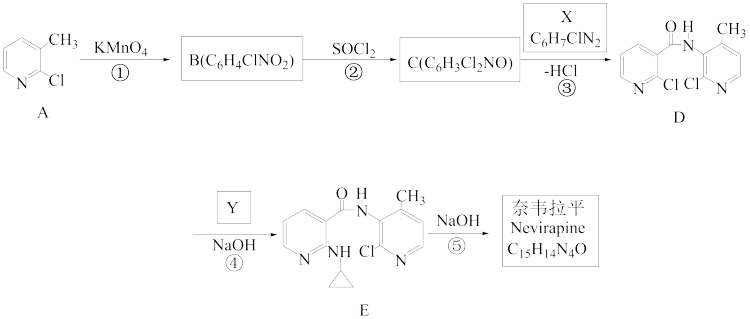
已知:R1NH2+R2Cl+NaOH→R1NHR2+NaCl+H2O
(1)对吡啶环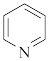 进行系统命名编号时,N原子为1号位,则A的名称为
进行系统命名编号时,N原子为1号位,则A的名称为___________ 。
(2)化合物D中官能团的名称___________ 、___________ 。(不考虑吡啶环)
(3)反应①的反应类型为___________ 。
(4)写出化合物X的结构简式___________ 。
(5)反应④的化学方程式为___________ 。
(6)化合物C的同分异构体中,含有苯环和亚硝基(-NO)的化合物有___________ 种。
(7)写出奈韦拉平的结构简式___________ 。
图所示,回答相关问题。

已知:R1NH2+R2Cl+NaOH→R1NHR2+NaCl+H2O
(1)对吡啶环
 进行系统命名编号时,N原子为1号位,则A的名称为
进行系统命名编号时,N原子为1号位,则A的名称为(2)化合物D中官能团的名称
(3)反应①的反应类型为
(4)写出化合物X的结构简式
(5)反应④的化学方程式为
(6)化合物C的同分异构体中,含有苯环和亚硝基(-NO)的化合物有
(7)写出奈韦拉平的结构简式
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、有机化学基础、化学实验基础、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硅的用途 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 离子方程式的正误判断 氧化还原反应方程式的配平 硝酸的强氧化性 水解的离子方程式书写 | |
| 3 | 0.65 | 乙酸乙酯制备实验的综合考查 物质的分离、提纯 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 | |
| 4 | 0.65 | 加成反应 化学科学对人类文明发展的意义 大气污染的治理原理及方法 | |
| 5 | 0.65 | 同分异构体的数目的确定 有机分子中原子共面的判断 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 6 | 0.65 | 电解原理的理解及判断 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.4 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 难溶电解质的溶解平衡 溶度积常数相关计算 | |
| 二、解答题 | |||
| 8 | 0.4 | 氧化还原反应方程式的配平 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 原电池电极反应式书写 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.4 | 盖斯定律的应用 化学平衡常数的有关计算 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 11 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 常见官能团名称、组成及结构 同分异构体的数目的确定 有机合成综合考查 有机推断综合考查 | 有机推断题 |



