江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题
江苏
高二
阶段练习
2019-10-31
259次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学反应原理、化学实验基础、物质结构与性质
江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题
江苏
高二
阶段练习
2019-10-31
259次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 《可再生能源法》倡导碳资源的高效转化及循环利用。下列做法与上述理念相违背 的是
| A.加快石油等化石燃料的开采和使用 | B.大力发展煤的气化及液化技术 |
| C.以CO2 为原料生产可降解塑料 | D.将秸秆进行加工转化为乙醇燃料 |
您最近一年使用:0次
2019-01-27更新
|
366次组卷
|
14卷引用:2016届江苏省苏中三市高三第二次调研测试化学试卷
2016届江苏省苏中三市高三第二次调研测试化学试卷2016届江苏省南通市高三下学期第三次教学调研化学试卷2015-2016学年江苏省淮安市高一下学期期末化学试卷2015-2016学年河北省永年二中高一下学期期末化学试卷【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题山东省济宁市鱼台县第一中学2020届高三上学期期中考试化学试题江苏省南通市如皋中学2019~2020学年度高三上学期教学质量调研(三)化学试题重庆市西南大学附属中学2020届高三第五次月考理综化学试题江苏省高淳高级中学2020-2021学年高二上学期第一次阶段考试化学试题重庆市万州二中2020-2021学年高二下学期期中考试化学试题(已下线)课后-8.3 环境保护与绿色化学-人教2019必修第二册(已下线)第23练 环境保护与绿色化学-2023年高考化学一轮复习小题多维练(全国通用)江苏省扬州大学附属中学2023-2024学年高二下学期 3月月考化学试卷
单选题
|
较易(0.85)
名校
2. 下列有关化学用语表示正确的是
| A.乙酸乙酯的最简式:C4H8O2 | B.丙醛的结构简式:CH3CH2COH |
C.四氯化碳的电子式: 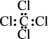 | D.聚乙烯的结构简式: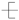 CH2—CH2 CH2—CH2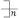 |
您最近一年使用:0次
2019-01-27更新
|
88次组卷
|
2卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
单选题
|
较易(0.85)
名校
3. 下列有机物命名正确的是
A. 1,3-二甲基丁烷 1,3-二甲基丁烷 |
B.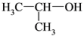 2-羟基丙烷 2-羟基丙烷 |
C.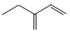 3-乙基-1,3-丁二烯 3-乙基-1,3-丁二烯 |
D.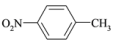 对硝基甲苯 对硝基甲苯 |
您最近一年使用:0次
2019-01-27更新
|
629次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
4. 下列说法正确的是
| A.分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛的同分异构体共有4种 |
| B.分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应的同分异构体共有3种 |
| C.3--甲基--3--乙基戊烷的一氯代物有5种 |
| D.2--氯丁烷与NaOH乙醇溶液共热的反应产物中一定不存在同分异构体 |
您最近一年使用:0次
2019-10-24更新
|
162次组卷
|
2卷引用:江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题
单选题
|
较易(0.85)
名校
5. 下列说法正确的是
| A.石油分馏、煤的干馏都是物理变化 |
| B.苯和甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
| C.1-氯丙烷和2-氯丙烷互为同分异构体,通过核磁共振氢谱不能鉴别二者 |
| D.通过红外光谱分析可以区分甲醇与甲酸甲酯 |
您最近一年使用:0次
2019-01-27更新
|
381次组卷
|
6卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
6. 某有机物的结构简式为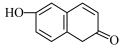 。下列关于该有机物的叙述正确的是( )
。下列关于该有机物的叙述正确的是( )
 。下列关于该有机物的叙述正确的是( )
。下列关于该有机物的叙述正确的是( )| A.该有机物属于芳香烃 |
| B.该有机物苯环上一氯代物有6种 |
| C.该有机物可发生取代、加成、加聚、消去反应 |
| D.1 mol该有机物在适当条件下,最多可与2molBr2发生取代反应 |
您最近一年使用:0次
2019-06-06更新
|
164次组卷
|
3卷引用:【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
7. 用下图所示装置进行实验,其中合理的是
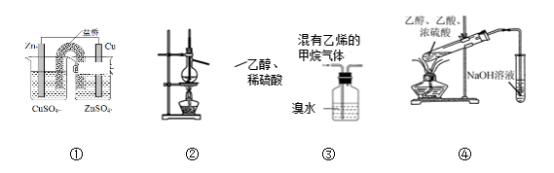

| A.装置①能将化学能转化为电能 |
| B.装置②可用于实验室制乙烯 |
| C.装置③可除去甲烷中的乙烯 |
| D.装置④可用于实验室制乙酸乙酯 |
您最近一年使用:0次
2019-01-27更新
|
180次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
8. 下列各组中的反应,属于同一反应类型的是( )
| A.一溴丙烷和氢氧化钠水溶液加热反应;一溴丙烷和氢氧化钠醇溶液加热反应 |
| B.甲苯硝化制对硝基甲苯;甲苯和高锰酸钾反应制苯甲酸 |
| C.1—氯环己烷制环己烯;丙烯与溴反应制1,2—二溴丙烷 |
| D.乙醇与氢溴酸反应制溴乙烷;乙酸和乙醇反应制乙酸乙酯 |
您最近一年使用:0次
2019-06-06更新
|
214次组卷
|
3卷引用:【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
9. 下列离子方程式书写正确的是
| A.醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑ |
B.惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O 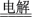 Mg(OH)2↓ + H2↑ + Cl2↑ Mg(OH)2↓ + H2↑ + Cl2↑ |
C.苯酚钠溶液中通入少量的CO2: +H2O+CO2→ +H2O+CO2→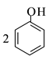 + + |
D.用银氨溶液检验乙醛中的醛基:CH3CHO+ +2OH- +2OH- CH3COONH4+H2O+2Ag↓+3NH3↑ CH3COONH4+H2O+2Ag↓+3NH3↑ |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2019-01-27更新
|
91次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
10. “类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
| B.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
| D.苯属于芳香烃,符合通式CnH2n-6(n≥6),则芳香烃的通式就是CnH2n-6(n≥6)。 |
【知识点】 同周期元素性质递变规律 氢键对物质性质的影响解读
您最近一年使用:0次
2019-06-06更新
|
115次组卷
|
2卷引用:【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
11. 下列与电化学有关的说法正确的是
| A.镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 |
| B.铅蓄电池在充电过程中,两极质量都增大 |
| C.水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀 |
| D.电解精炼铜的过程中,阳极减少的质量一定等于阴极增加的质量 |
您最近一年使用:0次
2019-01-27更新
|
160次组卷
|
2卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
12. 除去下列物质中混入的少量杂质(括号内物质为杂质),能达到实验目的的是
| A.乙醇(水):加足量生石灰,蒸馏 |
| B.苯酚(甲苯):加入足量的酸性KMnO4溶液,充分振荡、静置、分液 |
| C.乙酸乙酯(乙酸):加入足量的NaOH溶液,充分振荡、静置、分液 |
| D.溴苯(溴):加入足量的Na2SO3溶液,充分振荡、静置、分液 |
您最近一年使用:0次
2019-01-27更新
|
292次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
13. 药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
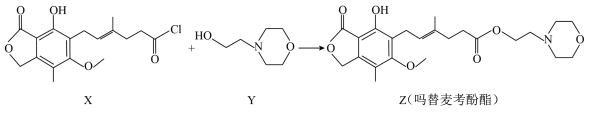 +HCl
+HCl
下列叙述正确的是
 +HCl
+HCl下列叙述正确的是
| A.用溴水可鉴别化合物X和Z | B.化合物Y的分子式为C6H12NO2 |
| C.化合物Z中含有手性碳原子 | D.1mol化合物Z可以与3molNaOH反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
14. 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | ||||||||||||||
B.基态Fe原子的外围电子排布图为: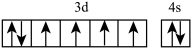 | ||||||||||||||
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | ||||||||||||||
D.某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅣA族
|
您最近一年使用:0次
单选题
|
适中(0.65)
名校
15. 如图为氢氧燃料电池原理示意图,下列叙述不正确的是
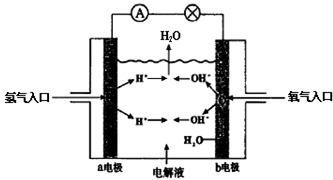

| A.a电极是负极 |
| B.b电极上发生氧化反应 |
| C.该电池工作时化学能转化为电能 |
| D.该电池的总反应为2H2 + O2 =2H2O |
【知识点】 原电池原理 原电池正负极判断解读 原电池电极反应式书写解读
您最近一年使用:0次
2016-12-09更新
|
968次组卷
|
4卷引用:2013-2014学年江苏省扬州市高二下学期学业水平模拟化学试卷(二)
(已下线)2013-2014学年江苏省扬州市高二下学期学业水平模拟化学试卷(二)2014-2015学年湖北省老河口市第二中学高二下学期期末化学试卷江苏省扬州中学2017-2018学年高二上学期期中考试化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题
单选题
|
适中(0.65)
名校
16. 短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| C.元素Y的简单气态氢化物的热稳定性比Z的强 |
| D.化合物X2Z2与W2Z2所含化学键类型完全相同 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
2016-11-17更新
|
520次组卷
|
17卷引用:2015届江苏省连云港等四市高三一模化学试卷
2015届江苏省连云港等四市高三一模化学试卷2016届福建省长泰县二中高三下学期第一次月考理科综合化学试卷2017届江苏省丹阳高级中学高三上期初考试化学试卷2017届江苏省苏州市高三上学期期初调研化学试卷2017届湖北省荆州中学高三上第四次质检化学试卷安徽省六安市第一中学2016-2017学年高一下学期第二次段考化学试题西藏山南地区第二高级中学2017届高三第三次模拟考试理综化学试题湖北省荆州中学2018届高三第二次月考化学试题陕西省2018届高三年级第二次大联考理综化学试题【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题湖北省荆州中学、宜昌一中两校2019-2020学年高二上学期期末考试化学试题黑龙江省大庆市第四中学2020届高三下学期第四次检测理综化学试题重庆南开中学高2020届高三化学网络复习理综测试化学试题云南省玉溪市峨山彝族自治县第一中学2021-2022学年高一下学期3月月考化学试题浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题云南省祥华教育集团2023-2024学年高一下学期5月联考化学试题
单选题
|
较易(0.85)
名校
解题方法
17. 反应N2(g)+O2(g) 2NO(g)在恒温密闭容器中进行,下列不改变反应速率的是
2NO(g)在恒温密闭容器中进行,下列不改变反应速率的是
 2NO(g)在恒温密闭容器中进行,下列不改变反应速率的是
2NO(g)在恒温密闭容器中进行,下列不改变反应速率的是| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |
【知识点】 浓度对化学反应速率的影响解读 压强对化学反应速率的影响解读
您最近一年使用:0次
2023-04-25更新
|
407次组卷
|
82卷引用:2013-2014学年云南省玉溪一中高二上学期期中考试化学试卷
(已下线)2013-2014学年云南省玉溪一中高二上学期期中考试化学试卷(已下线)2014年高一下学期化学必修2 2-3-1 化学反应的速率练习卷(已下线)2013-2014四川省雅安中学下学期期中考试高一化学试卷(已下线)2013-2014重庆市重庆一中下学期期中考试高二化学试卷(已下线)2015届湖北省武汉市部分学校新高三起点调研测试化学试卷(已下线)2015届黑龙江省哈尔滨市第三中学高三第一次测试化学试卷(已下线)2014-2015学年浙江嘉兴第一中学高二上第一次测试化学卷2014-2015学年广东省汕头市潮师高中高二上学期期中化学(理)试卷2014-2015浙江省乐清市二中高二上学期10月月考化学试卷2015-2016学年山西省忻州一中高一下期中化学试卷2015-2016学年河北省枣强中学高一下期中化学试卷2015-2016学年河北省定州中学高一6月月考化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年广东省汕头市金山中学高二上学期期中化学试卷2016-2017学年湖北省重点高中联考协作体高一下学期期中考试化学试卷山西省大同市第一中学2017-2018学年高二9月阶段测试化学试题甘肃省天水市第一中学2017-2018学年高二上学期第一阶段考试(理)化学试题四川省成都市实验中学2017-2018学年高二上学期期中考试化学试题福建省三明市第一中学2017-2018学年高二上学期期中考试(理)化学试题广东省惠州市2017-2018学年高二上学期期末教学质量检测(理)化学试题四川省广安市2017-2018学年高二上学期期末考试化学试题四川省棠湖中学2017-2018学年高二下学期开学考试化学试题浙江省诸暨市牌头中学2017-2018学年高一下学期期中考试(A)化学试题辽宁省实验中学2017-2018学年高一下学期期末考试化学试题甘肃省临泽县第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省雅安市雅安中学2018-2019学年高二上学期期中考试化学试题青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题新疆自治区生产建设兵团第一师高级中学2018-2019学年高二上学期第二次月考化学试题北京四中2018-2019学年高一下学期期末考试化学试题辽宁省阜新市第二高级中学2019-2020学年高二上学期第一次月考化学试题甘肃省靖远县第四中学2019-2020学年高二10月月考化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题内蒙古自治区集宁一中2019-2020学年高二上学期期中考试化学试题陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.1 化学反应速率(讲)-《2020年高考一轮复习讲练测》(已下线)专题06 化学反应的速率和限度(核心精讲)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)北京市平谷区第五中学2019-2020学年高一下学期期中考试化学试题甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题辽宁省阜新市第二高级中学2019-2020学年高一下学期线上考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次调研考试化学试题安徽省安庆市怀宁县第二中学2019-2020学年高二下学期期中线上检测化学试题黑龙江省大庆第一中学2019-2020学年高一下学期期末考试化学试题安徽省滁州市天长市天长中学2019-2020学年高一5月段考化学试题辽宁省铁岭市开原市高级中学2019-2020学年高一下学期第二次月考化学试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期期中考试化学试题(已下线)2.2 影响化学反应速率的因素(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第二章 化学反应速率和化学平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第三节 化学反应的快慢和限度 教材帮贵州省遵义市航天高级中学2020-2021学年高二上学期第一次月考化学(理)试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题吉林油田第十一中学2020-2021学年高二上学期期中考试化学试题青海省西宁市海湖中学2020-2021学年高二上学期第二次阶段测试化学试题甘肃省兰州市第四片区2020-2021学年高二上学期期末考试化学试题江西省南昌市新建区第二中学2019--2020学年高一下学期期终考试化学试题安徽省淮北市树人高级中学2020-2021学年高二下学期开学考试化学试题甘肃省兰州市教育局第四片区2020-2021学年高一下学期期中考试化学试题甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(理)试题陕西省宝鸡市千阳中学2019-2020学年高一下学期月考化学试题吉林省延边第二中学2020-2021学年高一下学期期末考试化学试题甘肃省庆阳市第六中学2020-2021学年高一下学期期末考试化学(理)试题安徽省芜湖市华星学校2021-2022学年高二上学期第一次月考化学试卷河北省盐山中学2021-2022学年高二上学期9月月考化学试题山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题河北省唐山市遵化市2021-2022学年高二上学期期中考试化学试题上海市南洋模范中学2021-2022学年高一下学期3月考化学试题上海市南洋模范中学2021-2022学年高一下学期3月月考化学试题内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题吉林省长春市第五中学2021-2022学年高一下学期期末考试化学试题黑龙江省伊春市伊美区第二中学2022-2023学年高二上学期开学考试化学试题 (已下线)第18讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(新教材新高考)河南省洛阳市2022-2023学年高二上学期10月强基联盟大联考化学试题(已下线)2.1.2 化学反应速率的影响因素——同步学习必备知识河北省廊坊市三河市第三中学2021-2022学年高一下学期5月线上考试化学试题黑龙江省饶河县高级中学2021-2022学年高一下学期期中考试化学试题吉林省延边朝鲜族自治州汪清县汪清第四中学2020-2021学年高一下学期期末考试化学试题(已下线)【2023】【高一下】【其他】【余高1】【高中化学】【刘尼尼收集】北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题甘肃省天水市第一中学2022-2023学年高一下学期5月期中考试化学试题甘肃省天水市秦安县第一中学2022-2023学年高二上学期期末考试化学试题陕西省西安市高陵区第一中学2022-2023学年高二下学期开学考试化学试题北京市育才学校2023-2024学年高一下学期期中考试化学(选考)试题
四、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
18. 四氢呋喃是常用的有机溶剂,可由有机物 (分子式为
(分子式为 )通过下列路线制得。
)通过下列路线制得。
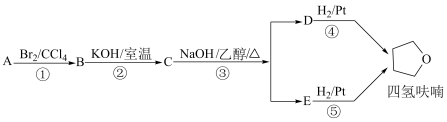
已知: 。下列说法正确的是
。下列说法正确的是
 (分子式为
(分子式为 )通过下列路线制得。
)通过下列路线制得。
已知:
 。下列说法正确的是
。下列说法正确的是| A.C中含有的官能团仅为醚键 |
B.A的结构简式是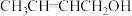 |
| C.D和E均能使酸性高锰酸钾溶液褪色 |
| D.①③的反应类型分别为加成反应、消去反应 |
您最近一年使用:0次
2021-06-13更新
|
185次组卷
|
5卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题(鲁科版2019)选3第2章 第1节有机化学反应类型 课时1(已下线)回归教材重难点06 “10种”官能团性质回放-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)北京市中国人民大学附属中学2019-2020学年高二上学期期中考试化学试题
五、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
19. 下面是以秸秆(含多糖类物质)为原料合成聚酯类高分子化合物的路线:
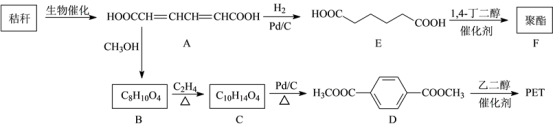
已知: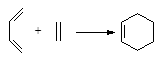
请回答下列问题:
食物中的纤维素虽然不能为人体直接提供能量,但能促进肠道蠕动,黏附并带出有害物质,俗称人体内的“清道夫”。从纤维素的化学成分看,它是一种____ (填序号)。
a.单糖 b.多糖 c.氨基酸 d.脂肪
A中官能团的名称为____ 、____ 。
A生成B的反应条件为____ 。
B、C的结构简式分别为____ 、____ 。
写出E→F的化学反应方程式______ 。
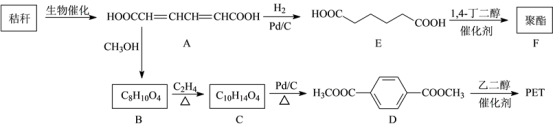
已知:
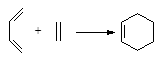
请回答下列问题:
食物中的纤维素虽然不能为人体直接提供能量,但能促进肠道蠕动,黏附并带出有害物质,俗称人体内的“清道夫”。从纤维素的化学成分看,它是一种
a.单糖 b.多糖 c.氨基酸 d.脂肪
A中官能团的名称为
A生成B的反应条件为
B、C的结构简式分别为
写出E→F的化学反应方程式
您最近一年使用:0次
2019-01-27更新
|
208次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
20. 有机物G是合成新农药的重要中间体。以化合物A为原料合成化合物G的工艺流程如下:
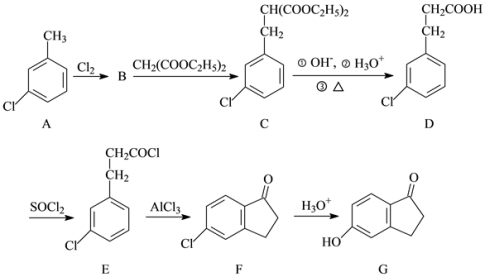
(1)化合物G中含氧官能团的名称为________ 。
(2)反应D→E的反应类型为________ 。
(3)化合物B的分子式为C7H6Cl2,B的结构简式为______ 。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:______ 。
①能发生银镜反应;
②核磁共振氢谱显示氢原子的峰值比为3∶2∶2∶1。
(5)请以化合物F和CH2(COOC2H5)2为原料制备 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
__________________
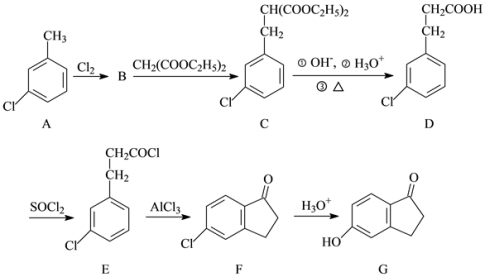
(1)化合物G中含氧官能团的名称为
(2)反应D→E的反应类型为
(3)化合物B的分子式为C7H6Cl2,B的结构简式为
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:
①能发生银镜反应;
②核磁共振氢谱显示氢原子的峰值比为3∶2∶2∶1。
(5)请以化合物F和CH2(COOC2H5)2为原料制备
 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
2019-01-27更新
|
239次组卷
|
3卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
解答题-结构与性质
|
适中(0.65)
名校
21. 有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______ 。
(2)C元素的第一电离能比氧元素的第一电离能_____ (填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______ ,CA3分子的空间构型是_____ 。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________ (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______ 。
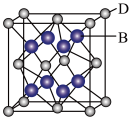
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式
(2)C元素的第一电离能比氧元素的第一电离能
(3)CA3分子中C原子的杂化轨道类型是
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为

您最近一年使用:0次
2019-06-06更新
|
106次组卷
|
2卷引用:【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题
六、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
22. 铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
(1)写出铅酸蓄电池放电时正极的电极反应式:______ ,放电时,H+向电池____ 极定向移动(填“正”或“负”)。
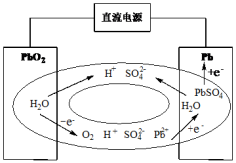
(2)传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为______ 。
(3)铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
①电解精炼时阳极泥的主要成分是______ (元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是______ (填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________ 。
(1)写出铅酸蓄电池放电时正极的电极反应式:
(2)传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为

(3)铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
| 成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
| % | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式
您最近一年使用:0次
2019-01-27更新
|
182次组卷
|
5卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题【全国百强校】江苏省扬州市扬州中学2018-2019学年高二下学期期中考试化学试题江苏省沭阳县修远中学2019-2020学年高二10月月考化学(选修)试题江苏省扬州市江都区大桥高级中学2020-2021学年高二6月学情调研化学试题(已下线)第13练 电解原理及其应用-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)
七、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
23. 高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+核外电子排布式为___ 。
(2)ClO4-空间构型是___ ;与ClO4-互为等电子体的一种分子为___ (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为___ ;C、N、O三种元素的电负性由大到小的顺序为___ 。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为___ 。
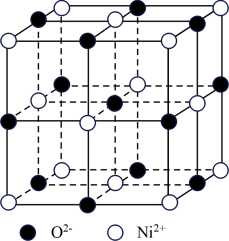
(1)Ni2+核外电子排布式为
(2)ClO4-空间构型是
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为

您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
24. 肼(N2H4)主要用作火箭和喷气发动机燃料。
(1) 已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态N2O4作推进剂,燃烧生成两种无污染的气体。写出反应的热化学方程式____ 。偏二甲肼(1,1-二甲基肼)也是一种高能燃料,写出其结构简式______ 。
(2)肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的化学方程式________ ,理论上,每消耗64 g肼可除去标准状况下O2________ L
(3)科学家用肼作为燃料电池的燃料,电池结构如图1所示,
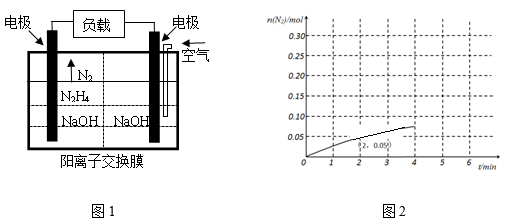
写出电池负极的电极反应式:________ 。
(4)N2H4在特定条件下(303K,Pt,Ni作催化剂)可以发生部分分解:N2H4(g) 2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=
2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=________ 。
(1) 已知 ① 2O2(g)+N2(g) === N2O4(l) ΔH=a kJ·mol-1
② N2(g)+2H2(g) === N2H4(l) ΔH=b kJ·mol-1
③ 2H2(g) + O2(g) = 2H2O(g) ΔH=c kJ·mol-1
某型号火箭采用液态肼和液态N2O4作推进剂,燃烧生成两种无污染的气体。写出反应的热化学方程式
(2)肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的化学方程式
(3)科学家用肼作为燃料电池的燃料,电池结构如图1所示,

写出电池负极的电极反应式:
(4)N2H4在特定条件下(303K,Pt,Ni作催化剂)可以发生部分分解:N2H4(g)
 2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=
2H2(g)+N2(g),在2 L的密闭容器中加入0.1 mol N2H4(g),测得0-4分钟内N2的物质的量随时间的变化曲线如图2所示,写出0-2分钟内H2的平均反应速率v(H2)=
您最近一年使用:0次
2019-01-27更新
|
161次组卷
|
2卷引用:【市级联考】江苏省扬州市2018-2019学年高二上学期期末考试化学试题
解答题-结构与性质
|
较易(0.85)
名校
解题方法
25. 锰元素的化合物在多个领域中均有重要应用。
(1)二价锰的 3 种离子化合物的熔点如表:
上表3种物质中晶格能最大的是___ 。
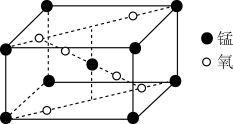
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___ 。
(3)与NO3-互为等电子体的一种分子为___ (填化学式)。
(1)二价锰的 3 种离子化合物的熔点如表:
| 物质 | MnCl2 | MnS | MnO |
| 熔点 | 650℃ | 1610℃ | 2800℃ |
(2)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为

(3)与NO3-互为等电子体的一种分子为
您最近一年使用:0次
八、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
26. 氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2 N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
用NO2表示0~2s内该反应的平均反应速率___ 。在第5s时,NO2的转化率为___ 。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__ 。
 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。一定条件下,在2L密闭容器内,反应2NO2
 N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、有机化学基础、化学反应原理、化学实验基础、物质结构与性质
试卷题型(共 26题)
题型
数量
单选题
16
多选题
2
解答题
6
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | “白色污染”危害及防治 化石能源 能源的充分利用 新能源的开发 | |
| 2 | 0.85 | 有关粒子结构的化学用语 化学用语综合判断 有机物的结构式、结构简式、比例模型、球棍模型、最简式 | |
| 3 | 0.85 | 烷烃的命名 烯烃、炔烃的命名 烷烃系统命名法 含有苯环的化合物的命名 | |
| 4 | 0.65 | 有机官能团的性质及结构 同分异构体的数目的确定 有机反应与同分异构的综合考查 醇的催化氧化 | |
| 5 | 0.85 | 物理变化与化学变化 红外光谱 核磁共振氢谱 苯的同系物 | |
| 6 | 0.65 | 有机反应类型 含有酚羟基的物质性质的推断 多官能团有机物的结构与性质 | |
| 7 | 0.65 | 原电池 实验室制备乙烯综合考查 乙酸乙酯制备实验 综合实验设计与评价 | |
| 8 | 0.65 | 消去反应 苯的同系物的硝化反应 卤代烃 乙醇的氧化反应 | |
| 9 | 0.65 | 离子方程式的正误判断 | |
| 10 | 0.65 | 同周期元素性质递变规律 氢键对物质性质的影响 | |
| 11 | 0.65 | 铅蓄电池 铜的电解精炼 金属的防护 | |
| 13 | 0.65 | 分子的手性 含有酚羟基的物质性质的推断 多官能团有机物的结构与性质 有机物的检验 | |
| 14 | 0.65 | 物质结构与性质综合考查 基态核外电子排布规律 核外电子排布的表示形式 电离能变化规律 | |
| 15 | 0.65 | 原电池原理 原电池正负极判断 原电池电极反应式书写 | |
| 16 | 0.65 | 元素周期律、元素周期表的推断 | |
| 17 | 0.85 | 浓度对化学反应速率的影响 压强对化学反应速率的影响 | |
| 二、多选题 | |||
| 12 | 0.65 | 有机物分离提纯操作的综合考查 乙酸乙酯制备实验 物质分离、提纯的常见化学方法 化学实验方案的设计与评价 | |
| 18 | 0.65 | 单烯烃的加成反应 烯烃与强氧化性物质的反应 卤代烃的消去反应 有机物的合成 | |
| 三、解答题 | |||
| 19 | 0.65 | 有机物的合成 有机物的推断 有机合成综合考查 | 有机推断题 |
| 20 | 0.65 | 有机反应类型 根据要求书写同分异构体 根据题给物质选择合适合成路线 多官能团有机物的结构与性质 | 有机推断题 |
| 21 | 0.65 | 电子排布式 电离能变化规律 共价键的形成及主要类型 晶胞的有关计算 | 结构与性质 |
| 23 | 0.65 | 元素性质与电负性的关系 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 24 | 0.65 | 盖斯定律的应用 化学反应速率计算 原电池电极反应式书写 燃料电池 | 原理综合题 |
| 25 | 0.85 | 等电子原理的应用 晶胞的有关计算 离子晶体 | 结构与性质 |
| 四、填空题 | |||
| 22 | 0.65 | 铅蓄电池 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 电解原理的应用实验 | |
| 26 | 0.85 | 影响化学反应速率的因素 化学反应速率计算 化学平衡的有关计算 转化率的相关计算及判断 | |



