2020届高考化学二轮复习大题精准训练——高考题中方程式(电极、氧化还原、热化学)书写专练
全国
高三
专题练习
2020-02-07
365次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、化学实验基础、常见无机物及其应用、物质结构与性质
2020届高考化学二轮复习大题精准训练——高考题中方程式(电极、氧化还原、热化学)书写专练
全国
高三
专题练习
2020-02-07
365次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、化学实验基础、常见无机物及其应用、物质结构与性质
一、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
解题方法
1. 电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。

①固体电解质中O2-向______ 极移动(填“正”或“负”)。
②写出V2O5电极的电极反应式:_____________ 。
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
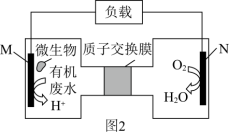
①N极为____ 极(填“正”或“负”),M电极反应式______________________ 。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为______ g。
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是__________ 。
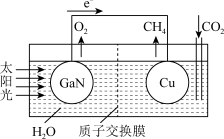
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O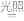 CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。

①固体电解质中O2-向
②写出V2O5电极的电极反应式:
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:

①N极为
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是

A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O
 CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
【知识点】 原电池原理理解解读 原电池电极反应式书写解读
您最近一年使用:0次
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
2. (1)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其电极反应正极:______ ,负极:______ ,该电池总反应的离子方程式为______ .
(2)如果把“碱性电池”改为“酸性电池”,其电极反应正极:______ ,负极:______ ,该电池总反应的离子方程式为______ .
(2)如果把“碱性电池”改为“酸性电池”,其电极反应正极:
【知识点】 原电池 原电池电极反应式书写解读
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
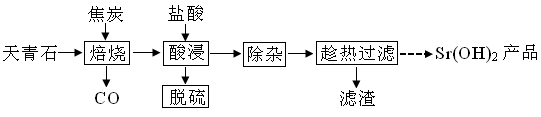
3. 锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:
已知氢氧化锶在水中的溶解度:
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为_____________ 。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=___ 。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____ 。
(3)“趁热过滤”的目的是____ ,“滤渣”的主要成分为___ 。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____ 、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式______ ;再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3溶液。请写出电解时阳极的电极反应:____ 。
已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=
②若pH过大,将导致氢氧化锶的产率降低,请解释原因
(3)“趁热过滤”的目的是
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式
您最近一年使用:0次
2017-11-03更新
|
719次组卷
|
5卷引用:2018届广东省揭阳市高三上学期第一次月考化学试题
解答题-工业流程题
|
较难(0.4)
解题方法
4. 高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________ 。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:
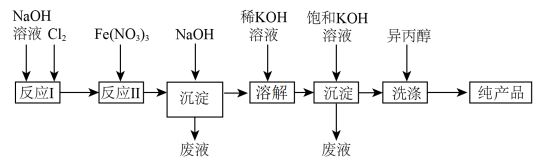
①反应Ⅰ的化学方程式为_________________________________________________ 。
②反应Ⅱ的离子方程式为_________________________________________________ 。
③加入饱和KOH溶液的目的是_________________________________________________ 。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________ 。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________ mL、4 mol·L-1 HNO3。
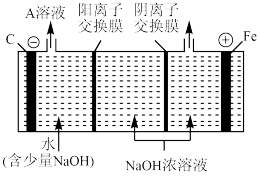
(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________ 。电解后,阴极室得到的A溶液中溶质的主要成分为________ (填化学式)。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:

①反应Ⅰ的化学方程式为
②反应Ⅱ的离子方程式为
③加入饱和KOH溶液的目的是
④高铁酸钾是一种理想的水处理剂,其处理水的原理为
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为
您最近一年使用:0次
2020-01-10更新
|
384次组卷
|
3卷引用:辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题
解答题-工业流程题
|
适中(0.65)
解题方法
5. 硫酸锰广泛应用于医药、食品、农药、造纸等行业,如图是以软锰矿(主要成分是MnO2,还含有SiO2等杂质)和黄铁矿(FeS2)制取MnSO4∙H2O的流程图,已知Ksp(MnCO3)=2.2×10-11,气体 常用作气体肥料。回答下列问题:
常用作气体肥料。回答下列问题:
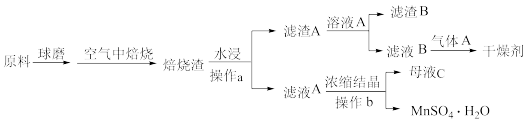
(1)空气中高温焙烧发生反应的化学方程式为________ .
(2)气体 的电子式为
的电子式为________ 。
(3)操作a所用的主要玻璃仪器:________ 。
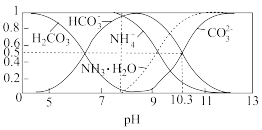
(4)常温下,0.1mol/L碳酸氢铵溶液中微粒浓度分数与pH的关系如图所示,取一定量母液C加入NH4HCO3至其浓度为0.1mol/L可制得高性能强磁性材料MnCO3,该反应的离子方程式为________  同时调pH=10.3,则溶液中c(Mn2+)=
同时调pH=10.3,则溶液中c(Mn2+)=________ .
(5)硫酸锰是工业制备MnO2电极的活性原料,则用惰性电极电解酸性母液C制得MnO2的阳极电极反应式为________  若电路中通过0.3mol电子时,理论上得到MnO2的质量为
若电路中通过0.3mol电子时,理论上得到MnO2的质量为________ g。
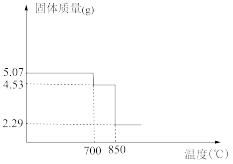
(6)如图是MnSO4∙H2O的热重曲线,则850℃时固体化学式为________ .700℃时发生反应的化学方程式是________ .
 常用作气体肥料。回答下列问题:
常用作气体肥料。回答下列问题:
(1)空气中高温焙烧发生反应的化学方程式为
(2)气体
 的电子式为
的电子式为(3)操作a所用的主要玻璃仪器:
(4)常温下,0.1mol/L碳酸氢铵溶液中微粒浓度分数与pH的关系如图所示,取一定量母液C加入NH4HCO3至其浓度为0.1mol/L可制得高性能强磁性材料MnCO3,该反应的离子方程式为
 同时调pH=10.3,则溶液中c(Mn2+)=
同时调pH=10.3,则溶液中c(Mn2+)=
(5)硫酸锰是工业制备MnO2电极的活性原料,则用惰性电极电解酸性母液C制得MnO2的阳极电极反应式为
 若电路中通过0.3mol电子时,理论上得到MnO2的质量为
若电路中通过0.3mol电子时,理论上得到MnO2的质量为
(6)如图是MnSO4∙H2O的热重曲线,则850℃时固体化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
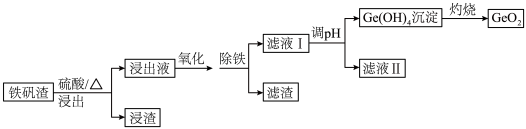
6. 二氧化锗(GeO2)可用于制备半导体材料,某实验小组以铁矾渣(主要成分为FeO、CaO、GeO和SiO2等)为原料制取二氧化锗的工艺流程如下所示。
已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
请回答下列问题:
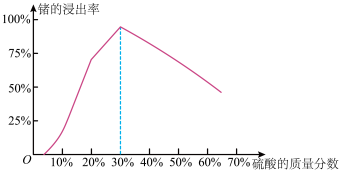
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为________ ,浸渣的主要成分为________________ (填化学式)。
(2)“氧化”时,可选用的试剂为________ (填字母)。
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为________________ 。“氧化”后,选用K3[Fe(CN)6]溶液证明Fe2+已全部被氧化的实验现象为________________________________________________ 。
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为____________________________ 。
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:________________________________ 。
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为___________________ 。

已知:25℃时,部分金属阳离子转化为氢氧化物沉淀时的pH如下表所示。
| 离子 | Fe3+ | Mn2+ | Ge4+ |
| 开始沉淀时的pH | 2.3 | 8.3 | 8.2 |
| 沉淀完全时的pH | 4.1 | 9.8 | 11.2 |
请回答下列问题:
(1)由下图可知,“浸出”时,所用硫酸的最佳质量分数为

(2)“氧化”时,可选用的试剂为
A.KMnO4 B.NaOH C.H2O2 D.I2
(3)“氧化”时,若以适量稀硝酸作氧化剂,则Ge2+被氧化的离子方程式为
(4)“除铁”时,可选用Na2CO3为除铁剂,其原理为
(5)已知Ge(OH)4,具有两性,在得到Ge(OH)4的过程中,若溶液的pH大于12,会导致Ge(OH)4溶解,写出该反应的离子方程式:
(6)利用惰性电极电解酸性GeSO4溶液也可制得GeO2,则阳极的电极反应式为
【知识点】 电解原理的应用 物质分离、提纯综合应用解读 常见无机物的制备解读
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
7. 过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
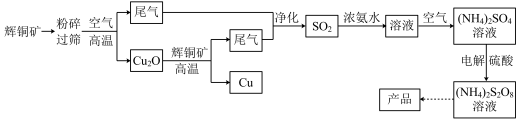
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________ 。在该反应中,n(氧化剂):n(还原剂)=________ 。
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________ 。当电路中转移2.5mol电子时,阴极产生________ (填数值)mol________ (填物质)。

(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________ 、________ 、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________ 。

请回答下列问题:
(1)矿石“粉碎”的目的是
(2)Cu2O和辉铜矿在高温下反应的化学方程式为
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:

(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式
【知识点】 氧化还原反应方程式的配平解读 电解原理 物质制备的探究解读
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
名校
解题方法
8. 某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:
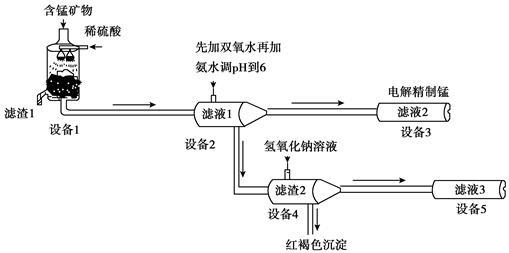
(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是_______ (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是_______ 。
(3)设备2中加足量双氧水的作用是_______ 。设计实验方案检验滤液2中是否存在Fe2+:_______ 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因:_______ 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:
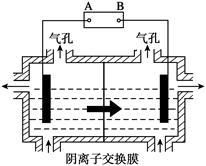
① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的_______ 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为___________ 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______________ 。

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是
(2)设备1中发生氧化还原反应的离子方程式是
(3)设备2中加足量双氧水的作用是
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因:
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式
【知识点】 离子反应的发生及书写 电解原理 常见无机物的制备解读 物质的检验
您最近一年使用:0次
2016-04-28更新
|
580次组卷
|
5卷引用:2016届北京市顺义区高三下学期一模理综化学试卷
9. 某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______ .
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
加氨水调节溶液的pH等于6,则滤渣的成分是______ ,滤液中含有的阳离子有H+和______ .
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______ .
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______ 极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______ .
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______ .

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
10. 可燃冰(天然气水合物,可用CH4∙xH2O表示)的开采和利用,既有助于解决人类面临的能源危机,又能生产一系列的工业产品。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是________ (填“低温、高压”或“高温、低压”)。
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。
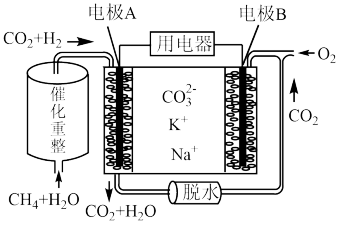
①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) ∆H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) ∆H=________ kJ/mol。
②图中电极A为燃料电池的________ (填“正极”或“负极”),电极B上的电极反应式为________ 。
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
①计算可知C2H2的产率α=________ 。
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是________ 。
(1)可燃冰在一定条件下能够释放出CH4气体,该条件是
(2)熔融碳酸盐型燃料电池(MCFC)通常被称为第二代燃料电池。以CH4为MCFC的燃料时,电池的工作原理如图所示。

①CH4(g)和H2O(g)可在电池内部经重整反应转化为H2(g)和CO2(g),已知CH4和H2的标准燃烧热分别为890.3kJ/mol和285.8kJ/mol,H2O(l)=H2O(g) ∆H=+41 kJ/mol,则甲烷重整反应的热化学方程式为CH4(g)+2H2O(g)=4H2(g)+CO2(g) ∆H=
②图中电极A为燃料电池的
(3)在压强为p的恒压容器中,CH4在电弧炉的作用下制取乙炔,化学方程式为2CH4=C2H2+3H2。下表为反应体系的物料衡算表。
| 成分 | 进料 | 出料 | ||
| 纯CH4 | CH4 | C2H2 | H2 | |
| 物质的量(mol) | 44.8 | 19.13 | 8.96 | 39.5 |
①计算可知C2H2的产率α=
②出料中C2H2和H2的物质的量之比并不等于1:3,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
11. 某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
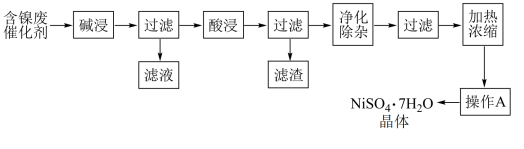
现用含镍废催化剂制备NiSO4∙7H2O晶体,其流程图如下:
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______ 。
(2)“酸浸”所使用的酸为______ 。
(3)“净化除杂”需加入H2O2溶液,其作用是______ 。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______ 、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______ 。
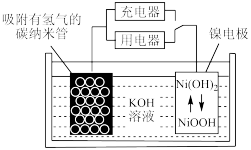
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______ 。
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4∙7H2O晶体,其流程图如下:

回答下列问题:

(1)“碱浸”时发生反应的离子方程式为
(2)“酸浸”所使用的酸为
(3)“净化除杂”需加入H2O2溶液,其作用是
(4)“操作A”为
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
困难(0.15)
解题方法
12. 常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
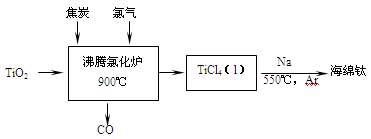
(1)TiCl4遇水强烈水解,写出其水解的化学方程式___________________ 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是___________ 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为_______ 。

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为____ mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K=_____________ 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是___________ (填序号)。
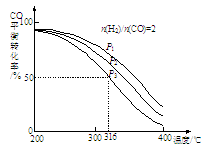
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
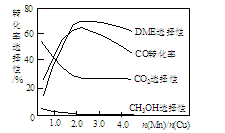
催化剂中n(Mn)/n(Cu)约为___________ 时最有利于二甲醚的合成。

(1)TiCl4遇水强烈水解,写出其水解的化学方程式
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为

③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3+ 6HCl(浓) =" KCl" + 3Cl2↑+ 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)
 CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。①该反应的平衡常数表达式为K=
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是

a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。

催化剂中n(Mn)/n(Cu)约为
【知识点】 氧化还原反应方程式的配平解读 化学平衡的移动及其影响因素 电解原理
您最近一年使用:0次
2015-03-20更新
|
1273次组卷
|
2卷引用:2015届江苏省泰州市姜堰区高三下学期期初联考化学试卷
解答题-原理综合题
|
适中(0.65)
解题方法
13. NH3可用于制氮肥 尿素、碳铵等
尿素、碳铵等 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为________________ 。联氨的电子式为________________ 。
(2)已知①N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ/mol,②N2H4(l)+O2(g)⇌N2(g)+2H2O(l) ∆H=-624kJ/mol,则反应2NH3(g) +2H2O(l)⇌N2H4(l)+O2(g) +3H2(g)的∆H=________ ,该反应的平衡常数表达式为________________ ,在常温下该反应________ (填“能”或“不能”)自发进行。为了提高N2H4的产率,下列措施可行的是____________________ 。
A.增加H2O(l)的量 B.增大压强 C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入________________ ,阴极通入________________ ,阴极的电极反应式为________________ 。
 尿素、碳铵等
尿素、碳铵等 、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:
、HNO3、铵盐、纯碱,还可用于制合成纤维、塑料、染料等。回答下列问题:(1)传统的联氨(N2H4)合成方法是用NaClO溶液氧化NH3得到,反应的化学方程式为
(2)已知①N2(g)+3H2(g)⇌2NH3(g) ∆H=-92.4kJ/mol,②N2H4(l)+O2(g)⇌N2(g)+2H2O(l) ∆H=-624kJ/mol,则反应2NH3(g) +2H2O(l)⇌N2H4(l)+O2(g) +3H2(g)的∆H=
A.增加H2O(l)的量 B.增大压强 C.降低温度 D.及时导出O2
(3)现在采用电解法合成氨,在电解法合成氨的过程中,用石墨作电极,阳极通入
您最近一年使用:0次



