山东省泰安市东平县高级中学2021届高三上学期第二次质量检测化学试题
山东
高三
阶段练习
2020-10-31
305次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、物质结构与性质、化学与STSE、化学实验基础
山东省泰安市东平县高级中学2021届高三上学期第二次质量检测化学试题
山东
高三
阶段练习
2020-10-31
305次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、物质结构与性质、化学与STSE、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 下列分类或归类正确的是
| A.CaSO4、HCl、Na2O均为强电解质 |
| B.雾、云、烟、纳米材料均为胶体 |
| C.NaOH、HD、H2O均为化合物 |
| D.C60、金刚石、石墨均为碳的同位素 |
您最近一年使用:0次
2020-04-03更新
|
82次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
单选题
|
适中(0.65)
2. 下列关于元素及其化合物的说法正确的是( )
| A.SO2具有漂白性,所以能使碘的淀粉溶液由蓝色变为无色 |
| B.金属单质Na、Mg、Fe在一定条件下都与水反应生成H2和相应的碱 |
| C.SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 |
| D.NaHCO3可用于制备纯碱、食品发酵剂、治疗胃酸过多的药剂 |
您最近一年使用:0次
2020-04-03更新
|
130次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
单选题
|
适中(0.65)
3. NA代表阿伏加 德罗常数的值。下列说法正确的是
| A.标准状况下,11.2 L14CO2含有的中子数为11NA |
| B.常温下,12 g NaHSO4中含有的离子数为0.3NA |
| C.将22.4 L Cl2通入NaOH溶液中充分反应,转移电子数为NA |
| D.6.4 g S2和S8的混合物中所含硫原子数为0.2NA |
您最近一年使用:0次
2020-04-03更新
|
93次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
单选题
|
适中(0.65)
4. A、B、C、D均为短周期主族元素,原子序数依次增大,其原子的最外层电子数之和为22,A和C同主族,B原子的电子层数与最外层电子数相等,B、C、D的单质均可与NaOH溶液反应。下列说法正确的是
| A.原子半径和简单离子半径的关系均满足:B>A |
| B.简单氢化物的沸点:A>C |
| C.B与C形成的化合物在水中不存在,故不能用单质直接化合反应制得 |
| D.工业上常用电解B、D形成的化合物来制备B单质 |
您最近一年使用:0次
2020-04-03更新
|
89次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
5. 多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处。Na2Sx在碱性溶液中与NaClO反应可生成Na2SO4,下列说法错误的是
| A.NaClO是氧化剂 |
| B.Na2SO4 是氧化产物 |
| C.若反应中Na2Sx与NaClO的物质的量之比为1:13,则x为5 |
| D.若x=3,则反应的离子方程式为:S32-+10ClO-+4OH-=3SO42-+10Cl-+2H2O |
【知识点】 氧化还原反应的几组概念解读 与氧化剂、还原剂有关的计算解读
您最近一年使用:0次
2020-04-03更新
|
127次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
单选题
|
适中(0.65)
解题方法
6. 下列过程中没有明显实验现象的是
| A.向Fe(NO3)2溶液中滴加NaHSO4溶液 |
| B.向饱和的NaCl和NH3的混合溶液中通入过量的CO2 |
| C.将NaHCO3和NaOH两种溶液混合 |
| D.向Na2S2O3溶液中加入稀盐酸 |
您最近一年使用:0次
2020-07-28更新
|
132次组卷
|
2卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
单选题
|
适中(0.65)
7. 设NA为阿伏加 德罗常数值,下列有关叙述正确的是
| A.0.1molKHSO4晶体中含有H+数为0.1NA |
| B.标准状况下,5.6LSO3分子中含有的电子总数为10NA |
| C.33.6gFe与足量的水蒸气加热充分反应,转移电子数为1.6NA |
| D.5.6gFe投入100mL3.5 mol • L-1硝酸中,充分反应转移电子总数为0.3NA |
您最近一年使用:0次
2020-07-28更新
|
146次组卷
|
3卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
8. 下列反应的离子方程式中不正确的是
| A.向H218O中投入Na2O2固体:2Na2O2+ 2H218O=4Na++4OH-+18O2↑ |
B.在碱性条件下,NH 被氧气氧化成NO 被氧气氧化成NO :NH :NH +2O2+2OH-=NO +2O2+2OH-=NO +3H2O +3H2O |
C.将酸性KMnO4溶液和H2C2O4溶液混合: 2MnO + 5H2C2O4+6H+=2Mn2++10CO2↑+8H2O + 5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
D.等物质的量的Ba(OH)2与明矾加入足量水中: 3Ba2++6OH-+2Al3++3SO =3BaSO4↓+2Al(OH)3↓ =3BaSO4↓+2Al(OH)3↓ |
您最近一年使用:0次
2020-07-28更新
|
177次组卷
|
3卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
9. 下列实验装置或图象与对应的说法正确的是


| A.利用甲装置灼烧海带 |
| B.利用乙装置分离苯和四氯化碳 |
| C.根据图丙溶解度曲线,能通过一次结晶,将x、y两种物质基本分离 |
| D.图丁向容量瓶转移溶液 |
您最近一年使用:0次
2020-07-28更新
|
92次组卷
|
2卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
单选题
|
较易(0.85)
解题方法
10. 下列有关化学用语表示正确的是
| A.次氯酸的结构式:H-Cl-O | B.质子数为52、中子数为75的碲原子: |
C.S2−的结构示意图: | D.四氯化碳的电子式: |
您最近一年使用:0次
2020-04-03更新
|
150次组卷
|
3卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)
单选题
|
适中(0.65)
解题方法
11. 为探究硫酸亚铁分解产物,用如图所示装置进行实验。打开K1和K2,缓缓通入N2,加热。实验后反应管a中残留固体为红色粉末。下列说法中不正确的是


| A.气体产物只有SO2和SO3,则反应管a内生成等物质的量的氧化产物和还原产物 |
| B.装置b中的试剂为BaCl2溶液,也可用Ba(NO3)2溶液 |
| C.装置c中的试剂为品红溶液,也可用酸性KMnO4溶液 |
| D.装置d中的试剂为NaOH溶液,为尾气处理装置 |
您最近一年使用:0次
2020-07-28更新
|
151次组卷
|
2卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
12. 根据下列操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
B | 用氢氧化铁胶体做电泳实验,通电一段时间后,与电源负极相连的一极颜色变深 | 氢氧化铁胶体带正电荷 |
C | 将少量铜粉加入1.0 mol • L-1 Fe2(SO4)3溶液中 | 金属铁比铜活泼 |
D | 向饱和硼酸溶液中加入少量Na2CO3粉末,无气泡冒出 | 酸性:碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-28更新
|
353次组卷
|
2卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
单选题
|
适中(0.65)
解题方法
13. 实验室用浓氨水和生石灰制取氨气,并探究氨气的性质,其装置如图所示,下列说法错误的是
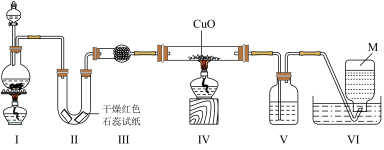

| A.一段时间后,Ⅱ中干燥红色石蕊试纸变蓝色 |
| B.Ⅲ干燥管中盛放的试剂可以是无水氯化钙 |
| C.Ⅳ中黑色粉末逐渐变为红色说明氨气具有还原性 |
| D.实验结束后,应先将导气管从水槽中拿出再熄灭酒精灯 |
您最近一年使用:0次
2020-04-03更新
|
209次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
二、多选题 添加题型下试题
多选题
|
适中(0.65)
解题方法
14. 下列反应的离子方程式书写正确的是( )
A.向次氯酸钠溶液中通入过量SO2:ClO-+SO2+H2O = HClO +  |
| B.物质的量相等的溴化亚铁跟氯气反应:2Fe2+ + 2Br-+ 2Cl2 = 2Fe3++ Br2 + 4Cl- |
C.Ca(HCO3)2溶液中加入过量NaOH:Ca2++2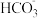 +2OH-=CaCO3↓+ +2OH-=CaCO3↓+ +2H2O +2H2O |
| D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
您最近一年使用:0次
三、单选题 添加题型下试题
15. H3AsO3与SnCl2在浓盐酸中反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M。关于该反应的说法中错误的是
| A.M为H2O |
| B.还原剂是Sn2+,还原产物是As |
| C.氧化性:H3AsO3>SnCl62- |
| D.每生成7.5 g As,转移的电子为0.6 mol |
您最近一年使用:0次
2020-04-03更新
|
283次组卷
|
3卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)
四、填空题 添加题型下试题
填空题
|
适中(0.65)
16. 元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)当皮肤划破时可用FeCl3溶液应急止血,用氯化铁固体配制成450 mL 0.1mol·L-1的溶液,配制过程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、______________ 。
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子______________ (填离子符号)。
(3)高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。其工业制备反Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数________ NA。
(4)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O72-还原。其离子方程式:__ 。
(5)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是____________ 。
(1)当皮肤划破时可用FeCl3溶液应急止血,用氯化铁固体配制成450 mL 0.1mol·L-1的溶液,配制过程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、
(2)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后,溶液中大量存在的阳离子
(3)高铁酸钾(K2FeO4)是一种既能杀菌消毒、又能絮凝净水的水处理剂。其工业制备反Fe(OH)3+ClO-+OH-→FeO42-+Cl-+H2O(未配平),每生成1 mol K2FeO4,转移的电子数
(4)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,在酸性条件下可用亚硫酸钠将Cr2O72-还原。其离子方程式:
(5)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,且均为1 mol。向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。则溶液中存在的离子是
您最近一年使用:0次
2019-12-05更新
|
98次组卷
|
2卷引用:山东省德州市2020届高三上学期期中考试化学试题
填空题
|
适中(0.65)
名校
解题方法
17. 如图是元素周期表的一部分,按要求回答问题:
(1)元素④在周期表中位置是_______ 。元素③的最高价氧化物的化学式为________ 。
(2)元素①⑤组成化合物电子式为___________ 。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___ 。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____ 。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____ (用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。
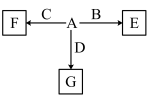
①A和F的化学式分别为_______ 、_______ 。
②B与G反应的化学方程式为____________________ 。
③C与NaOH溶液反应的离子方程式为______________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)元素④在周期表中位置是
(2)元素①⑤组成化合物电子式为
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为
②B与G反应的化学方程式为
③C与NaOH溶液反应的离子方程式为
您最近一年使用:0次
2020-04-03更新
|
1037次组卷
|
5卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)
山东省威海市文登区2019届高三上学期期中考试化学试题(A卷)鲁科版(新)必修第二册第一章检测题湖北省应城市第一高级中学2019-2020学年高一下学期复学摸底测试化学试题山东省泰安市东平县高级中学2021届高三上学期第二次质量检测化学试题(已下线)第15练 第四章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)
五、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
解题方法
18. 钼是人体必须的微量元素之一,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO4▪2H2O)可制造阻燃剂和无公害型冷水系统的金属抑制剂。由钼精矿(主要成分MoS2,含少量PbS等)制备钼及钼酸钠晶体的部分流程如下:
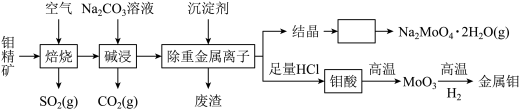
(1)焙烧时,下列措施有利于使钼精矿充分反应的是________ (填序号)。
a 增大空气的进入量 b 将矿石粉碎 c 采用逆流原理
(2)焙烧过程中,每生成1mol MoO3,转移电子数目为_____ 。
(3)写出“碱浸”过程中反应的离子方程式__________ 。
(4)经“结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,题中方框内需要进行的操作是_______ 。
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。

①图象中纵坐标x =______ 。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,该反应的化学方程式为________ 。每生成标准状况下11.2L SO2,消耗氧化剂的物质的量为______ 。

(1)焙烧时,下列措施有利于使钼精矿充分反应的是
a 增大空气的进入量 b 将矿石粉碎 c 采用逆流原理
(2)焙烧过程中,每生成1mol MoO3,转移电子数目为
(3)写出“碱浸”过程中反应的离子方程式
(4)经“结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,题中方框内需要进行的操作是
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。

①图象中纵坐标x =
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,该反应的化学方程式为
【知识点】 氧化还原反应方程式的配平解读 常见无机物的制备解读
您最近一年使用:0次
2020-07-28更新
|
195次组卷
|
2卷引用:山东省威海荣成市2020届高三上学期期中考试化学试题
解答题-无机推断题
|
适中(0.65)
解题方法
19. 某溶液A中可能含有 、
、 、
、 、
、 、
、 、Fe2+、Al3+、Fe3+中的几种离子,且溶液中各离子的物质的量浓度均为0.1 mol/L。现取100 mL该溶液A进行如下实验:
、Fe2+、Al3+、Fe3+中的几种离子,且溶液中各离子的物质的量浓度均为0.1 mol/L。现取100 mL该溶液A进行如下实验:
实验1:向该溶液中逐滴滴入过量的(NH4)2CO3溶液,产生白色沉淀B,并有无色气泡产生。
实验2:静置后,再向溶液中加入过量Ba(OH)2溶液,加热,仍然存在白色沉淀C,并有无色气泡产生。
实验3:静置后,继续向溶液中加入Cu片和过量的盐酸,仍然存在白色沉淀D,溶液变蓝色,并有气泡E产生。
(1)白色沉淀C的成分为_________________ (填化学式);气体E的成分为_______________ 、_______________ (写名称)。
(2)实验1中发生反应的离子方程式为_________________________________________ 。
(3)实验3中发生所有反应的离子方程式为________________________________________ ,
________________________________________________________________________________ 。
(4)溶液A中__________ (填“一定”“可能”或“一定不”)存在 ,理由是
,理由是________________________________________________________ 。
 、
、 、
、 、
、 、
、 、Fe2+、Al3+、Fe3+中的几种离子,且溶液中各离子的物质的量浓度均为0.1 mol/L。现取100 mL该溶液A进行如下实验:
、Fe2+、Al3+、Fe3+中的几种离子,且溶液中各离子的物质的量浓度均为0.1 mol/L。现取100 mL该溶液A进行如下实验:实验1:向该溶液中逐滴滴入过量的(NH4)2CO3溶液,产生白色沉淀B,并有无色气泡产生。
实验2:静置后,再向溶液中加入过量Ba(OH)2溶液,加热,仍然存在白色沉淀C,并有无色气泡产生。
实验3:静置后,继续向溶液中加入Cu片和过量的盐酸,仍然存在白色沉淀D,溶液变蓝色,并有气泡E产生。
(1)白色沉淀C的成分为
(2)实验1中发生反应的离子方程式为
(3)实验3中发生所有反应的离子方程式为
(4)溶液A中
 ,理由是
,理由是
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
解题方法
20. 四氯化钛常温下为无色液体,熔点-23.2℃,沸点136.4℃,极易水解。在900℃时,将氯气通过钛铁矿(主要成分是FeTiO3)和炭粉的混合物可反应生成四氯化钛和氯化铁(熔点306℃,沸点315℃),同时产生一种有毒气体。现制取并收集四氯化钛的装置如图所示(夹持装置略去)。

回答下列问题:
(1)仪器a的名称是____ 。组装好仪器,没加试剂反应前,应该进行的操作是_____ 。
(2)反应开始前,先将钛铁矿粉碎,并与稍过量的炭粉混合均匀,制成多孔状固体混合物,目的是______________ 。
(3)实验中需通入N2两次,第二次通N2的作用是_________ 。
(4)900℃时,A装置中发生反应的化学方程式为__________ 。
(5)B装置中控温箱温度在150~200℃,目的是___________ 。
(6)装置b处存在的缺点是________________ 。
(7)产物TiCl4在热潮湿空气中“发烟”生成TiO2•xH2O,反应方程式为_________ 。

回答下列问题:
(1)仪器a的名称是
(2)反应开始前,先将钛铁矿粉碎,并与稍过量的炭粉混合均匀,制成多孔状固体混合物,目的是
(3)实验中需通入N2两次,第二次通N2的作用是
(4)900℃时,A装置中发生反应的化学方程式为
(5)B装置中控温箱温度在150~200℃,目的是
(6)装置b处存在的缺点是
(7)产物TiCl4在热潮湿空气中“发烟”生成TiO2•xH2O,反应方程式为
您最近一年使用:0次
2020-04-03更新
|
189次组卷
|
2卷引用:山东省威海市文登区2019届高三上学期期中考试化学试题(B卷)
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、物质结构与性质、化学与STSE、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
14
多选题
1
填空题
2
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 分类方法的应用 | |
| 2 | 0.65 | 二氧化硫 二氧化硅 钠与水反应原理 铁与水蒸气的反应 | |
| 3 | 0.65 | 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.65 | 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 5 | 0.65 | 氧化还原反应的几组概念 与氧化剂、还原剂有关的计算 | |
| 6 | 0.65 | 含硫化合物之间的转化 碳酸钠与碳酸氢钠的相互转化 Fe2+的还原性 纯碱的生产 | |
| 7 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 8 | 0.65 | 离子方程式的正误判断 过氧化钠与水的反应 明矾与氢氧化钡溶液反应的离子方程式 | |
| 9 | 0.65 | 一定物质的量浓度的溶液的配制 化学实验基础操作 物质分离、提纯的常见物理方法 | |
| 10 | 0.85 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 共价型分子结构式、电子式 原子、离子、原子团及其电子式的书写与判断 | |
| 11 | 0.65 | 二氧化硫的化学性质 物质性质的探究 | |
| 12 | 0.65 | 胶体的性质和应用 碘与淀粉的显色反应 铁盐 化学实验方案的设计与评价 | |
| 13 | 0.65 | 氨气的结构与性质 氨气的制备 化学实验基础操作 物质性质实验方案的设计 | |
| 15 | 0.65 | 常见氧化剂与还原剂 氧化性、还原性强弱的比较 氧化还原反应有关计算 氧化还原反应的规律 | |
| 二、多选题 | |||
| 14 | 0.65 | 离子方程式的正误判断 氧化性、还原性强弱的比较 二氧化硫的化学性质 Fe2+的还原性 | |
| 三、填空题 | |||
| 16 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 基于氧化还原反应守恒规律的计算 一定物质的量浓度的溶液的配制 | |
| 17 | 0.65 | 元素周期律、元素周期表的推断 元素周期表提供的元素信息 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 四、解答题 | |||
| 18 | 0.4 | 氧化还原反应方程式的配平 常见无机物的制备 | 工业流程题 |
| 19 | 0.65 | 限定条件下的离子共存 有关酸性环境下硝酸根氧化性的有关计算 Fe2+的还原性 | 无机推断题 |
| 20 | 0.65 | 氧化还原反应的应用 氯气的实验室制法 物质的分离、提纯 常见无机物的制备 | 实验探究题 |



