Cu(In1-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]___ ;Ga、In、Se,第一电离能从大到小顺序为___ 。
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是___ 。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是___ 。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为___ 。
(4)SeO32-的立体构型为___ ;SeO2中硒原子采取杂化类型是___ 。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加 德罗常数的值为NA。___ pm。
②Cu2S晶体中,S2-的配位数为___ 。
③Cu2S晶体的密度为ρ=___ g·cm-3(列出计算式即可)。
回答下列问题:
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]
(2)硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为
(4)SeO32-的立体构型为
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加 德罗常数的值为NA。
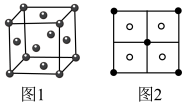
②Cu2S晶体中,S2-的配位数为
③Cu2S晶体的密度为ρ=
2020·安徽·三模 查看更多[7]
河南省南阳市第一中学校2023-2024学年高二下学期第一次月考化学试题 (已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)湖南省株洲市九方中学2022届高三下学期第二次模拟考试化学试题广东省潮州市2021届高考第二次模拟考试化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编安徽省江淮十校2020届高三第三次联考(5月)理综化学试题
更新时间:2020-05-24 12:04:51
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】明代宋应星 《天工开物·铜》写道:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的排布式为:________________________
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式________________________________________ ,[Cu(NH3)4]SO4·H2O中与Cu2+形成配位键的原子是________ (填元素符号),若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行_________________ 实验。
(3)含有钡元素的盐的焰色反应为_______ 色,许多金属盐都可以发生焰色反应,其原因是______________________
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。

①Cu+的配位数为__________ ,
②已知:底边a=b=0.524 nm,高c=1.032 nm,NA为阿伏加 德罗常数的值,CuFeS2晶体的密度是___________ g•cm3(列出计算表达式即可)。
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的排布式为:
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式
(3)含有钡元素的盐的焰色反应为
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。

①Cu+的配位数为
②已知:底边a=b=0.524 nm,高c=1.032 nm,NA为阿伏加 德罗常数的值,CuFeS2晶体的密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ ,该元素在周期表中的位置是_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5°C、 沸点117°C,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填“极性”或“非极性”)分子。
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。 下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
A.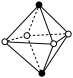 B.
B. C.
C. 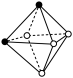 D.
D.  E.
E.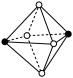
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O(M=278g ·mol-1 )加入含CrO3的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III), 调节溶液pH达8~10,使溶液中的Fe(II)、 Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①根据上述结果可确定铁氧磁体中x=_______ ;
②根据①的结果,在pH<4时,加入FeSO4·7H2O的质量至少是废水中CrO3质量的_______ 倍。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5°C、 沸点117°C,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为
A.
 B.
B. C.
C.  D.
D.  E.
E.
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O(M=278g ·mol-1 )加入含CrO3的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III), 调节溶液pH达8~10,使溶液中的Fe(II)、 Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①根据上述结果可确定铁氧磁体中x=
②根据①的结果,在pH<4时,加入FeSO4·7H2O的质量至少是废水中CrO3质量的
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】钴(Co)在合金工业、催化剂,颜料等方面有重要应用,某湿法炼锌工厂废弃钴渣的成分主要有: 、
、 、
、 ,一种富集钻的工艺流程如图所示:
,一种富集钻的工艺流程如图所示:

(1)Co的价层电子排布式为_______ , 的结构简式如图所示,则Co的配位数为
的结构简式如图所示,则Co的配位数为_______ 。
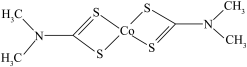
(2) 中Fe的化合价为
中Fe的化合价为_______ ,“酸浸”需要控制溶液的pH值不能过高,其原因是_______ 。
(3)煅烧时产生的气体成分为 、
、_______ 、_______ 。
(4)“烧渣”的主要成分为 ,写出“还原浸出”时的离子方程式:
,写出“还原浸出”时的离子方程式:_______ 。
(5)“氧化沉钴”时氧化剂和还原剂的物质的量之比为_______ 。
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为_______ (填序号),设阿伏加德罗常数的值为_______  ,晶胞参数为a nm,则该晶胞的密度为
,晶胞参数为a nm,则该晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。

A. B.
B. C.
C.
 、
、 、
、 ,一种富集钻的工艺流程如图所示:
,一种富集钻的工艺流程如图所示:
(1)Co的价层电子排布式为
 的结构简式如图所示,则Co的配位数为
的结构简式如图所示,则Co的配位数为
(2)
 中Fe的化合价为
中Fe的化合价为(3)煅烧时产生的气体成分为
 、
、(4)“烧渣”的主要成分为
 ,写出“还原浸出”时的离子方程式:
,写出“还原浸出”时的离子方程式:(5)“氧化沉钴”时氧化剂和还原剂的物质的量之比为
(6)一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为
 ,晶胞参数为a nm,则该晶胞的密度为
,晶胞参数为a nm,则该晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
A.
 B.
B. C.
C.
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】我国科学家相继发明了具有重要工业应用价值的新型非线性光学晶体BBO、LBO,又陆续发展了具有重要应用前景的深紫外非线性光学晶体KBBF、SBBO等,为我国光学事业做出了卓越贡献。
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为___________ 。
②Y的原子序数为39,其在元素周期表中的位置为___________ 。
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为___________ 。
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为___________ ,与该阴离子互为等电子体的离子为___________ 。
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为___________ 。
②该晶体中含有的化学键有___________ ,晶体类型为___________ ,其中B采取___________ 杂化。
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=___________ g·cm-3。(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)
请回答下列问题:
(1)KBBF的化学式为KBe2BO3F2,KBBF晶体的棱镜耦合技术在国际上首次实现了Nd:YVO4激光的6倍频谐波光输出。
①B的价电子层排布式为
②Y的原子序数为39,其在元素周期表中的位置为
③KBe2BO3F2中各元素的第一电离能由小到大的顺序为
④KBF4是合成KBBF的原料之一,其阴离子的空间构型为
(2)BBO晶体和LBO晶体是我国首次走向国际,并被国际上广泛应用的两种晶体。LBO晶体由Li、B、O三种元素组成,晶胞结构及沿b、c轴的投影图如图甲所示(O原子略去),晶体结构中存在(B3O7)5-基团,Li+分布在基团骨架空隙中,如图乙所示。

①LBO晶体化合物的化学式为
②该晶体中含有的化学键有
③已知该晶体的晶胞参数分别为apm、bpm、cpm,α=β=y=90°,则该晶体的密度ρ=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】(1)下列状态的镁中,电离最外层一个电子所需能量最大的是___________ (填标号)。
A.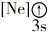 B.
B.
C.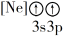 D.
D.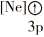
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是___________ 、___________ 。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________ ,其中与乙二胺形成的化合物稳定性相对较高的是___________ (填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因___________ 。
A.
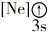 B.
B.
C.
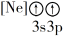 D.
D.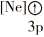
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是
(3)一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/℃ | 1570 | 2800 | 23.8 | −75.5 |
解释表中氧化物之间熔点差异的原因
您最近一年使用:0次
【推荐3】植物生长需要多种矿质元素,其中必须元素就多达14种,需要量比较大的有镁、硫、铁等元素。回答下列问题。
(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为_______ 。
(2)第3周期中,第一电离能大于S的元素有_______ (填元素符号)。
(3)经研究表明Fe3+可以形成配离子[FeCl2(H2O)4]+,与游离的H2O分子相比,其H—O—H键角_______ (填“较大”,“较小”或“相同”),原因是_______ 。
(4)Mg与H2在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90℃,储氢物质X的化学式为_______ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如C点原子的分数坐标为(1,0,0)。已知Mg—H键的键长为r pm,A点位于面对角线上,其原子分数坐标为_______ ,晶胞中A、B两个H之间的核间距d=_______ pm(用代数式表示)。

(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为
(2)第3周期中,第一电离能大于S的元素有
(3)经研究表明Fe3+可以形成配离子[FeCl2(H2O)4]+,与游离的H2O分子相比,其H—O—H键角
(4)Mg与H2在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90℃,储氢物质X的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________ 对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________ I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________ ;
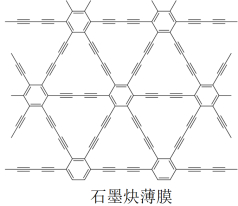
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________ 的杂化方式。
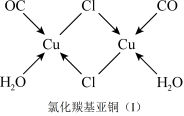
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________ σ键数目。
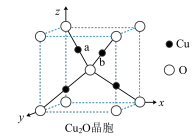
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________ ;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________ 。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________ (填“高”或“低”),请解释原因___________________ 。
(1)基态铜原子核外有
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子



(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某油脂厂废弃的油脂加氢反应的镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4:7H2O);

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)基态Ni2+的价电子排布式为_______ 。H2O2的结构如图所示,则H2O2中的O原子的杂化方式为_______ ,转化过程中的双氧水可用O3代替,O3的空间构型是_______ ,O3是_______ 分子(填“极性“或”非极性”)。

(2)“转化”过程宜控制较低温度的原因是_______ 。
(3)利用上述表格数据,计算Ni(OH)2的Ksp_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
(1)基态Ni2+的价电子排布式为

(2)“转化”过程宜控制较低温度的原因是
(3)利用上述表格数据,计算Ni(OH)2的Ksp
(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______ .
(2)C、H、O三种原子的电负性由大到小的顺序为______ .
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
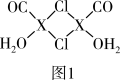
①与CO为互为等电子体的分子是______ .
②该配合物中氯原子的杂化方式为______ .
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______ .
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______ .XCl的化学式__________

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=_____________ (无需化简,列式即可)。
(1)X基态原子的电子排布式为
(2)C、H、O三种原子的电负性由大到小的顺序为
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:

①与CO为互为等电子体的分子是
②该配合物中氯原子的杂化方式为
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】Fe、Co、Ni三种元素性质非常相似,称铁系元素。请回答下列问题。
(1)三种元素位于周期表中____ 区(填分区),基态Ni原子的外围电子排布式为_____ 。
(2)Fe成为阳离子首先失去____ 轨道电子,比较离子半径Fe2+____ Fe3+(填“>”、“<”或“=”)。
(3)FeSO4常作净水剂和补铁剂, 空间构型为
空间构型为__ ,与其互为等电子体的分子有____ (写一个)。
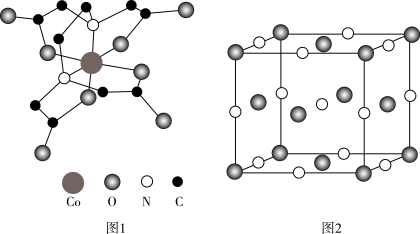
(4)Co3++Y4-=CoY-,CoY-的结构如图1所示(略去H原子)(Y是乙二胺四乙酸,分子式为C10H16N2O8)。该图中四种元素第一电离能由大到小的顺序为____ (写元素符号),其中C原子的杂化类型为____ 。1mol该配合物中配位键有___ mol。
(5)NiO晶体为NaCl型结构(如图2)。其中Ni2+可看成填充在由O2-组成的正___ 面体空隙中,填充率为100%。将NiO在空气中加热,部分Ni2+被氧化为Ni3+,成为NixO(x<1),晶体仍保持电中性,则会出现晶体缺陷,填充率下降。现有NixO晶胞的质量为4.0×10-22g。则分别填充Ni2+、Ni3+和未填充Ni离子的空隙个数之比为_____ 。
(1)三种元素位于周期表中
(2)Fe成为阳离子首先失去
(3)FeSO4常作净水剂和补铁剂,
 空间构型为
空间构型为(4)Co3++Y4-=CoY-,CoY-的结构如图1所示(略去H原子)(Y是乙二胺四乙酸,分子式为C10H16N2O8)。该图中四种元素第一电离能由大到小的顺序为

(5)NiO晶体为NaCl型结构(如图2)。其中Ni2+可看成填充在由O2-组成的正
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED)。目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主。已知砷化镓的晶胞结构如图。试回答:

(1)镓的基态原子的外围电子排布式是_______________ 。
(2)镓与钾、钙元素的第一电离能从大到小依次为_________________________ ,与其在同一周期的砷、硒和溴的电负性从大到小依次为_______________ 。(填元素符号)
(3)此晶胞中所含的砷原子(白色球)个数为_______ ,与同一个镓原子相连的砷原子构成的立体构型为___________ ,镓采取的杂化方式为________________ 。
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为_____________________ ,其结构式为_____________ ,硼酸是_______ 元酸。
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为________ cm,NA表示阿伏伽德罗常数,则该晶体的密度为________ g/cm3。

(1)镓的基态原子的外围电子排布式是
(2)镓与钾、钙元素的第一电离能从大到小依次为
(3)此晶胞中所含的砷原子(白色球)个数为
(4)与镓同主族的元素硼形成的最高价氧化物对应水化物化学式为
(5)若砷和镓两元素的相对原子质量分别为a,b,GaAs晶体结构图中相距最近的两个原子的距离为dnm,晶胞参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________ 。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________ 。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________ N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________ ;写出制备反应的化学方程式:____________ 。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于______________ 晶体(填晶体类型),____________ (填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________ 。
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为____________ g·cm-3(用含a、NA的式子表示)。
(1)硼原子的价电子排布图为
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于
②晶体中P原子的配位数为
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为
您最近一年使用:0次



