常温下,部分酸的电离平衡常数如下:
(1)c(H+)相同的三种酸溶液的浓度从大到小为___ 。
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为__ mol·L-1。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是__ 。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a__ (填“大于”“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1__ n2。
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为__ 。
(5)设计实验证明氢氟酸比HCl的酸性弱__ 。
| 化学式 | HF | HCN | H2CO3 |
| 电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(1)c(H+)相同的三种酸溶液的浓度从大到小为
(2)若HCN溶液的起始浓度为0.01mol·L-1,平衡时c(H+)约为
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a
(4)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为
(5)设计实验证明氢氟酸比HCl的酸性弱
更新时间:2020-06-21 16:39:07
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】NaOH、CH3COOH、 NaHCO3、 HCl溶液是中学化学中常用的四种物质。
(1)物质的量浓度相同的CH3COOH和HCl溶液比较,pH较大的是_______ 。
(2)等体积、等pH的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,产生CO2较多的是_______ 。
(3)常温下,pH均为12的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为_______ 。
(4)在NaHCO3水溶液中,存在电荷守恒等式关系为_______ 。
(1)物质的量浓度相同的CH3COOH和HCl溶液比较,pH较大的是
(2)等体积、等pH的CH3COOH和HCl溶液与足量的NaHCO3固体粉末反应,产生CO2较多的是
(3)常温下,pH均为12的 NaOH和NaHCO3 溶液,由水电离出的c(OH—)之比为
(4)在NaHCO3水溶液中,存在电荷守恒等式关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硼及其化合物在生产中有广泛用途,硼和铝位于同主族,具有相似的化学性质。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有___________ 个电子。
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是: ,在该反应中,氧化剂是
,在该反应中,氧化剂是___________ ,制备 时转移
时转移___________ mol电子。
(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离: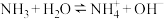 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为___________ 。
(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式___________ 。
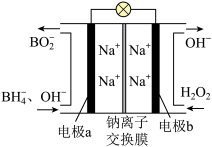
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。
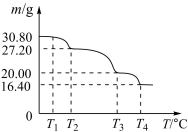
(6)过硼酸钠晶体( )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为___________ 。
(1)硼和氯气反应生成BCl3,在该分子中,硼原子最外层有
(2)NaBH4是有机合成中重要的还原剂。工业上合成方法之一是:
 ,在该反应中,氧化剂是
,在该反应中,氧化剂是 时转移
时转移(3)B(OH)3(硼酸)是一元弱酸,它在水中类似氨的电离:
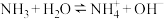 ,硼酸在水中电离的方程式为
,硼酸在水中电离的方程式为(4)过硼酸钠(NaBO3)是一种用途广泛的无机过氧化物,可用作织物的漂白、染色,医药上可作为消毒剂和杀菌剂。过硼酸钠的水溶液不稳定,极易生成偏硼酸钠(NaBO2)并放出氧气,写出该反应的化学方程式
(5)以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是___________。

A.电池放电时 从a极区移向b极区 从a极区移向b极区 |
B.该电池a极的反应为 |
| C.电极b采用Pt/C,该极溶液的pH增大 |
D.电池总反应: |
(6)过硼酸钠晶体(
 )可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
)可用作洗衣业的无氯漂白剂、清洗材料和牙齿增白剂,在70℃以上加热会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T3℃时所得固体的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氨水,碳酸氢钠,醋酸都是重要的化工原料,
(1)氨水中滴入酚酞显红色,其原因是___________ (用离子方程式表示);碳酸氢钠溶液中滴入酚酞也显红色,其原因是___________ (用离子方程式表示)。
(2)现有0.1 mol·L-1醋酸,要证明它是弱电解质最简单的方法是:___________ 。
(3)0.1 mol·L-1氨水分别与等浓度的盐酸、醋酸等体积混合,所得溶液的pH值前者___________ 后者;水的电离程度前者___________ 后者;等浓度的NH4Cl和NaHCO3溶液中,c(NH )
)___________ c(HCO )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)
(4)NaHCO3常用在灭火器中做原料剂,其参与反应的离子方程式为___________ 。
(5)常温下,浓度为a mol·L-1的NH4Cl溶液pH=b, 则NH3·H2O 的电离平衡常数Kb=___________ 。
| CH3COOH | NH3.H2O | H2CO3 | |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Kb=1.75×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)氨水中滴入酚酞显红色,其原因是
(2)现有0.1 mol·L-1醋酸,要证明它是弱电解质最简单的方法是:
(3)0.1 mol·L-1氨水分别与等浓度的盐酸、醋酸等体积混合,所得溶液的pH值前者
 )
) )。(填“>”“<”或“=”)
)。(填“>”“<”或“=”)(4)NaHCO3常用在灭火器中做原料剂,其参与反应的离子方程式为
(5)常温下,浓度为a mol·L-1的NH4Cl溶液pH=b, 则NH3·H2O 的电离平衡常数Kb=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H++HA-、HA-⇌H++A2-,试完成下列问题:
(1)Na2A溶液显________ 填(“酸性”“中性”或“碱性”)。理由是(用离子方程式表示)________ 。
(2)NaHA溶液pH___________ 7(填“大于”“小于”或“等于”),试分析原因是_______
(3)在0.1mol•L-1的Na2A溶液中,下列粒子浓度关系式正确的是___________
(1)Na2A溶液显
(2)NaHA溶液pH
(3)在0.1mol•L-1的Na2A溶液中,下列粒子浓度关系式正确的是___________
| A.c(A2-)+c(HA-)+c(H2A)=0.1mol•L-1 |
| B.c(OH-)=c(H+)+c(HA-) |
| C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) |
| D.c(Na+)=2c(A2-)+2c(HA-) |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】今有① 、②
、② 、③
、③ 三种溶液,根据要求回答下列问题:
三种溶液,根据要求回答下列问题:
(1)当它们的 相同时,其物质的量浓度的关系是
相同时,其物质的量浓度的关系是_______ 。(用序号填空,下同)
(2)当它们的物质的量浓度相同时,加水稀释相同的倍数后其 的关系是
的关系是_______ 。
(3) 相同的三种酸溶液各
相同的三种酸溶液各 ,加水稀释相同倍数后,溶液中水电离出来的
,加水稀释相同倍数后,溶液中水电离出来的 的关系为
的关系为_______ 。
(4)当它们 相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为_______ 。
(5)中和等体积相同浓度的烧碱溶液,需同浓度的三种溶液的体积分别为 、
、 、
、 ,则
,则 、
、 、
、 的关系为
的关系为_______ (用等式表示)。
 、②
、② 、③
、③ 三种溶液,根据要求回答下列问题:
三种溶液,根据要求回答下列问题:(1)当它们的
 相同时,其物质的量浓度的关系是
相同时,其物质的量浓度的关系是(2)当它们的物质的量浓度相同时,加水稀释相同的倍数后其
 的关系是
的关系是(3)
 相同的三种酸溶液各
相同的三种酸溶液各 ,加水稀释相同倍数后,溶液中水电离出来的
,加水稀释相同倍数后,溶液中水电离出来的 的关系为
的关系为(4)当它们
 相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为(5)中和等体积相同浓度的烧碱溶液,需同浓度的三种溶液的体积分别为
 、
、 、
、 ,则
,则 、
、 、
、 的关系为
的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某学习小组设计研究醋酸的性质。
(1)研究稀释过程导电能力变化。
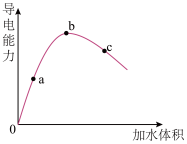
冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是________ (填字母)。用湿润的pH 试纸测定a点pH,结果_______ (填“偏大”、“偏小”或“准确”)。
(2)研究稀释过程pH变化。
25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
根据表中数据,稀释醋酸溶液,电离平衡________ (填“正”或“逆”)向移动;结合表中数据得出判断理由是__________ 。
(3)对比强、弱酸的性质。
构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:
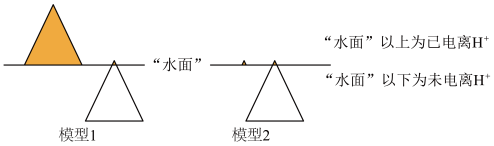
①模型1表示的是____________ (填序号)。
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸_______ 醋酸(填“>”、“<”或“=”)。
③模型2表示的两种溶液中分别加水,醋酸溶液中n(H+)_______ ,c(H+)_______ (填“增大”、“减小”或“不变”)
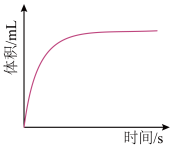
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得镁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像_______ 。
(1)研究稀释过程导电能力变化。

冰醋酸稀释过程,溶液导电能力变化如图所示,则a、b、c三点对应溶液中,醋酸电离程度由大到小的顺序是
(2)研究稀释过程pH变化。
25℃时,用pH计测定不同浓度醋酸溶液的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.01000 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.83 |
(3)对比强、弱酸的性质。
构建模型可帮助理解问题。盐酸和醋酸的“冰山”理解模型如下图,回答问题:

①模型1表示的是
A.等浓度的盐酸和醋酸 B.等pH的盐酸和醋酸溶液
②等体积,pH均为1的盐酸和醋酸溶液,中和NaOH的能力比较:盐酸
③模型2表示的两种溶液中分别加水,醋酸溶液中n(H+)
④过量镁粉分别与2mL 2mol/L盐酸、2mL 2mol/L醋酸溶液反应,测得镁粉与盐酸反应生成气体体积随时间变化如图,在图中画出镁粉与醋酸溶液反应的图像

您最近一年使用:0次
【推荐1】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是____ 。
②将过量H2S通入Na2CO3溶液,反应的离子方程式是_________ 。
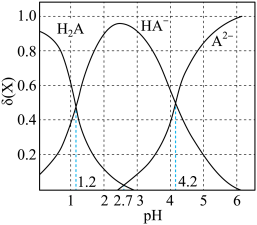
(2)二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数随pH的变化如图所示。则H2A的电离平衡常数K1=_______
(3)室温下,用0.100mol/L 盐酸溶液滴定20.00mL 0.100mol/L的某氨水溶液,滴定曲线如图所示

①b点所示溶液中c(Cl-)_________ c(NH )
)
②pH=10的氨水与pH=4的氯化铵溶液中,由水电离出的c(H+)之比为_______
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH大于____ 。(已知25℃时,Ksp[Zn(OH)2] =1.0×l0-17)
(1)已知部分弱酸的电离常数如下表:
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数K (25℃) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
②将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数随pH的变化如图所示。则H2A的电离平衡常数K1=

(3)室温下,用0.100mol/L 盐酸溶液滴定20.00mL 0.100mol/L的某氨水溶液,滴定曲线如图所示

①b点所示溶液中c(Cl-)
 )
)②pH=10的氨水与pH=4的氯化铵溶液中,由水电离出的c(H+)之比为
(4)常温下,要将ZnSO4溶液中的Zn2+沉淀完全(Zn2+的浓度小于10-5 mol·L-1),应控制溶液的pH大于
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

根据图像回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____ (填“A”或“B”)。
(2)NH3·H2O的电离常数为_____ 。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。

根据图像回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是
(2)NH3·H2O的电离常数为
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)t℃时,水的Kw=1×10-12,则该温度____ (填“>”“<”或“=”)25℃,其理由是____ 。
(2)在(1)中所述温度下,c(H+)=1×10-7mol•L-1的溶液呈____ (填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由水电离出的c(OH-)=____ mol•L-1。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____ (填“向左”“向右”或“不”,下同)移动。在新制氯水中加入少量NaCl固体,水的电离平衡____ 移动。
(4)25℃时,pH=4的盐酸中水的电离程度____ (填“大于”“小于”或“等于”)pH=10的Ba(OH)2溶液中水的电离程度。
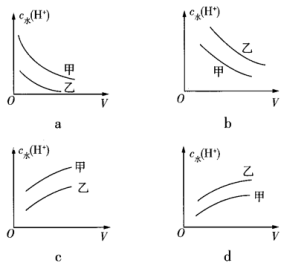
(5)0.1mol•L-1乙酸(甲,Ka=1.75×10-5)和0.1mol•L-1氯乙酸(乙,Ka=1.4×10-3)的水溶液,下列可以表示两溶液中由水电离出的c水(H+)与加入水的体积V之间关系的是____ (填序号)。
(6)下列操作合理的是____ (填字母)。
(7)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是____ (填字母)。
(1)t℃时,水的Kw=1×10-12,则该温度
(2)在(1)中所述温度下,c(H+)=1×10-7mol•L-1的溶液呈
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡
(4)25℃时,pH=4的盐酸中水的电离程度
(5)0.1mol•L-1乙酸(甲,Ka=1.75×10-5)和0.1mol•L-1氯乙酸(乙,Ka=1.4×10-3)的水溶液,下列可以表示两溶液中由水电离出的c水(H+)与加入水的体积V之间关系的是

(6)下列操作合理的是
| A.用25mL碱式滴定管量取20.00mLNaHCO3溶液 |
| B.用托盘天平准确称量10.20g碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1mol•L-1的氢氧化钠溶液495.5mL用500mL容量瓶 |
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1) 时,向水的电离平衡体系中加入少量醋酸钠固体,得到
时,向水的电离平衡体系中加入少量醋酸钠固体,得到 为
为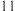 的溶液,其水解反应离子方程式为
的溶液,其水解反应离子方程式为 ___________ ,由水电离出的 =
=_____ 
(2) 时,已知
时,已知 ,在
,在 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中 =
=_____  (填精确值),
(填精确值), =
= __________ 。
(3)向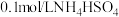 溶液中滴加
溶液中滴加 溶液至中性后,各离子浓度由大到小的顺序为
溶液至中性后,各离子浓度由大到小的顺序为___________ 。
(4)某温度时水的离子积常数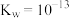 ,若将此温度下
,若将此温度下 的
的 溶液
溶液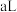 与
与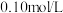 的稀硫酸
的稀硫酸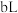 混合,所得混合液
混合,所得混合液 ,则
,则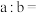
___________ 。
(5) 时,向
时,向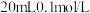 的NH3·H2O溶液滴加amL0.1
的NH3·H2O溶液滴加amL0.1 的
的 溶液时,混合溶液的
溶液时,混合溶液的 恰好为7。则NH3·H2O的电离平衡常数
恰好为7。则NH3·H2O的电离平衡常数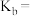
_____ (用含有 的式子表示)。
的式子表示)。
(1)
 时,向水的电离平衡体系中加入少量醋酸钠固体,得到
时,向水的电离平衡体系中加入少量醋酸钠固体,得到 为
为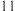 的溶液,其水解反应离子方程式为
的溶液,其水解反应离子方程式为  =
=
(2)
 时,已知
时,已知 ,在
,在 与
与 的混合溶液中,若测得
的混合溶液中,若测得 ,则溶液中
,则溶液中 =
= (填精确值),
(填精确值), =
= (3)向
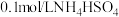 溶液中滴加
溶液中滴加 溶液至中性后,各离子浓度由大到小的顺序为
溶液至中性后,各离子浓度由大到小的顺序为(4)某温度时水的离子积常数
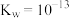 ,若将此温度下
,若将此温度下 的
的 溶液
溶液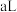 与
与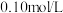 的稀硫酸
的稀硫酸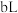 混合,所得混合液
混合,所得混合液 ,则
,则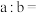
(5)
 时,向
时,向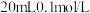 的NH3·H2O溶液滴加amL0.1
的NH3·H2O溶液滴加amL0.1 的
的 溶液时,混合溶液的
溶液时,混合溶液的 恰好为7。则NH3·H2O的电离平衡常数
恰好为7。则NH3·H2O的电离平衡常数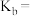
 的式子表示)。
的式子表示)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请根据所学知识回答下列问题:
(1) 的
的 溶液的pH约为4.0,请分析
溶液的pH约为4.0,请分析 溶液显酸性的原因:
溶液显酸性的原因:_______ 。
(2)实验室配制 溶液时,需将
溶液时,需将 溶解在较浓盐酸中,然后加水稀释,这样操作的目的是
溶解在较浓盐酸中,然后加水稀释,这样操作的目的是_______ 。
(3)KCN溶液中存在水解平衡: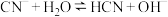 ,25℃时其平衡常数
,25℃时其平衡常数
_______ 。[已知:25℃时,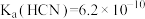 ]
]
(4)已知:25℃时,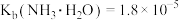 ,
, 的
的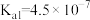 、
、 。则
。则 溶液的pH
溶液的pH_______ (填“>”“<”或“=”)7。
(5)已知:离子的浓度小于 ,可认为该离子不存在;25℃时,
,可认为该离子不存在;25℃时,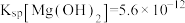 ,
,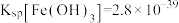 ,某地海水样品经
,某地海水样品经 处理后,所含离子及其浓度如表所示(
处理后,所含离子及其浓度如表所示( 和
和 未列出)。
未列出)。
则a_______ (填“>”“<”或“=”)0.16。
(1)
 的
的 溶液的pH约为4.0,请分析
溶液的pH约为4.0,请分析 溶液显酸性的原因:
溶液显酸性的原因:(2)实验室配制
 溶液时,需将
溶液时,需将 溶解在较浓盐酸中,然后加水稀释,这样操作的目的是
溶解在较浓盐酸中,然后加水稀释,这样操作的目的是(3)KCN溶液中存在水解平衡:
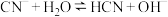 ,25℃时其平衡常数
,25℃时其平衡常数
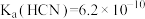 ]
](4)已知:25℃时,
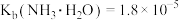 ,
, 的
的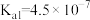 、
、 。则
。则 溶液的pH
溶液的pH(5)已知:离子的浓度小于
 ,可认为该离子不存在;25℃时,
,可认为该离子不存在;25℃时,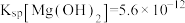 ,
,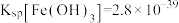 ,某地海水样品经
,某地海水样品经 处理后,所含离子及其浓度如表所示(
处理后,所含离子及其浓度如表所示( 和
和 未列出)。
未列出)。| 离子 |  |  |  |  |  |
浓度/( ) ) | a | 0.05 | 0.10 | 0.50 | 0.58 |
则a
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:_______ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)_______ (填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字) :c(OH-)-c(HA)=_______ mol·L-1
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH_______ 7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液NH 按由大到小的顺序排列是
按由大到小的顺序排列是_______ (填序号)。
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
(1)混合溶液的pH=8的原因:
(2)混合溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字) :c(OH-)-c(HA)=
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
 按由大到小的顺序排列是
按由大到小的顺序排列是A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl
您最近一年使用:0次



