工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ•mol﹣1
N2(g)+2O2(g)═2NO2(g) =+133kJ•mol﹣1
=+133kJ•mol﹣1
H2O(g)═H2O(l) =﹣44kJ•mol﹣1
=﹣44kJ•mol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:_____ .
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是_____ .(填字母)
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  <0中的所有物质都为气态,起始温度、体积相同(T1℃、2L密闭容器),反应过程中部分数据见表:
<0中的所有物质都为气态,起始温度、体积相同(T1℃、2L密闭容器),反应过程中部分数据见表:
对反应Ⅰ,前10min内的平均反应速率 (CH3OH)=
(CH3OH)=_____ .在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1_____ T2(填“>”、“<”或“=”),若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____ 移动(填“正向”“逆向”或“不”).
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ•mol﹣1
N2(g)+2O2(g)═2NO2(g)
 =+133kJ•mol﹣1
=+133kJ•mol﹣1H2O(g)═H2O(l)
 =﹣44kJ•mol﹣1
=﹣44kJ•mol﹣1催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
(2)改变温度,使反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  <0中的所有物质都为气态,起始温度、体积相同(T1℃、2L密闭容器),反应过程中部分数据见表:
<0中的所有物质都为气态,起始温度、体积相同(T1℃、2L密闭容器),反应过程中部分数据见表:| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
对反应Ⅰ,前10min内的平均反应速率
 (CH3OH)=
(CH3OH)=
更新时间:2020-09-14 21:12:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)已知合成氨的热化学方程式为:N2(g)+ 3H2(g) 2NH3(g) △H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g) △H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
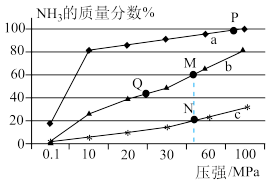
①曲线c对应的温度为___________ ℃。
②下列说法中正确的是___________ 。
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
(2)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_____________________________ 。
(3)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式_______________________________________ ,当有1mol尿素完全反应时,转移电子的数目为___________ 。
(1)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)
 2NH3(g) △H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g) △H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
①曲线c对应的温度为
②下列说法中正确的是
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
(2)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(3)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:___________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=___________ 。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
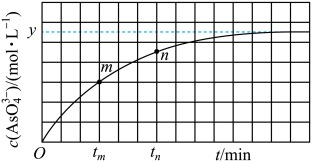
①下列可判断反应达到平衡的是________ (填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.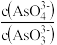 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______ v逆(填“大于”“小于”或“等于”)。
③tm时v逆____ tn时v逆(填“大于”“小于”或“等于”)。
(1)画出砷的原子结构示意图:
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2 2As(s)+
 O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1I2和20 mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.
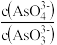 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1②tm时,v正
③tm时v逆
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为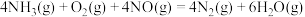

(1)催化剂___________ 改变ΔH(填“能”或“不能”)
(2)催化剂的制备。将预先制备的一定量的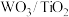 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为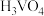 沉淀的离子方程式为
沉淀的离子方程式为___________ ;
(3)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
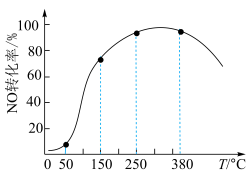
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:___________
(4)废催化剂的回收。回收 催化剂并制备
催化剂并制备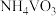 的过程可表示为
的过程可表示为

①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
②向pH=8的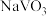 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知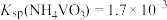 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
(5)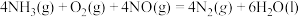 ΔH
ΔH___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为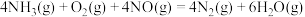

(1)催化剂
(2)催化剂的制备。将预先制备的一定量的
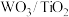 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为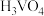 沉淀的离子方程式为
沉淀的离子方程式为(3)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:
(4)废催化剂的回收。回收
 催化剂并制备
催化剂并制备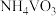 的过程可表示为
的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
②向pH=8的
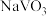 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知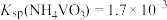 ,加过量
,加过量 溶液的目的是
溶液的目的是(5)
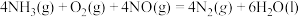 ΔH
ΔH (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
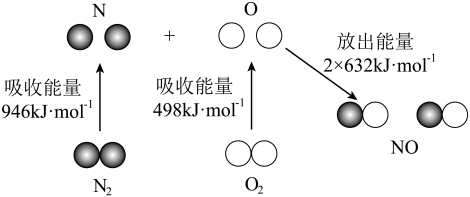
【推荐1】回答下列问题:
(1)根据如图所示的 和
和 反应生成
反应生成 过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中_______ (填“吸收”或“放出”)的能量为_______ kJ。
(2)在5L密闭容器内,800℃时发生反应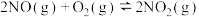 ,
, 随时间变化如下表:
随时间变化如下表:
①0~2s内,用 表示该反应的反应速率为
表示该反应的反应速率为_______  。
。
②下列措施能够使该反应的反应速率加快的是_______ (填字母)。
a.降低温度 b.使用合适的催化剂 c.减小压强(扩大容器容积)
(3) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的 。
。
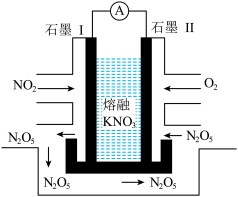
①放电时,该电池的负极是_______ (填“石墨Ⅰ”或“石墨Ⅱ”)。
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的
_______ L。
(1)根据如图所示的
 和
和 反应生成
反应生成 过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
过程中能量变化情况,计算在一定条件下,氮气与氧气反应生成1mol一氧化氮气体的过程中
(2)在5L密闭容器内,800℃时发生反应
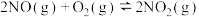 ,
, 随时间变化如下表:
随时间变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
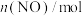 | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
①0~2s内,用
 表示该反应的反应速率为
表示该反应的反应速率为 。
。②下列措施能够使该反应的反应速率加快的是
a.降低温度 b.使用合适的催化剂 c.减小压强(扩大容器容积)
(3)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成可循环使用的 。
。
①放电时,该电池的负极是
②若电路中有2mol电子转移,则理论上石墨Ⅱ处需消耗标准状况下的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________ 。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)⇌2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
①在T℃下,0~2s时,该反应的平均反应速率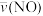 =
=________ ;
②该温度下反应的平衡常数K=________ ,在T℃下,能提高NO的平衡转化率的措施有_______ 、________ 。
(3)已知NO和O2反应的历程如图,回答下列问题:

①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________ 。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____ (选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________ 。
(1)自然界在闪电时,生成NO的反应方程式为
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)⇌2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
| n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
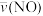 =
=②该温度下反应的平衡常数K=
(3)已知NO和O2反应的历程如图,回答下列问题:

①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):
②试分析上述基元反应中,反应①和反应②的速率较小的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CH4、CO等都是重要的能源,也是重要的化工原料。
(1)一定条件下,甲烷与水蒸气发生反应: ,工业上可利用此反应生产合成氨原料气H2。
,工业上可利用此反应生产合成氨原料气H2。
①一定温度下,向2L恒容密闭容器中充入1.6mol CH4和2.4molH2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图甲所示。

 内的平均反应速率
内的平均反应速率
_______ 。平衡时CH4的转化率为_______ 。
②下列措施能加快反应速率的是_______ (填字母)。
A.恒压时充入He B.升高温度 C.恒容时充入 D.及时分离出CO
D.及时分离出CO
③第1分钟时v正(CO)_______ 第2分钟时v逆(CO) (填“ ”“
”“ ”“
”“ ”或“无法比较”)
”或“无法比较”)
④下列能说明上述反应达到平衡状态的是_______ (填字母)。
a.
b.恒温恒容时,容器内混合气体的密度保持不变
c. 、
、 浓度保持不变
浓度保持不变
d. 、
、 、CO(g)、
、CO(g)、 的物质的量之比为
的物质的量之比为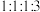
e.断开3mol H−H键的同时断开2molO−H键
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。

⑤输入氢气的一极为_______ 极。
⑥写出正极反应式:_______ 。
(1)一定条件下,甲烷与水蒸气发生反应:
 ,工业上可利用此反应生产合成氨原料气H2。
,工业上可利用此反应生产合成氨原料气H2。①一定温度下,向2L恒容密闭容器中充入1.6mol CH4和2.4molH2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图甲所示。

 内的平均反应速率
内的平均反应速率
②下列措施能加快反应速率的是
A.恒压时充入He B.升高温度 C.恒容时充入
 D.及时分离出CO
D.及时分离出CO③第1分钟时v正(CO)
 ”“
”“ ”“
”“ ”或“无法比较”)
”或“无法比较”)④下列能说明上述反应达到平衡状态的是
a.

b.恒温恒容时,容器内混合气体的密度保持不变
c.
 、
、 浓度保持不变
浓度保持不变d.
 、
、 、CO(g)、
、CO(g)、 的物质的量之比为
的物质的量之比为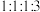
e.断开3mol H−H键的同时断开2molO−H键
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒。

⑤输入氢气的一极为
⑥写出正极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在密闭容器中进行反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH1=akJ·mol-
FeO(s)+CO(g) ΔH1=akJ·mol-
反应②2CO(g)+O2(g) 2CO2(g) △H2=b kJ·mol-
2CO2(g) △H2=b kJ·mol-
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________ (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________ ,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________ 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a___________ 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________ (填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
 FeO(s)+CO(g) ΔH1=akJ·mol-
FeO(s)+CO(g) ΔH1=akJ·mol-反应②2CO(g)+O2(g)
 2CO2(g) △H2=b kJ·mol-
2CO2(g) △H2=b kJ·mol-反应③2Fe(s)+O2(g)
 2FeO(s) △H3
2FeO(s) △H3(1) △H3=
(2)反应①的化学平衡常数表达式K=
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某可逆反应:2A(g)⇌B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
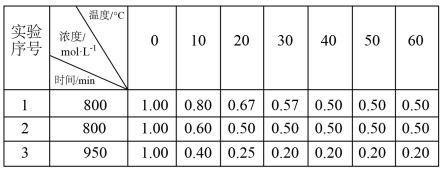
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为___ mol·L-1·min-l,50min时,v正___ v逆(填“<”“>”或“=”)。
(2)0~20min内,实验2比实验1的反应速率___ (填“快”或“慢”),其原因可能是___ 。
(3)实验3比实验1的反应速率__ (填“快”或“慢”),其原因是__ 。

(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为
(2)0~20min内,实验2比实验1的反应速率
(3)实验3比实验1的反应速率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】ⅰ 在一定体积的密闭容器中,进行化学反应: ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
请回答下列问题:
(1)该反应的正反应为______ (填“吸热”或“放热”)反应。
(2)某温度下,在2 L的密闭容器中,加入1 mol 和1 mol
和1 mol  ,充分反应达平衡时,CO的平衡浓度为
,充分反应达平衡时,CO的平衡浓度为 ,试判断此时的反应温度为
,试判断此时的反应温度为______ ℃。
(3)若在(2)所处的温度下,在1 L的密闭容器中,加入2 mol 和3 mol
和3 mol  ,则充分反应达平衡时,
,则充分反应达平衡时, 的物质的量______(填字母)。
的物质的量______(填字母)。
(4)能说明该反应达到化学平衡状态的是______(填字母)。
ⅱ 高炉炼铁中发生的基本反应之一如下:


(5)已知1100℃时 。温度升高,化学平衡移动后达到新的平衡,高炉内
。温度升高,化学平衡移动后达到新的平衡,高炉内 和CO的体积比值
和CO的体积比值______ (填“增大”“减小”或“不变”)。
(6)1100℃时测得高炉中 ,
, ,在这种情况下,该反应是否处于平衡状态
,在这种情况下,该反应是否处于平衡状态______ (选填“是”或“否”),此时化学反应速率
______  (选填“>”“<”或“=”)。
(选填“>”“<”或“=”)。
ⅲ 在其他条件不变时,改变某一条件对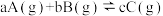 化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:

(7)在反应Ⅲ中,
______ c(填“大于”“小于”“等于”);若 ,试分析该反应能否自发进行?
,试分析该反应能否自发进行?______________ 。
 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的正反应为
(2)某温度下,在2 L的密闭容器中,加入1 mol
 和1 mol
和1 mol  ,充分反应达平衡时,CO的平衡浓度为
,充分反应达平衡时,CO的平衡浓度为 ,试判断此时的反应温度为
,试判断此时的反应温度为(3)若在(2)所处的温度下,在1 L的密闭容器中,加入2 mol
 和3 mol
和3 mol  ,则充分反应达平衡时,
,则充分反应达平衡时, 的物质的量______(填字母)。
的物质的量______(填字母)。| A.等于1.0 mol | B.大于1.0 mol |
| C.大于0.5 mol,小于1.0 mol | D.无法确定 |
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
C.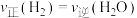 | D. |
ⅱ 高炉炼铁中发生的基本反应之一如下:


(5)已知1100℃时
 。温度升高,化学平衡移动后达到新的平衡,高炉内
。温度升高,化学平衡移动后达到新的平衡,高炉内 和CO的体积比值
和CO的体积比值(6)1100℃时测得高炉中
 ,
, ,在这种情况下,该反应是否处于平衡状态
,在这种情况下,该反应是否处于平衡状态
 (选填“>”“<”或“=”)。
(选填“>”“<”或“=”)。ⅲ 在其他条件不变时,改变某一条件对
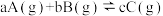 化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
(7)在反应Ⅲ中,

 ,试分析该反应能否自发进行?
,试分析该反应能否自发进行?
您最近一年使用:0次
【推荐1】反应 在工业上有重要应用。
在工业上有重要应用。
(1)已知 和
和 的燃烧热分别为
的燃烧热分别为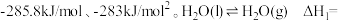
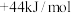 ,则
,则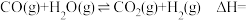
_______ 。
(2)在恒温恒容的密闭容器中发生反应: ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。
(3)该反应常在 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是_______ 。
②某温度下, 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: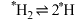 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是_______ (填字母)。
A.Pd膜对气体分子的透过具有选择性
B.过程2的
C.加快 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离
D. 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应
③同温同压下,已知等物质的量的 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了_______  。
。
(4) 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。_______ (填“正极”或“负极”),该电极上的反应为_______ 。
 在工业上有重要应用。
在工业上有重要应用。(1)已知
 和
和 的燃烧热分别为
的燃烧热分别为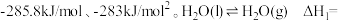
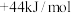 ,则
,则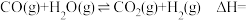
(2)在恒温恒容的密闭容器中发生反应:
 ,下列能说明该反应达平衡状态的是_______(填字母)。
,下列能说明该反应达平衡状态的是_______(填字母)。| A.容器中混合气体的平均摩尔质量不变 | B. 的体积分数保持不变 的体积分数保持不变 |
| C.体系中压强不变 | D.容器中混合气体的密度不变 |
(3)该反应常在
 膜反应器中进行,其工作原理如图1所示。
膜反应器中进行,其工作原理如图1所示。
 膜时具有更高转化率的原因是
膜时具有更高转化率的原因是②某温度下,
 在
在 膜表面上的解离过程存在如下平衡:
膜表面上的解离过程存在如下平衡: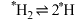 (*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是
(*表示吸附在催化剂表面),其正反应的活化能远小于逆反应的活化能。下列说法错误的是A.Pd膜对气体分子的透过具有选择性
B.过程2的

C.加快
 膜内
膜内 原子迁移有利于
原子迁移有利于 的解离
的解离D.
 原子在
原子在 膜表面上结合为
膜表面上结合为 的过程为放热反应
的过程为放热反应③同温同压下,已知等物质的量的
 和
和 通入无
通入无 膜反应器和
膜反应器和 膜反应器发生反应
膜反应器发生反应 ,无
,无 膜反应器中
膜反应器中 的平衡转化率为
的平衡转化率为 ,相同时间内
,相同时间内 膜反应器出口
膜反应器出口 和出口
和出口 中
中 的物质的量之比为1:8,则使用
的物质的量之比为1:8,则使用 膜反应器
膜反应器 的平衡转化率提高了
的平衡转化率提高了 。
。(4)
 也可采用电化学方法实现,反应装置如图2所示。
也可采用电化学方法实现,反应装置如图2所示。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g) 2NH3(g)的平衡常数K=
2NH3(g)的平衡常数K=_____ (精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______ (填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
(1)此合成反应的a_____ 0;ΔS______ 0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g) 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______ (用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______ 。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)
 2NH3(g)的平衡常数K=
2NH3(g)的平衡常数K=A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)
 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:| T/K | 303 | 313 | 323 |
| NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a
(2)已知(K为平衡常数):N2(g)+3H2(g)
 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.某课外活动小组利用如图1装置探究Zn与酸反应速率的影响因素。记录生成氢气的体积及时间。
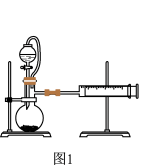
(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:
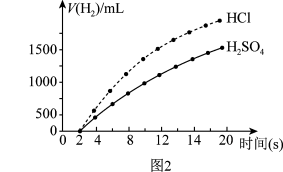
①实验中所用硫酸的浓度为______ 。
②反应开始的0~2s内,未产生氢气,可能的原因是______ 。
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率_____ (填“大于”或“小于”)锌与500mLamol•L-1硫酸反应速率。
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=______ (忽略溶液体积变化)。
②根据表中数据可知,温度越高,化学反应速率越______ (填“快”或“慢”)。
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。
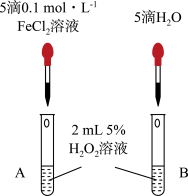
产生气泡更快的是______ (填“A”或“B”)。
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I- 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是______ 。

(1)阴离子对反应速率的影响
实验药品:500mL0.4mol•L-1盐酸、500mLamol•L-1硫酸,等质量、等大小的过量Zn片。记录数据绘制成图2。回答下列问题:

①实验中所用硫酸的浓度为
②反应开始的0~2s内,未产生氢气,可能的原因是
③根据实验数据绘制的图像可知,在相同时间段内,锌与500mL0.4mol•L-1盐酸反应速率
(2)温度对反应速率的影响
取2L1mol/LHCl溶液于图一装置中,分别加入同等大小的锌粒,在不同温度下反应,记录相同时间内产生的H2的体积,实验数据记录如表(换算成标况):
| 实验① | 298K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 14.5 | 36.6 | 61.6 | 141.6 | 224 | 389 | 450 | 496 | 517.6 | 534 | ||
| 实验② | 308K | 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算308K时在0s~40s时间内氯化氢的平均反应速率v(HCl)=
②根据表中数据可知,温度越高,化学反应速率越
(3)催化剂对反应速率的影响
该研究小组的同学为研究Fe3+对H2O2分解的催化效果,设计了如图所示的实验。

产生气泡更快的是
Ⅱ.回答下列问题:
(4)某实验小组在温度为T时,向烧杯中加入10mL0.1mol/LFeCl3溶液和20mL0.1mol/LKI溶液,发生反应2Fe3++2I-
 2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是
2Fe2++I2一段时间后达到平衡。下列不能判断反应达到平衡状态的是| A.溶液颜色不再发生变化 | B.v(Fe3+)=2v(I2) |
| C.Fe2+浓度不再发生变化 | D.消耗1molFe3+的同时生成1molI- |
您最近一年使用:0次



