N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
(1)按电子排布N元素在周期表分区中属于_____ 区元素,基态N原子的未成对电子数目为____ 个。
(2)Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是____ ,第一电离能由大到小的顺序是_____ 。
(3)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2)反应生成有机化合物B,B具有优异的催化性能。
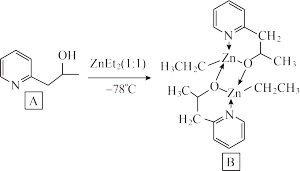
吡啶类化合物A中N原子的杂化类型是___ ,化合物A易溶于水,主要原因是_____ 。含Zn有机物B的分子结构中含_______ (填字母代号)。
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AlN的晶体结构如图1所示,某种氮化铁的结构如图2所示。
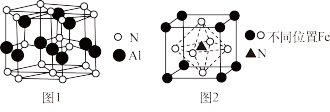
①AlN晶体结构单元中,含有的Al、N原子个数均是_______ ;
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁的晶体密度可表示为_______ g·cm−3。
(1)按电子排布N元素在周期表分区中属于
(2)Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
(3)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与Zn(CH3CH2)2(即ZnEt2)反应生成有机化合物B,B具有优异的催化性能。

吡啶类化合物A中N原子的杂化类型是
A.离子键 B.配位键 C.π键 D.σ键 E.氢键
(4)N与金属可形成氮化物,如AlN的晶体结构如图1所示,某种氮化铁的结构如图2所示。

①AlN晶体结构单元中,含有的Al、N原子个数均是
②若该氮化铁的晶胞边长为apm,阿伏加德罗常数的值为NA,则该氮化铁的晶体密度可表示为
更新时间:2020-11-18 17:13:04
|
相似题推荐
【推荐1】元素周期表前3周期的元素a、b、c,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍。回答下列问题:
(1)a的基态原子核外电子运动的轨道呈____ 形。
(2)b的基态原子的核外电子占据____ 个原子轨道。
(3)c的外围电子轨道表示式为____ 。
(4)b与c的第一电离能相比,较大的是____ (填元素符号),理由是____ 。
(1)a的基态原子核外电子运动的轨道呈
(2)b的基态原子的核外电子占据
(3)c的外围电子轨道表示式为
(4)b与c的第一电离能相比,较大的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Z在元素周期表中的位置 _______________________ ,Z的氢化物空间构型是________
(2)在H—Y、H—Z两种共价键中,键的极性较强的是____________ (用相应的元素符号表示该共价键)。
(3)XZ2分子中X以________ 方式杂化。
(4)写出W元素的原子核外电子排布式___________________________________ 。
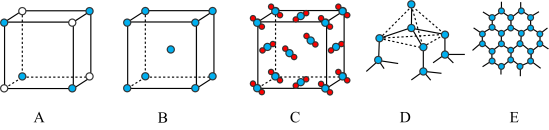
(5)Y元素和Na形成晶体的部分结构可用下图中的_________ 来表示(填序号)。
| 元素 | 相关信息 |
| X | X的价电子排布式为nsnnpn |
| Y | Y的负一价离子的电子层结构都与氩相同 |
| Z | 常温常压下,Z单质是淡黄色固体,常在火山口附近沉积 |
| W | W原子共有6个价电子,其中五个价电子位于第三能层d轨道 |
(2)在H—Y、H—Z两种共价键中,键的极性较强的是
(3)XZ2分子中X以
(4)写出W元素的原子核外电子排布式
(5)Y元素和Na形成晶体的部分结构可用下图中的

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题。
(1)写出F元素的电子排布式:________ 。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为________ 。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________ 。
(4)B、C、D、E的第一电离能由大到小的顺序是________ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________ (写化学式)。
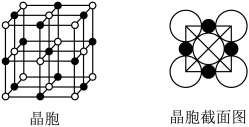
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:晶胞中距离一个B+最近的B+有________ 个;B+的配位数是________ 。
(1)写出F元素的电子排布式:
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是
(4)B、C、D、E的第一电离能由大到小的顺序是
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:晶胞中距离一个B+最近的B+有

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】现有6种短周期元素X、Y、Z、W、M、Q,其原子序数依次增大,部分信息如下表:
请用相应的化学用语回答下列问题:
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是________ 。
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是________ ,其电子云轮廓图为________ 形。
(3)Z的电负性________ W的电负性(填“>”或“<”,下同),Z的第一电离能________ W的第一电离能,Z、W、M的简单离子半径由大到小的顺序是________ (用离子符号回答)。
(4)QW 的VSEPR模型是
的VSEPR模型是________ ,QW3分子中的键角是________ 。
(5)ZX 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是________ 。
| X | 阴离子电子层结构与氦原子相同 |
| Y | 最高价氧化物在空气中增多会造成温室效应 |
| Z | 双原子单质分子中键与键的数目之比为1:2 |
| W | 基态原子的价电子排布式为nsnnpn+2 |
| M | 短周期元素中原子半径最大 |
| Q | 元素最高化合价与最低化合价的代数和等于4 |
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是
(3)Z的电负性
(4)QW
 的VSEPR模型是
的VSEPR模型是(5)ZX
 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
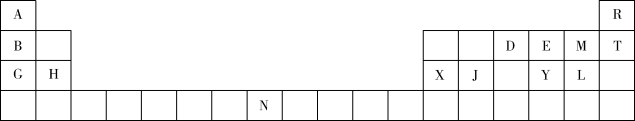
回答下列问题:
(1)D的简单气态氢化物的VSEPR模型为_______ 。
(2)第一电离能H_______ X(填“>”“<”或“=”),其原因是_______ 。
(3)电负性E_______ M(填“>”“<”或“=”)。
(4)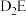 的沸点比
的沸点比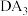 的沸点低,其原因是
的沸点低,其原因是_______ 。
(5)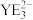 的键角比
的键角比 的键角小的原因是
的键角小的原因是_______ 。

回答下列问题:
(1)D的简单气态氢化物的VSEPR模型为
(2)第一电离能H
(3)电负性E
(4)
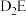 的沸点比
的沸点比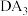 的沸点低,其原因是
的沸点低,其原因是(5)
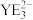 的键角比
的键角比 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
【推荐3】C、N、O、Al、Si、Cu是常见的六种元素。
①Si位于元素周期表第________ 周期第________ 族。
②N的基态原子核外电子排布式为________ ;Cu的基态原子最外层有________ 个电子。
③用“>”或“<”填空:
(2)O、Na、P、Cl四种元素中电负性最大的是________ (填元素符号),其中P原子的核外电子排布式为___________________ 。
(3)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是_________ (填元素符号),e的价层电子轨道示意图为____________ 。
(4)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是________ (填写元素符号)。
②基态锗(Ge)原子的电子排布式是______ 。Ge的最高价氯化物的分子式是________ 。
③Ge元素可能的性质或应用有______ 。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
①Si位于元素周期表第
②N的基态原子核外电子排布式为
③用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al | N | 金刚石 | CH4 |
(2)O、Na、P、Cl四种元素中电负性最大的是
(3)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是
(4)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/(kJ·mol-1) | 578 | 1 817 | 2 745 | 11 578 | …… |
则该元素是
②基态锗(Ge)原子的电子排布式是
③Ge元素可能的性质或应用有
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_______ 。
(2)单个AlCl3气态分子的空间构型为_______ ,AlCl3可与Cl-形成AlCl ,与AlCl
,与AlCl 互为等电子体的分子为
互为等电子体的分子为_______ 。
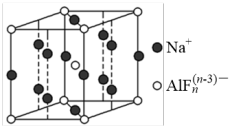
(3)某遮光剂的晶胞如图所示,则n=_______ 。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为
(2)单个AlCl3气态分子的空间构型为
 ,与AlCl
,与AlCl 互为等电子体的分子为
互为等电子体的分子为(3)某遮光剂的晶胞如图所示,则n=

您最近一年使用:0次
【推荐2】A、B、C、D、E五种元素原子序数依次增大,A元素原子的价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2。C、D的电离能数据如下(kJ·mol-1):
(1)化合价是元素的一种性质。由C、D的电离能数据判断,C通常显___________ 价,D显___________ 价。
(2)某气态单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个___________ 键,2个___________ 键。
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是___________ 。
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
(2)某气态单质甲与化合物AB分子中电子总数相等,则甲分子中包含1个
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应。根据下表数据,说明AB比甲活泼的原因是
| 单键 | 双键 | 叁键 | |
| AB键能/(kJ·mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲键能/(kJ·mol-1) | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】氮及其化合物,在工农业生产中作用巨大。
(1)下列有关氮的化合物的说法,正确的是___________。
(2)氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如下图所示。它的化学式为___________ ,它的硬度超过金刚石的主要原因是___________ 。
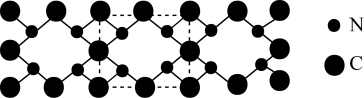
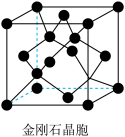
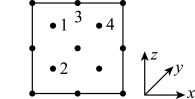
(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图)内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为 (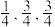 ),则原子2和4的原子分数坐标为
),则原子2和4的原子分数坐标为___________ 、___________ 。
(4)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
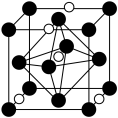
氮化钼的化学式为___________ ,氮化钼晶胞边长为a pm,晶体的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)下列有关氮的化合物的说法,正确的是___________。
| A.肼(N2H4)的沸点低于乙烷(C2H6) |
| B.NH3极易溶于水,原因之一是NH3能够与水分子形成分子间氢键 |
| C.NF3和NH3空间构型均为三角锥形,分子中键角:NH3>NF3 |
D.尿素(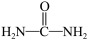 )中σ键与π键的比例为7:1 )中σ键与π键的比例为7:1 |

(3)氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞(如图)内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。下图为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为 (
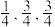 ),则原子2和4的原子分数坐标为
),则原子2和4的原子分数坐标为

(4)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】我国科学家率先合成了新拓扑结构的储氢材料,镁、钛、钒、铁等一些金属形成的化合物及合金有异乎寻常的储氢能力。回答下列问题:
(1)基态铁原子失电子成为Fe3+,Fe3+的价电子排布图是___________ 。
(2)V2+与N2H4、H2O2、乙二胺(H2NCH2CH2NH2)等能形成配离子,在N2H4和H2O2中的非金属元素第一电离能由大到小的顺序是___________ ,N2H4中氮原子的杂化方式为___________ ,乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)莫氏硬度是衡量矿物硬度的一种标准,其值越大则硬度越大。已知NaF和MgF2的莫氏硬度值分别为3.2和6.0,引起这种差异的主要原因是___________ 。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。 的空间构型为
的空间构型为___________ ,再写出与其互为等电子体的分子和离子___________ 、___________ 。
(5)配合物[Cu(CH3C≡N)4]BF4中铜的配位数为___________ ,配位体中σ键与π键个数之比为___________ 。
(6)某种铁镁合金储氢效率很高,其晶胞如图所示,
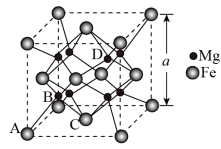
已知铁镁合金的晶胞参数为a pm,则铁镁之间的最短距离为___________ pm,该合金的密度为___________ g∙cm−3(只列出计算式即可)。
(1)基态铁原子失电子成为Fe3+,Fe3+的价电子排布图是
(2)V2+与N2H4、H2O2、乙二胺(H2NCH2CH2NH2)等能形成配离子,在N2H4和H2O2中的非金属元素第一电离能由大到小的顺序是
(3)莫氏硬度是衡量矿物硬度的一种标准,其值越大则硬度越大。已知NaF和MgF2的莫氏硬度值分别为3.2和6.0,引起这种差异的主要原因是
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。
 的空间构型为
的空间构型为(5)配合物[Cu(CH3C≡N)4]BF4中铜的配位数为
(6)某种铁镁合金储氢效率很高,其晶胞如图所示,

已知铁镁合金的晶胞参数为a pm,则铁镁之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】锂—磷酸氧铜电池正极的活性物质是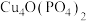 ,可通过下列反应制备:
,可通过下列反应制备: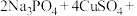
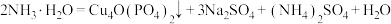 。
。
(1)写出基态 的电子排布式:
的电子排布式:_______________ 。
(2)P、S元素第一电离能大小关系为_______________ ,原因是_______________ 。
(3)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为_______________ ,基态碳原子核外电子有_______________ 种运动状态。
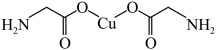
(4)在硫酸铜溶液中加入过量 ,生成配合物
,生成配合物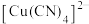 ,则
,则 该配合物含有
该配合物含有 键的数目为
键的数目为_______________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
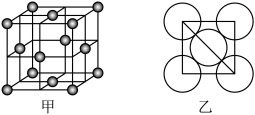
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为_______________ ,铜的原子半径为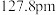 ,
, 表示阿伏加德罗常数的值,晶体铜的密度为
表示阿伏加德罗常数的值,晶体铜的密度为_______________  (列出计算式即可)。
(列出计算式即可)。
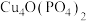 ,可通过下列反应制备:
,可通过下列反应制备: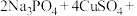
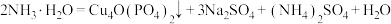 。
。(1)写出基态
 的电子排布式:
的电子排布式:(2)P、S元素第一电离能大小关系为
(3)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为

(4)在硫酸铜溶液中加入过量
 ,生成配合物
,生成配合物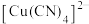 ,则
,则 该配合物含有
该配合物含有 键的数目为
键的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为
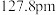 ,
, 表示阿伏加德罗常数的值,晶体铜的密度为
表示阿伏加德罗常数的值,晶体铜的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】锂离子电池常用的电极材料是LiCoO2和石墨。
(1)画出基态Co2+离子的价电子排布图________ 。
(2)Co2+与CN-结合形成配合物[Co(CN)6]4-,其中与Co2+结合的C原子的杂化方式是_____ 。
(3)NH3分子与Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH__ (填“较大”,“较小”或“相同”),解释原因______ 。
(4)Li2O的熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是__ 。
(5)石墨的晶胞为六方晶胞,部分晶胞参数如下图所示。若石墨的密度为d g·cm-3,以NA代表阿伏加 德罗常数的数值,则石墨中的C-C键长为____ pm。
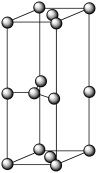
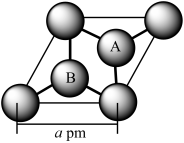
侧视图 俯视图
(1)画出基态Co2+离子的价电子排布图
(2)Co2+与CN-结合形成配合物[Co(CN)6]4-,其中与Co2+结合的C原子的杂化方式是
(3)NH3分子与Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH
(4)Li2O的熔点为1570℃,CoO的熔点为1935℃,解释后者熔点更高的主要原因是
(5)石墨的晶胞为六方晶胞,部分晶胞参数如下图所示。若石墨的密度为d g·cm-3,以NA代表阿伏加 德罗常数的数值,则石墨中的C-C键长为


侧视图 俯视图
您最近一年使用:0次



