某化学反应2A(g) B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L﹣1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L﹣1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min内,以A的速率表示的平均反应速率为___________ mol•L﹣1•min﹣1
(2)实验2中,A的初始浓度c2=___________ mol•L﹣1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3___________ v1(填“>”“=”或“<”),且c3___________ 1.0 mol•L﹣1(填“>”“=”或“<”)。
(4)比较实验4和实验1,可推测该反应的正反应是___________ 反应(填“吸热”或“放热”),理由是___________ 。
 B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L﹣1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol•L﹣1)随反应时间(min)的变化情况如下表:| 时间 实验序号 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以A的速率表示的平均反应速率为
(2)实验2中,A的初始浓度c2=
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应的正反应是
16-17高二上·山西朔州·阶段练习 查看更多[4]
湖北省武汉西藏中学2022-2023学年高一下学期6月期末考试化学试题(已下线)第6章 化学反应速率和化学平衡复习-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)江西省宜春市第九中学2020-2021学年高二上学期期中考试化学试题2016-2017学年山西省怀仁一中高二上第一次月考化学试卷
更新时间:2021-01-06 13:28:42
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】试分析有关化学反应速率问题。
(1)某反应在体积为 的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知
的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知 均为气体)。
均为气体)。___________ 。
②反应开始至 时,B的平均反应速率为
时,B的平均反应速率为___________ 。
③平衡时A的转化率为___________ 。
(2)下表是某学习兴趣小组,一定条件下测定 在水溶液中分解浓度减少一半所需时间。已知:
在水溶液中分解浓度减少一半所需时间。已知: 的起始浓度为
的起始浓度为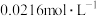 。
。
①在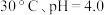 条件下,
条件下, 的分解速率为
的分解速率为___________ 。
② 增大能加速
增大能加速 分解,表明对
分解,表明对 分解起催化作用的是
分解起催化作用的是___________ 。
③根据表中数据,推测 在下列条件下分解速率依次增大的顺序为
在下列条件下分解速率依次增大的顺序为___________ (填序号)。
a.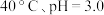 b.
b.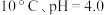 c.
c.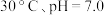
(1)某反应在体积为
 的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知
的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知 均为气体)。
均为气体)。
②反应开始至
 时,B的平均反应速率为
时,B的平均反应速率为③平衡时A的转化率为
(2)下表是某学习兴趣小组,一定条件下测定
 在水溶液中分解浓度减少一半所需时间。已知:
在水溶液中分解浓度减少一半所需时间。已知: 的起始浓度为
的起始浓度为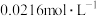 。
。
| 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
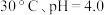 条件下,
条件下, 的分解速率为
的分解速率为②
 增大能加速
增大能加速 分解,表明对
分解,表明对 分解起催化作用的是
分解起催化作用的是③根据表中数据,推测
 在下列条件下分解速率依次增大的顺序为
在下列条件下分解速率依次增大的顺序为a.
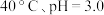 b.
b.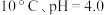 c.
c.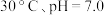
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
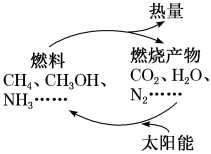
(1)在如图构想的物质和能量循环中,太阳能最终转化为___________ 能。
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为甲醇(CH3OH),该反应的化学方程式为2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
用O2表示0~3 min内该反应的平均反应速率为___________ mol/(L·min)。
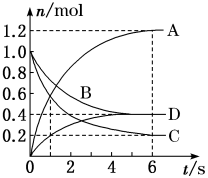
(3)一定温度下,向容积为2 L的密闭容器中通入两种气体并发生反应,反应中各物质的物质的量的变化如图所示。试写出该反应的化学方程式为___________ 。
(4)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为:CH3OH+8OH--6e-=CO +6H2O;O2+2H2O+4e- =4OH-。则甲醇应通入该燃料电池的
+6H2O;O2+2H2O+4e- =4OH-。则甲醇应通入该燃料电池的___________ 极(填“正”或“负”)。当通入67.2 L O2(在标准状况下)完全反应后,消耗甲醇的质量为___________ 。

(1)在如图构想的物质和能量循环中,太阳能最终转化为
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为甲醇(CH3OH),该反应的化学方程式为2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
2CH3OH(g)+3O2(g)。一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CH3OH)/mol | 0 | 0.040 | 0.070 | 0.080 | 0.085 | 0.085 |
用O2表示0~3 min内该反应的平均反应速率为
(3)一定温度下,向容积为2 L的密闭容器中通入两种气体并发生反应,反应中各物质的物质的量的变化如图所示。试写出该反应的化学方程式为

(4)用人工光合作用得到的甲醇、氧气和KOH溶液制作燃料电池,其电极反应分别为:CH3OH+8OH--6e-=CO
 +6H2O;O2+2H2O+4e- =4OH-。则甲醇应通入该燃料电池的
+6H2O;O2+2H2O+4e- =4OH-。则甲醇应通入该燃料电池的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】李克强总理在十二届全国人大五次会议上作政府工作报告时强调:坚决打好蓝天保卫战。今年二氧化硫、氮氧化物排放量要分别下降3%,重点地区细颗粒物(PM2.5)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
(1)催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为___ 。
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。现向2L恒容密闭容器中加入2mol CO2、6mol H2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.5mol·L-1,请回答以下问题:
CH3OH(g)+H2O(g)。现向2L恒容密闭容器中加入2mol CO2、6mol H2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.5mol·L-1,请回答以下问题:
(2)前10s内的平均反应速率v(H2O)=__ 。
(3)其它条件不变的情况下,在10s时往容器中再加入一定量H2,此时该反应正向速率将___ (填“增大”或“减小”或“不变”)。
(4)下列叙述能说明原反应达到平衡状态的是___ 。
a.单位时间内消耗nmol CH3OH的同时生成nmol CO2
b.1mol CO2生成的同时有3mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2与Ca(OH)2悬浊液发生反应。
(5)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是___ 。
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(6)请写出脱硫过程发生的主要化学方程式:___ 。
Ⅰ.脱硝:
(1)催化剂存在下,H2还原NO2生成水蒸气和另一种无毒气体的化学方程式为
Ⅱ.脱碳:一定条件下CO2会和H2反应合成CH3OH。方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。现向2L恒容密闭容器中加入2mol CO2、6mol H2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.5mol·L-1,请回答以下问题:
CH3OH(g)+H2O(g)。现向2L恒容密闭容器中加入2mol CO2、6mol H2,在恒温下发生反应。10s后反应达到平衡,此时容器内CH3OH的浓度为0.5mol·L-1,请回答以下问题:(2)前10s内的平均反应速率v(H2O)=
(3)其它条件不变的情况下,在10s时往容器中再加入一定量H2,此时该反应正向速率将
(4)下列叙述能说明原反应达到平衡状态的是
a.单位时间内消耗nmol CH3OH的同时生成nmol CO2
b.1mol CO2生成的同时有3mol H-H键断裂
c.CO2和H2的浓度保持不变
d.容器内压强保持不变
e.CO2和H2的物质的量之比保持不变
Ⅲ.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中SO2与Ca(OH)2悬浊液发生反应。
(5)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知SO2(g)与O2(g)反应生成SO3(g)为放热反应,则SO3(g)分解生成SO2(g)与O2(g)的反应为吸热反应
(6)请写出脱硫过程发生的主要化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:____ 。
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:____ 。
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。
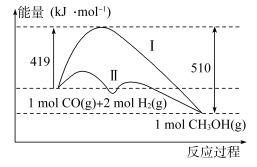
①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是____ kJ。
②选择适宜的催化剂____ (填“能”或“不能”)改变该反应的反应热。
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需____ (填“吸收”或“放出”)能量____ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是____ 。
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。

①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是
②选择适宜的催化剂
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
(1)写出铝和稀盐酸反应的化学方程式___________ 。
(2)实验②和③表明:该反应快慢与___________ 有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:___________ 和___________ 。
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围___________ 。
| 试验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铝丝消失的时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)实验②和③表明:该反应快慢与
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应,以下为探究外界条件对反应速率的影响。请回答下列问题:
(1)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子方程式为_______ 。
(2)完成此实验设计,其中:V1=_______ ,V2=_______ 。
(3)对比实验1、2可探究_______ 对反应速率的影响。
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol·L-1H2C2O4溶液 | 0.01mol·L-1KMnO4溶液 | 3.0mol·L-1稀H2SO4 | 水 | 温度/℃ | ||
| 1 | 12.0 | 2.0 | 3.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 3.0 | V1 | 20 | t2 |
| 3 | V2 | 2.0 | 3.0 | 9.0 | 30 | t3 |
(2)完成此实验设计,其中:V1=
(3)对比实验1、2可探究
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在恒温恒容条件下,a mol CO与2a molH2的混合气体在催化剂作用下发生反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ∆H<0。
CH3OH(g) ∆H<0。
(1)平衡后将容器的容积压缩到原来的一半,对平衡体系产生的影响是_______(填字母)。
(2)若容器容积不变,下列措施可增大甲醇产率的是_______ (填字母)。
A.升高温度 B.将CH3OH从体系中分离 C.充入He,使体系总压强增大
(3)若起始压强为PokPa,反应达到平衡时甲醇体积分数为25%,则此时CO物质的量为_______ ,化学平衡常数KP=_______ ,(KP用气体平衡分压代替平衡浓度计算。气体分压=气体总压×气体体积分数)
 CH3OH(g) ∆H<0。
CH3OH(g) ∆H<0。(1)平衡后将容器的容积压缩到原来的一半,对平衡体系产生的影响是_______(填字母)。
| A.c(H2)减小 | B.正反应速率加快,逆反应速率减慢 |
| C.反应物转化率都增大 | D.重新平衡时 减小 减小 |
A.升高温度 B.将CH3OH从体系中分离 C.充入He,使体系总压强增大
(3)若起始压强为PokPa,反应达到平衡时甲醇体积分数为25%,则此时CO物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】对于A+2B(g)  nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:
nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:
(1)增压,平衡不移动,当n=2时,A为____ 态;当n=3时,A为______ 态。
(2)若A为固态,增大压强,C的组分含量减少,则n_________ 。
(3)升温,平衡向右移动,则该反应的逆反应为_______ 热反应。
 nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:
nC(g)。在一定条件下达到平衡后,改变下列条件,请回答:(1)增压,平衡不移动,当n=2时,A为
(2)若A为固态,增大压强,C的组分含量减少,则n
(3)升温,平衡向右移动,则该反应的逆反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________ ;该反应在________ 条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g) CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
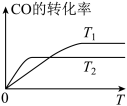
①T1________ T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________ (填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________ (填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________ ;
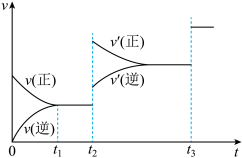
t3时采取的措施可能是_________________ 。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________ ;正极的电极反应为_______________________ 。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1
②若容器容积不变,下列措施不能增加CO转化率的是
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是

t3时采取的措施可能是
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是
您最近一年使用:0次