已知25℃时有关弱酸的电离平衡常数如下表:
下列推断正确的是
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 |  | 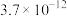 |   |
A.等pH的HX和HY浓度大小为: |
B.相同条件下溶液的碱性: |
C.Na2CO3溶液中加入过量HX,离子方程式为: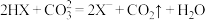 |
D.NaY溶液中通入过量CO2,离子方程式为: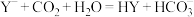 |
更新时间:2021-02-02 15:39:40
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列离子方程式正确的是
| A.氧化铁溶于氢碘酸溶液的反应:Fe2O3+6H+=2Fe3++3H2O |
B.已知电离平衡常数:H2CO3>HClO>HCO ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO |
C.硫酸亚铁铵(NH4)2FeSO4溶液与足量Ba(OH)2溶液反应:Fe2++2Ba2++2OH-+2SO =Fe(OH)2↓+2BaSO4↓ =Fe(OH)2↓+2BaSO4↓ |
D.碳酸氢钠溶液与少量澄清石灰水反应:Ca2++2OH-+2HCO =CaCO3↓+2H2O+CO =CaCO3↓+2H2O+CO |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】羟氨(NH2OH)在水溶液中的电离方程式为:NH2OH+H2O NH3OH++OH-,用0.1mol/L盐酸滴定20mL0.1mol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的OH-浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
NH3OH++OH-,用0.1mol/L盐酸滴定20mL0.1mol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的OH-浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )

 NH3OH++OH-,用0.1mol/L盐酸滴定20mL0.1mol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的OH-浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
NH3OH++OH-,用0.1mol/L盐酸滴定20mL0.1mol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的OH-浓度的负对数与盐酸体积的关系如图所示,下列说法错误的是( )
| A.A到D溶液中,NH2OH电离常数不变 |
| B.由A到D,水电离出的c(OH-)逐渐减小 |
| C.B点对应的溶液中c(Cl-)=c(NH3OH+) |
| D.C点对应的溶液中c(H+)=c(OH-)+ c(NH2OH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】用NA代表阿伏加德罗常数的数值,下列叙述正确的是
| A.30gHCHO与CH3COOH混合物中含C原子数为NA |
| B.4.8g正丁烷和1.0g异丁烷的混合物中共价键数目为1.4NA |
C. 、 、 时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA 时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA |
D.0.1 mol·L-1Na2CO3溶液中含有的 数目小于0.1 NA 数目小于0.1 NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列有关实验,对应现象以及结论都正确的是
| 实验 | 现象 | 结论 | |
| A | 向盛有H2O2溶液的试管中加入几滴酸化的FeSO4溶液 | 溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成 | Fe3+催化H2O2分解产生O2,分解反应放热,促进Fe3+的水解 |
| B | 向装有Ag2O晶体的两支试管中分别加入稀硝酸和氨水 | 两支试管中的Ag2O晶体均溶解 | Ag2O是两性氧化物 |
| C | 分别取少量CuSO4、CuCl2、CuBr2、K2SO4、NaCl、KBr固体溶于水 | CuSO4、CuCl2、CuBr2溶液均呈蓝色,K2SO4、NaCl、KBr溶液均呈无色 | Cu2+呈蓝色 |
| D | 将氢氧化镁固体投入到足量浓氯化铵溶液中 | 氢氧化镁固体溶解 | 氯化铵溶液呈酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】已知25 ℃时有关弱酸的电离平衡常数如下表:
下列推断正确的是
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.4×10-7 K2=4.7×10-11 |
| A.HX、HY两种弱酸的酸性:HX>HY |
| B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 |
C.向Na2CO3溶液中加入足量HY,反应的离子方程式:HY+CO =HCO =HCO +Y- +Y- |
| D.HX和HY酸性相同,都比H2CO3弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知H2C2O4是一种二元弱酸。室温下,通过下列实验探究NaHC2O4溶液的性质。
实验1:测得10 mL0.1 mol·L-1NaHC2O4溶液的pH约为5.5
实验2:向0.1 mol·L-1NaHC2O4溶液中加入等体积0.1 mol·L-1Ba(OH)2溶液,溶液变浑浊
实验3:向酸性KMnO4溶液中滴加过量0.1 mol·L-1NaHC2O4溶液,溶液紫红色褪去。
若忽略溶液混合时的体积变化,下列说法正确的是
实验1:测得10 mL0.1 mol·L-1NaHC2O4溶液的pH约为5.5
实验2:向0.1 mol·L-1NaHC2O4溶液中加入等体积0.1 mol·L-1Ba(OH)2溶液,溶液变浑浊
实验3:向酸性KMnO4溶液中滴加过量0.1 mol·L-1NaHC2O4溶液,溶液紫红色褪去。
若忽略溶液混合时的体积变化,下列说法正确的是
A.0.1 mol·L−1H2C2O4溶液:c(H+)=0.1 mol·L-1+c(C2O )+c(OH−)−c(H2C2O4) )+c(OH−)−c(H2C2O4) |
| B.由实验1可得出:Kw>Ka1(H2C2O4)×Ka2(H2C2O4) |
| C.由实验2推测:Ksp(BaC2O4)>2.5×10−3 |
| D.由实验3推测:NaHC2O4溶液具有漂白性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】NaH2A—Na2HA溶液是人体存在的缓冲溶液。常温下,H3A溶液中各微粒组成随着pH而变化,溶液中A3-、HA2-、H2A-、H3A浓度所占分数(δ)随pH变化的关系如图所示。
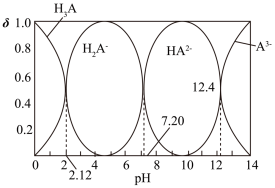
下列说法错误的是

下列说法错误的是
| A.0.1mol/LNaH2A溶液显酸性 |
| B.H3A+HA2—=2H2A—的平衡常数K=105.08 |
| C.将等物质的量的Na2HA和NaH2A配制成溶液,pH=7.20 |
| D.pH=12.40时,存在关系:c(H+)<2c(HA2—)+c(H2A—)+3c(A3—)+c(OH—) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】在常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.浓度均为0.1 mol·L-1 的CuSO4和(NH4)2SO4的混合溶液中:c(NH ) >c(SO ) >c(SO ) >c(Cu2+) >c(H+) ) >c(Cu2+) >c(H+) |
B.pH=6的NaHSO3溶液中:c(SO ) -c(H2SO3) =9.9 ×10-6 mol·L-1 ) -c(H2SO3) =9.9 ×10-6 mol·L-1 |
C.向10mL0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,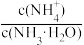 逐渐减小 逐渐减小 |
| D.等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液中:c(Na+) >c(HX) >c(X-) >c(H+) >c(OH-) |
您最近一年使用:0次

 的关系如下图所示(已知:pKb=−lg Kb)。下列说法错误的是(
的关系如下图所示(已知:pKb=−lg Kb)。下列说法错误的是(


