某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的醋酸溶液,c(H+)之比为1∶10
③pH相等的四种溶液:a.CH3COONa;b. NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由大到小的顺序为d、b、c、a
④室温下,NH4 HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO )
)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka×Kh=Kw
⑥pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH值仍相同,则m>n
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的醋酸溶液,c(H+)之比为1∶10
③pH相等的四种溶液:a.CH3COONa;b. NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由大到小的顺序为d、b、c、a
④室温下,NH4 HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO
 )
)⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka×Kh=Kw
⑥pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH值仍相同,则m>n
| A.①②④ | B.④⑤⑥ | C.①②⑤ | D.②⑤⑥ |
更新时间:2021-02-23 23:17:27
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】已知 时,水的电离达到平衡:
时,水的电离达到平衡: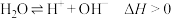 ,下列叙述正确的是
,下列叙述正确的是
 时,水的电离达到平衡:
时,水的电离达到平衡: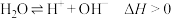 ,下列叙述正确的是
,下列叙述正确的是A.向水中加入稀氨水,平衡逆向移动, 减小 减小 |
B.将水加热,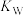 不变 不变 |
C.向水中加入少量 固体,平衡逆向移动, 固体,平衡逆向移动,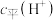 减小 减小 |
D.向水中加入少量 固体, 固体,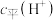 增大, 增大,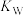 不变 不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向10mL 0.1mol·L-1 CH3COOH溶液中逐滴滴入0.1 mol·L-1的某碱ROH溶液,所得溶液pH及导电性变化如图所示。下列分析错误的是
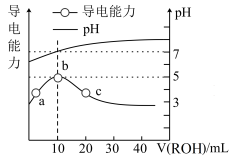

| A.b点溶液的pH=7,此时酸碱恰好中和 |
| B.b点导电能力最强,说明ROH为强碱 |
| C.c点溶液存在c(R+)>c(CH3COO-)、c(OH-)>c(H+) |
| D.b~c任意点溶液均有c(H+)·c(OH-)= Kw=10-14 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列叙述正确的是
| A.pH=3的醋酸溶液,稀释至10倍时溶液的pH<4 |
| B.等浓度的醋酸溶液与氢氧化钠溶液等体积混合后pH=7 |
| C.等体积pH均为3的醋酸和盐酸分别与足量Zn反应,盐酸产生的H2多 |
| D.室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,下列各组溶液充分混合后,混合液的pH一定大于7的是
| A.将pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合 |
| B.将pH=2的盐酸与pH=12的Ba(OH)2溶液等体积混合 |
| C.将0.1 mol·L-1的酸性溶液与0.2 mol·L-1的碱性溶液等体积混合 |
| D.将pH=9的溶液加水稀释1 000倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A. 的NaF溶液中含有0.1NA个 的NaF溶液中含有0.1NA个 |
| B.常温常压下,22.4LCl2完全溶于水时,转移电子数小于NA |
| C.标准状况下,44.8L的NO与22.4L的O2混合后,分子数为2NA |
D.25℃时, 的CH3COOH溶液中,水电离出的 的CH3COOH溶液中,水电离出的 的数目为0.01NA 的数目为0.01NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.32g环状 ( ( )分子中含有S—S键的数目为 )分子中含有S—S键的数目为 |
B.1mol 与足量氧气充分反应,生成 与足量氧气充分反应,生成 的分子数为 的分子数为 |
C.12g 固体中含有 固体中含有 的数目为 的数目为 |
D. 的 的 溶液中含有 溶液中含有 的数目为 的数目为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下(25℃),用0.1mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/L的CH3COOH溶液和HA溶液所得滴定曲线如图所示,下列说法正确的是


| A.常温下(25℃)HA的电离平衡常数Ka(HA)的数量级为10-10 |
| B.a点时溶液中微粒浓度大小关系为:c(A-)>c(Na+)>c(HA)>c(OH-)>c(H+) |
| C.b点溶液中存在:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| D.c点溶液中溶质为CH3COONa,溶液中离子浓度大小关系:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,H2C2O4的电离常数:Ka1=5.4×10-2,Ka2=5.0×10-5。在V1mL0.1mol•L-1H2C2O4溶液中滴加0.1mol•L-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是( )


| A.V1=20mL |
| B.b点和d点对应的溶液中都存在:c(K+)=c(HC2O4-)+2c(C2O42-) |
| C.常温下,加水稀释b点对应的溶液,稀释后溶液pH减小 |
| D.常温下,KHC2O4的Kh1=2×10-10 |
您最近一年使用:0次

 、K+、C1-、Na+
、K+、C1-、Na+ 、Mg2+、Na+、SO
、Mg2+、Na+、SO
 =1×1012的溶液中:NH
=1×1012的溶液中:NH 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO 溶于水和干冰升华都只有分子间作用力改变
溶于水和干冰升华都只有分子间作用力改变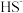 的水解程度增大,pH增大
的水解程度增大,pH增大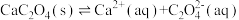 [已知
[已知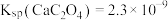 ,
, ,
, 的电离常数
的电离常数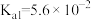 ,
,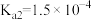 ,下列有关说法不正确的是
,下列有关说法不正确的是 形式存在
形式存在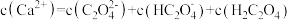
 溶液时,加入适量醋酸钠粉末,有利于生成
溶液时,加入适量醋酸钠粉末,有利于生成 沉淀
沉淀 至
至 ,则:
,则:


