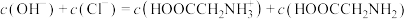下列说法不正确 的是
A. 相同的盐酸和醋酸溶液,用水稀释相同倍数后,盐酸的 相同的盐酸和醋酸溶液,用水稀释相同倍数后,盐酸的 变化大 变化大 |
B.常温下,加水稀释 溶液时,水电离的 溶液时,水电离的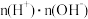 增大 增大 |
C.向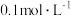 醋酸溶液中加入少量醋酸钠固体,溶液中 醋酸溶液中加入少量醋酸钠固体,溶液中 增大 增大 |
D.25℃时,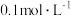 的 的 溶液电离度为1.0%,则该溶液的 溶液电离度为1.0%,则该溶液的 为3 为3 |
2021·浙江宁波·二模 查看更多[3]
浙江省宁波市2021届高三下学期高考适应性考试(二模)化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)
更新时间:2021/04/16 08:56:36
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知25℃时CH3COOH的电离常数K=1.6×10-5。该温度下向20ml 0.01mol·L-1 CH3COOH溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是

| A.a点溶液中c(H+)为4.0×10-5mol/L |
| B.c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO->c(H+)=c(OH-) |
| C.V=200 |
| D.a、b、c三点中水的电离程度最大的是c点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比为
①0.1mol•L-1的盐酸
②pH=1的醋酸溶液
③pH=12的氨水
④0.01mol•L-1的NaOH溶液
①0.1mol•L-1的盐酸
②pH=1的醋酸溶液
③pH=12的氨水
④0.01mol•L-1的NaOH溶液
| A.14:13:2:1 | B.1:10-1:10-12:10-14 |
| C.1:10:100:1 | D.1:1:10:10 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】25℃时,向20.00mL0.1000mol/LCH3COOH溶液中逐滴加入0.1000mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
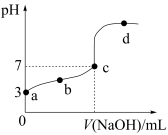

| A.a点溶液中:c(CH3COO-)约为10-3mol/L |
| B.水的电离程度:b点>c点 |
| C.c点溶液中:CH3COOH和NaOH恰好反应完全 |
| D.d点溶液中:c(Na+)<c(CH3COO-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,浓度相同的一元弱酸HR稀溶液和一元弱碱MOH稀溶液互相滴定,溶液中 和
和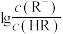 随pH变化关系如图所示。已知HR和MOH的电离常数为Ka和Kb,且x和y点的横坐标之和为14。
随pH变化关系如图所示。已知HR和MOH的电离常数为Ka和Kb,且x和y点的横坐标之和为14。
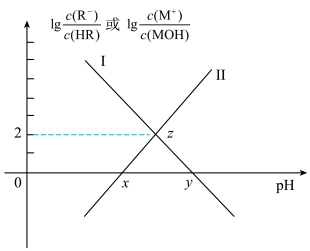
下列说法错误的是
 和
和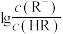 随pH变化关系如图所示。已知HR和MOH的电离常数为Ka和Kb,且x和y点的横坐标之和为14。
随pH变化关系如图所示。已知HR和MOH的电离常数为Ka和Kb,且x和y点的横坐标之和为14。
下列说法错误的是
A.曲线Ⅰ表示 与pH关系 与pH关系 |
B. Kb=10-5mol·L |
| C.水的电离程度:z>x>y |
D.z点满足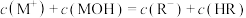 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,向某二元弱酸 溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化的关系如图所示。下列说法正确的是
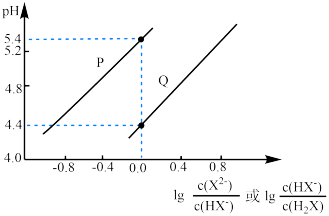
 溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化的关系如图所示。下列说法正确的是
溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化的关系如图所示。下列说法正确的是
A.Q表示pH与 的变化关系 的变化关系 |
B.pH=4.8时,溶液中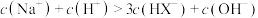 |
C.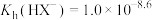 |
D.当混合溶液呈中性时,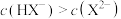 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】为证明某可溶性一元酸(HA)是弱酸,某学习小组成员分别设计了如下的实验方案,其中不合理的是( )
| A.室温下,测定0.1 mol/L HA溶液的pH,若pH>1,证明HA是弱酸 |
| B.室温下,测定1 mol/L NaA溶液的pH,若pH>7,证明HA是弱酸 |
| C.将等浓度、等体积的HCl和NaA溶液混合,若混合溶液的pH<7,证明HA是弱酸 |
| D.在相同条件下,分别对0.1 mol/L的HCl和0.1 mol/L的HA进行导电实验,若HA溶液的灯光较暗,证明HA为弱酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,下列有关离子浓度之间的关系不正确的是
| A.将CO2通入0.1mol/LNa2CO3溶液至中性(忽略溶液体积变化),溶液中:2c(CO32-)+c(HCO3-)=0.2mol/L |
| B.在0.1mol/LNaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO42-) |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后pH=5,则混合溶液中:c(Na+)>c(CH3COO-) |
| D.已知Ka(CH3COOH)=Kb(NH3·H2O),则常温下0.1mol/LCH3COONH4中:c(CH3COO-)=c(NH4+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列实验操作、实验现象及根据现象得出的结论,都正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 用食醋浸泡水垢,水垢主要成分:CaCO3与Mg(OH)2 | 水垢溶解,有无色气泡产生 | 碱性:CH3COONa>Na2CO3 |
B | 向浓度均为0.1 mol/L的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 先出现黄色沉淀 |
|
C | 向CH3COONa溶液中滴加酚酞,加热 | 溶液红色加深 | 水解是吸热过程 |
D | 用广泛pH试纸测定新制氯水的pH | pH=3.0 | 氯水呈酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
| A.②④ | B.①②⑤ | C.③④⑤ | D.②③ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法错误的是
A.制备 沉淀,洗涤沉淀时选择稀硫酸比选择水更好 沉淀,洗涤沉淀时选择稀硫酸比选择水更好 |
B.向 的醋酸溶液中加水稀释至原体积的100倍,稀释后溶液的 的醋酸溶液中加水稀释至原体积的100倍,稀释后溶液的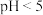 |
C.除去 溶液中的 溶液中的 ,可加入过量 ,可加入过量 ,过滤后再向滤液中加适量盐酸 ,过滤后再向滤液中加适量盐酸 |
D.向2mL0.1mol/L 溶液中滴加3滴0.1mol/LKI溶液,再滴加0.1mol/L 溶液中滴加3滴0.1mol/LKI溶液,再滴加0.1mol/L 溶液,产生黑色沉淀的离子方程式: 溶液,产生黑色沉淀的离子方程式: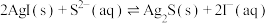 |
您最近一年使用:0次

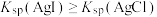
 。下列说法不正确的是
。下列说法不正确的是 )是一种两性有机物,可与盐酸反应生成盐酸盐(
)是一种两性有机物,可与盐酸反应生成盐酸盐( )。已知
)。已知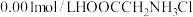 水溶液的pH=3
水溶液的pH=3