盐酸、醋酸、碳酸钠和碳酸氢钠都是生活中常见的物质。
(1)25℃时,浓度均为0.1 mol·L-1的盐酸和醋酸溶液,下列说法正确___________ 。
A.两溶液的pH相同
B.两溶液的导电能力相同
C.两溶液中由水电离出的 相同
相同
D.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水的电离程度___________ (大于、小于、等于)氯化铵溶液中水的电离程度
(3)醋酸溶液中存在电离平衡: ,下列叙述中正确的是
,下列叙述中正确的是___________ 。
A.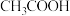 溶液中离子浓度关系满足:
溶液中离子浓度关系满足: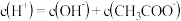
B.0.1 mol·L-1的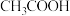 溶液加水稀释,溶液中
溶液加水稀释,溶液中 减小
减小
C.向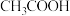 溶液中加入少量
溶液中加入少量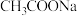 固体,
固体,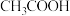 电离平衡逆向移动
电离平衡逆向移动
D.常温下, 的
的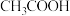 溶液与
溶液与 的NaOH溶液等体积混合后溶液的
的NaOH溶液等体积混合后溶液的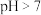
E.室温下 的醋酸溶液加水稀释,溶液中
的醋酸溶液加水稀释,溶液中 不变
不变
(4)①物质的量浓度相等的下列溶液:① NaNO3 ② H2SO4 ③ AlCl3 ④ Na2CO3 ⑤NaHCO3,请按PH由大到小的顺序排列___________
②等pH的碳酸钠与碳酸氢钠溶液,其物质的量浓度: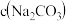
___________  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
(1)25℃时,浓度均为0.1 mol·L-1的盐酸和醋酸溶液,下列说法正确
A.两溶液的pH相同
B.两溶液的导电能力相同
C.两溶液中由水电离出的
 相同
相同D.中和等物质的量的NaOH,消耗两溶液的体积相同
(2)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水的电离程度
(3)醋酸溶液中存在电离平衡:
 ,下列叙述中正确的是
,下列叙述中正确的是A.
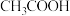 溶液中离子浓度关系满足:
溶液中离子浓度关系满足: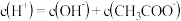
B.0.1 mol·L-1的
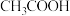 溶液加水稀释,溶液中
溶液加水稀释,溶液中 减小
减小C.向
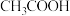 溶液中加入少量
溶液中加入少量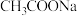 固体,
固体,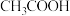 电离平衡逆向移动
电离平衡逆向移动D.常温下,
 的
的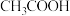 溶液与
溶液与 的NaOH溶液等体积混合后溶液的
的NaOH溶液等体积混合后溶液的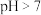
E.室温下
 的醋酸溶液加水稀释,溶液中
的醋酸溶液加水稀释,溶液中 不变
不变(4)①物质的量浓度相等的下列溶液:① NaNO3 ② H2SO4 ③ AlCl3 ④ Na2CO3 ⑤NaHCO3,请按PH由大到小的顺序排列
②等pH的碳酸钠与碳酸氢钠溶液,其物质的量浓度:
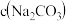
 填“
填“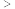 ”、“
”、“ ”或“
”或“ ”
” 。
。
更新时间:2021-05-22 22:53:02
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
①写出H2S的Ka1的表达式:________________ 。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是_______ 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________ 。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)
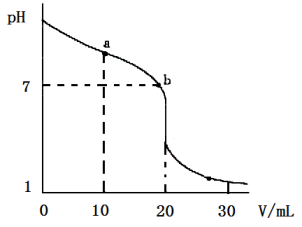
①a点所示的溶液中c(NH3·H2O)___________ c(Cl-)。
②b点所示的溶液中c(Cl-)___________ c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________ 。
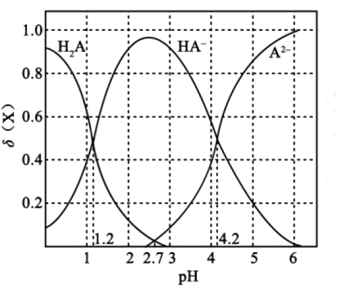
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________ 。
(1)已知部分弱酸的电离常数如下表:
| 化学式 | HF | H2CO3 | H2S |
| 电离平衡常数K(25℃) |  | 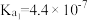 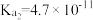 |  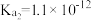 |
①写出H2S的Ka1的表达式:
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是
③将过量H2S通入Na2CO3溶液,反应的离子方程式是
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)

①a点所示的溶液中c(NH3·H2O)
②b点所示的溶液中c(Cl-)
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为

(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】(1)已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
依据复分解反应的规律,请你判断下列反应不能成立的是________ (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前面描述的信息判断,浓度均为0.05mol·L-1的下列六种物质的溶液中,pH最小的是______ (填编号);将各溶液分别稀释100倍,pH变化最小的是________ (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:______________________ 。
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1 mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图。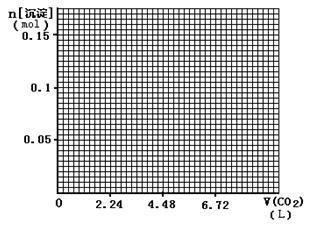
_________________________
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
依据复分解反应的规律,请你判断下列反应不能成立的是
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前面描述的信息判断,浓度均为0.05mol·L-1的下列六种物质的溶液中,pH最小的是
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子方程式:
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1 mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图。

您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】已知25℃时,醋酸、HCN和碳酸的电离平衡常数如下表:
(1)用饱和氨水吸收CO2可得到NH4HCO3溶液。若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
(2)在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中 =
=_______ 。
(3)写出少量CO2通入NaCN溶液的离子方程式:_______ 。
(4)某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=_______ mol/L。
(5)等体积、等浓度NaCN溶液和CH3COONa溶液中离子总数前者_______ 后者(填“>”“<”或“=”)。
(6)若常温下,将bmol·L–1的CH3COONa溶液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=_______ 。
| 物质的化学式 | CH3COOH | HCN | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K=4.9×10-10 | K1=4.3×10-7 | K2=5.6×10-11 |
(2)在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
 =
=(3)写出少量CO2通入NaCN溶液的离子方程式:
(4)某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=
(5)等体积、等浓度NaCN溶液和CH3COONa溶液中离子总数前者
(6)若常温下,将bmol·L–1的CH3COONa溶液与0.01mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】电解质在溶液中的行为是化学研究的重要内容之一。
已知25℃时,某些电解质的电离常数如表,回答下列问题:
(1)用蒸馏水稀释 的氢氟酸,数值随加水量的增加而增大的是________。
的氢氟酸,数值随加水量的增加而增大的是________。
(2)将过量 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为________________ ;等体积等浓度的 溶液和
溶液和 溶液中,离子总数前者
溶液中,离子总数前者________ 后者(填“>”“<”或“=”,下同);25℃时, 溶液的pH
溶液的pH________ 7。
(3)常温下,用 盐酸标准溶液滴定
盐酸标准溶液滴定

 溶液的曲线如图所示(忽略溶液混合时体积和温度的变化):
溶液的曲线如图所示(忽略溶液混合时体积和温度的变化):
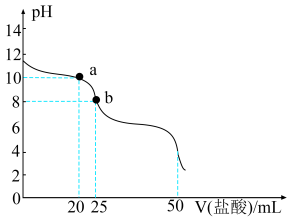
a点混合溶液中主要的溶质有Na2CO3、NaCl和________ (填化学式);此时, =
=________ ;b点混合溶液中, =
=________ 。
已知25℃时,某些电解质的电离常数如表,回答下列问题:
 |  |  |  |  | |
 |  | 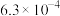 |   | 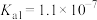 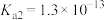 |  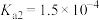 |
(1)用蒸馏水稀释
 的氢氟酸,数值随加水量的增加而增大的是________。
的氢氟酸,数值随加水量的增加而增大的是________。A. | B. | C. | D. |
(2)将过量
 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为 溶液和
溶液和 溶液中,离子总数前者
溶液中,离子总数前者 溶液的pH
溶液的pH(3)常温下,用
 盐酸标准溶液滴定
盐酸标准溶液滴定

 溶液的曲线如图所示(忽略溶液混合时体积和温度的变化):
溶液的曲线如图所示(忽略溶液混合时体积和温度的变化):
a点混合溶液中主要的溶质有Na2CO3、NaCl和
 =
= =
=
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】纳米磷酸钙是理想的生物材料,可用作骨骼和牙用骨水泥。将含有脲酶的Na3PO4溶液加入处于高速搅状态的尿素[CO(NH2)2]、CaC12和盐酸混合液中,可制得纳米磷酸钙。
已知:①CO(NH2)2+H2O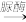 2NH3+CO2
2NH3+CO2
②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是___________ 。
(2)尿素水解液呈碱性,则c( )
)___________ c( )(填“>”或“<”)
)(填“>”或“<”)
(3)混合后,溶质的初始浓度如下表
①生成 的离子方程式为
的离子方程式为___________ 。
②初始时刻,溶液中含磷微粒浓度从大到小的顺序为___________ 。
③判断此时能否生成Ca3(PO4)2沉淀___________ (列式计算) 。
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是___________ (填序号) 。
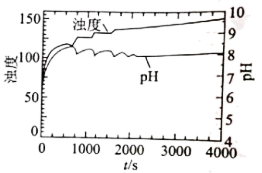
A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
已知:①CO(NH2)2+H2O
 2NH3+CO2
2NH3+CO2②25℃时,H3PO4的Ka1=7.5×10-3 、Ka2=6.3×10-8、Ka3=4.4×10-13;Ca3(PO4)2的Ksp=3.3×10-9。
(1)实验过程若降低搅拌速率,可能造成的不良后果是
(2)尿素水解液呈碱性,则c(
 )
) )(填“>”或“<”)
)(填“>”或“<”)(3)混合后,溶质的初始浓度如下表
| 物质 | CaCl2 | HCl | NaH2PO4 | NaCl | 尿素 | 脲酶 |
| 初始浓度 mol/L | 0.25 | 5×10-3 | 0.05 | 1 | 1.0 | 20U/mL |
①生成
 的离子方程式为
的离子方程式为②初始时刻,溶液中含磷微粒浓度从大到小的顺序为
③判断此时能否生成Ca3(PO4)2沉淀
(4)上述实验条件下,溶液的浊度、pH与反应时间t的关系如图所示,实验表明,pH在7.8-8.1之间出现周期性振荡,相关分析不正确的是

A.振荡周期内,PO43-浓度不变
B.随着尿素水解反应的进行,pH升高
C.随着磷酸钙沉淀的生成,pH下降
D.尿素水解速率和磷酸钙沉淀速率的差异引起pH周期性振荡
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】溶液中存在电离平衡、水解平衡、沉淀溶解平衡等多种形式的化学平衡。
(1)常温下,用0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1CH3COOH溶液,滴定曲线如图所示。
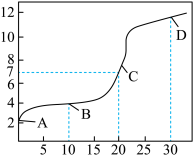
①B点所示的溶液中:c(Na+)+c(H+)_____ c(CH3COOH)+c(OH-)(填“>”、“=”或“<“)。
②C点为理论上的反应终点,则该滴定实验应选用的指示剂是____ ,此时溶液的pH大于7,原因是____ (用化学用语表示)。
③点D所示溶液中c(H+)、c(OH-)、c(CH3COOH)、c(CH3COO-)四者之间的等量关系式为:c(OH-)-c(H+)=______ 。
(2)已知常温时Ksp[Al(OH)3]=1×10-33,Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.9×10-5。
①常温下,某溶液中c(Mg2+)=5.6mol/L,欲除去该溶液中的Al3+(使其浓度小于1×10-5mol/L),需要调节pH的范围为______ <pH<_____ 。
②常温下,CaSO4(s)+CO32-(aq) CaCO3(s)+SO42-(aq)平衡常数的值为
CaCO3(s)+SO42-(aq)平衡常数的值为_______ 。
(1)常温下,用0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1CH3COOH溶液,滴定曲线如图所示。

①B点所示的溶液中:c(Na+)+c(H+)
②C点为理论上的反应终点,则该滴定实验应选用的指示剂是
③点D所示溶液中c(H+)、c(OH-)、c(CH3COOH)、c(CH3COO-)四者之间的等量关系式为:c(OH-)-c(H+)=
(2)已知常温时Ksp[Al(OH)3]=1×10-33,Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.9×10-5。
①常温下,某溶液中c(Mg2+)=5.6mol/L,欲除去该溶液中的Al3+(使其浓度小于1×10-5mol/L),需要调节pH的范围为
②常温下,CaSO4(s)+CO32-(aq)
 CaCO3(s)+SO42-(aq)平衡常数的值为
CaCO3(s)+SO42-(aq)平衡常数的值为
您最近半年使用:0次



