Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH1=+247.3kJ·mol-1Ⅱ.CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH2=+206.1kJ·mol-1Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
(1)ΔH3=
(2)一定条件下,向VL恒容密闭容器中通入2molCH4(g)、1molCO2(g)、1molH2O(g)发生上述反应,达到平衡时,容器中CH4(g)为amol,CO2(g)为bmol,H2O(g)为cmol,此时CO(g)的浓度为
(3)不同温度下,向VL密闭容器中按照n(CO2):n(CH4):n(H2O)=1:1:1投料,实验测得平衡时n(H2):n(CO)随温度的变化关系如图所示:
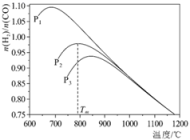
①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,n(H2):n(CO)先增大后减小。解释温度Tm前后,随着温度升高n(H2):n(CO)变化的原因分别是
(4)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
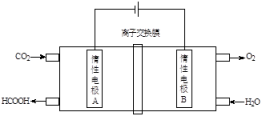
则A极的电极反应式为
相似题推荐
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2
H2(g)+CO2(g) ΔH2③C(s)+2H2(g)
 CH4(g) ΔH3
CH4(g) ΔH3④2CO(g)
 C(s)+CO2(g) ΔH4
C(s)+CO2(g) ΔH4(1)试写出CO2与H2反应生成CH4和H2O(g)的热化学方程式为
Ⅱ.CO2可用来生产燃料甲醇。CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得
CH3OH(g)+H2O(g) ΔH2= - 49kJ·mol-1,在体积为1L的恒容密闭容器中,充入1molCO2和2molH2,一定条件下发生上述反应,测得 的浓度随时间的变化如表所示:
的浓度随时间的变化如表所示:| 时间/min | 0 | 3 | 5 | 10 | 15 |
| 浓度/mol/L | 0 | 0.3 | 0.45 | 0.5 | 0.5 |
(3)下列措施中能使平衡体系中
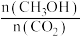 增大且不减慢化学反应速率的是_______。
增大且不减慢化学反应速率的是_______。| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.再充入1molH2 | D.将H2O(g)从体系中分离出去 |
(5)要提高CO2的转化率,可以采取的措施是_______(填序号)。
| A.加入催化剂 | B.增大CO2的浓度 | C.通入惰性气体 | D.通入H2 |
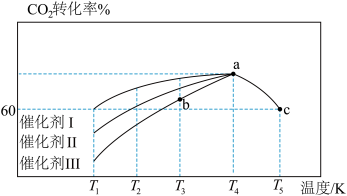
则催化效果最佳的是催化剂
 N2(g)+2H2O(g) △H=-664.0kJ·mol-1。
N2(g)+2H2O(g) △H=-664.0kJ·mol-1。(1)H2O的电子式为
(2)已知几种共价键的键能如下:
| 共价键 | H-H | N N N | N-O | H-O |
| 键能/(kJ·mol-1) | 436 | 946 | a | 464 |
(3)2NO(g)+2H2(g)
 N2(g)+2H2O(g)的反应速率表达式为v正=k正cn(NO)cm(H2)(k正为正反应速率常数,只与温度有关。m和n为反应级数,取最简正整数)。
N2(g)+2H2O(g)的反应速率表达式为v正=k正cn(NO)cm(H2)(k正为正反应速率常数,只与温度有关。m和n为反应级数,取最简正整数)。为了探究一定温度下NO、H2的浓度对反应速率的影响,测得实验数据如下:
| 序号 | c(NO)/(mol·L-1) | c(H2)/(mol·L-1) | v正/(mol·L-1·min-1) |
| I | 0.10 | 0.10 | 0.414k正 |
| II | 0.10 | 0.20 | 0.828k正 |
| III | 0.30 | 0.10 | 3.726k正 |
②经研究,有人提出上述反应分两步进行:(a)2NO(g)+H2(g)=N2(g)+H2O2(g);(b)H2O2(g)+H2(g)=2H2O(g)。化学总反应由较慢的一步反应决定。上述反应中,(a)反应较慢,(a)正反应活化能
③1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:k=A•eEa/RT[k为反应速率常数,A为比例常数,e为自然对数的底数,R为气体摩尔常数,T为开尔文温度,Ea为活化能(kJ•mol-1)]。2NO(g)+2H2(g)
 N2(g)+2H2O(g)反应达到平衡后,升高温度,正反应速率常数增大的倍数
N2(g)+2H2O(g)反应达到平衡后,升高温度,正反应速率常数增大的倍数(4)一定温度下,在2L恒容密闭容器中充入2molNO(g)、2molH2(g)发生上述反应,混合气体压强随时间变化关系如图所示。

①0~5min内N2的平均速率v(N2)=
②该温度下,上述反应的平衡常数K=
③其他条件不变,在10min时向反应体系中再充入1molNO、1molH2,达到新平衡时NO的平衡转化率
(5)工业上,可以采用电化学方法处理NO。以惰性材料为电极,以硝酸铵溶液为电解质溶液并补充NH3,电解反应为8NO+7H2O+2NH3
 5NH4NO3。电解过程中,阳极的电极反应式为
5NH4NO3。电解过程中,阳极的电极反应式为(1)目前工业上可用CO2生产甲醇燃料,反应的化学方程式为: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),△H。
CH3OH(g)+H2O(g),△H。已知:
| 共价键 | C=O | H—H | C—O | C—H | O—H |
| 键能(KJ·mol-1) | 750 | 436 | 358 | 413 | 463 |
(2)研究证明。用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图所示: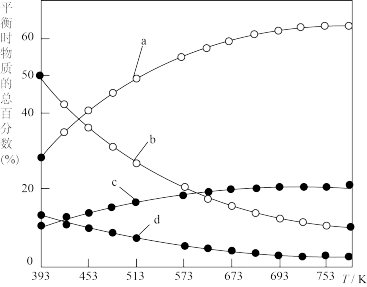
①对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=
②曲线a表示的物质为H2,理由是
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
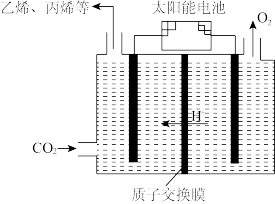
④在强酸性电解质水溶液中,以惰性电极电解CO2可得到多种燃料,其原理如图所示,电解时,生成乙烯的电极反应式
(3)工业上利用CO2和NH3反应来制取尿素,反应2NH3+CO2
 CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图:
CO(NH2)2+H2O,在合成塔中不同氮碳比a[n(NH3)/n(CO2)]和水碳比b[n(H2O)/n(CO2)]时二氧化碳转化率(x)如图: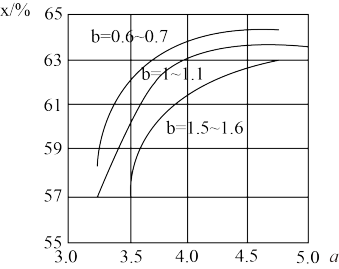
①b宜控制在
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61;
②a宜控制在4.0左右,理由是
(4)工业上利用CO2和CH3OH反应制取碳酸二甲酯,反应:CO2(g)+2CH3OH(g)
 CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V="
CH3OOCOOCH3(g)+H2O(g),在恒温、容积可变的密闭容器中加入1 molCO2, 2molCH3OH+CO2的转化率与反应时间关系如图所示,在反应过程中,若t1时容器体积为1000mL,则t2时容器体积V=" 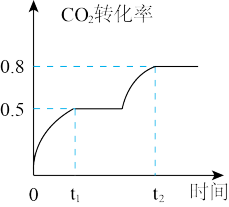
 和
和 反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:(1)A、B均为1L的恒容密闭容器,向A容器中充入1mol
 和1mol
和1mol ,向B容器中充入1mol
,向B容器中充入1mol 和1mol
和1mol 在催化剂存在下发生反应:
在催化剂存在下发生反应: ,测得
,测得 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。
 表示0~5min内的化学反应速率为
表示0~5min内的化学反应速率为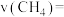
 为
为 、
、 各0.4mol,CO、
各0.4mol,CO、 各1.2mol,重新达到平衡前,
各1.2mol,重新达到平衡前,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②a点时该反应的平衡常数为
 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③a、b两点处容器内气体总压强分别是p(a)、p(b),则p(a)、p(b)的大小顺序为
(2)对于反应③:
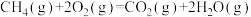 ,在使用不同催化剂时,相同时间内测得
,在使用不同催化剂时,相同时间内测得 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。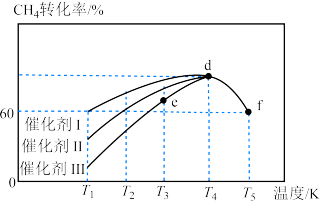

 逆(填“>”“<”或“=”),f点转化率比d点低的原因是
逆(填“>”“<”或“=”),f点转化率比d点低的原因是(1)乙烷在一定条件可发生如下反应:
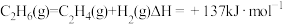 ,提高该反应平衡转化率的方法有
,提高该反应平衡转化率的方法有(2)高温下,甲烷生成乙烷的反应如下:
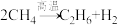 。反应在初期阶段的速率方程为:
。反应在初期阶段的速率方程为: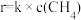 ,其中k为反应速率常数。
,其中k为反应速率常数。①设反应开始时的反应速率为r1,甲烷的转化率为
 时的反应速率为r2,则r2=
时的反应速率为r2,则r2=②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
II、研究氮及其化合物的转化对于环境改善有重大意义。
已知

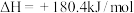 ,
,
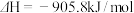 。
。(3)用NH3消除NO污染的反应为:
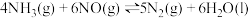 ,则该反应自发进行的条件是
,则该反应自发进行的条件是(4)不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。曲线a中NH3的起始浓度为
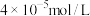 ,从A点到B点经过2秒,该时间段内NO的脱除速率为
,从A点到B点经过2秒,该时间段内NO的脱除速率为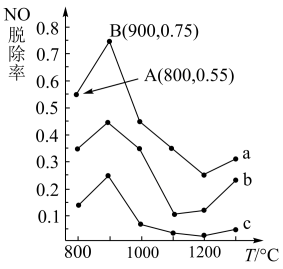
(5)工业烟气中的氮氧化物用NH3催化还原,发生反应:
 ,研究表明不同氨氮比
,研究表明不同氨氮比 条件下测得NO的残留率与温度关系如图所示。随着温度不断升高,NO的残留率趋近相同的可能原因是
条件下测得NO的残留率与温度关系如图所示。随着温度不断升高,NO的残留率趋近相同的可能原因是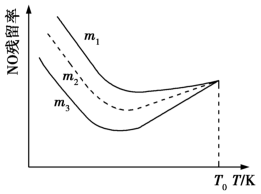
(1)“碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ:CH4(g) + CO2(g)
 2CO(g) + 2H2(g) ∆H1 = +247kJ·mol-1,K1
2CO(g) + 2H2(g) ∆H1 = +247kJ·mol-1,K1Ⅱ:CO2(g) + H2(g)
 CO(g) + H2O(g) ∆H2 = +41kJ·mol-1,K2
CO(g) + H2O(g) ∆H2 = +41kJ·mol-1,K2①反应Ⅰ的活化能Ea(正)
②反应CH4(g) + 3CO2(g)
 4CO(g) + 2H2O(g)的∆H =
4CO(g) + 2H2O(g)的∆H = ③在T温度下,将6 mol CH4(g) 和8mol CO2(g) 充入2L的恒容密闭容器中发生反应Ⅰ和Ⅱ,达到平衡状态时H2(g)和H2O(g)的物质的量均为2 mol。则T温度时反应Ⅰ的平衡常数K为
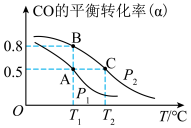
(2)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为 CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为
②平衡常数KA、KB、KC的大小关系为
③若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为
④利用CO2和H2也可合成甲醇:CO2(g)+3H2(g)
 CH3OH(g) + H2O (g) ∆H < 0。根据该反应中各物质的物质的量得到v正 ~ n(CO2)和v逆 ~ n(CH3OH)的关系可用如图表示。在图示达到平衡后,
CH3OH(g) + H2O (g) ∆H < 0。根据该反应中各物质的物质的量得到v正 ~ n(CO2)和v逆 ~ n(CH3OH)的关系可用如图表示。在图示达到平衡后,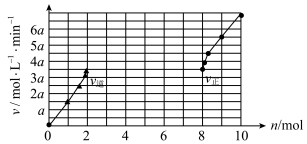
Ⅰ.制备Cu2O
(1)微乳液—还原法:在100℃的Cu(NO3)2溶液中加入一定体积的NaOH溶液,搅拌均匀,再逐滴加入肼(N2H4)产生红色沉淀,抽滤、洗涤、干燥,得到Cu2O。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-akJ·mol-1
Cu(OH)2(s)=CuO(s)+H2O(l)△H=+bkJ·mol-1
4CuO(s)=2Cu2O(s)+O2(g)△H=+ckJ·mol-1
则由N2H4(l)和Cu(OH)2(s)反应制备Cu2O(s)的热化学方程式为
(2)电解法:纳米级Cu2O由于具有优良的催化性能而受到关注。
采用阴离子交换膜制备纳米级Cu2O的装置如图所示:
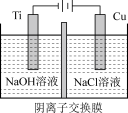
阳极的电极反应式为
Ⅱ.纳米级Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ·mol-1
(3)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是(填字母)。
CH3OH(g)已达平衡状态的是(填字母)。| A.CO的消耗速率等于CH3OH的生成速率 |
| B.一定条件,CO的转化率不再变化 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.CO和H2的浓度比不变 |
时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①0~5s内CH3OH的平均速率是
②t℃时该反应的压力平衡常数Kp为
③保持其它条件不变,向平衡体系中充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(5)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:
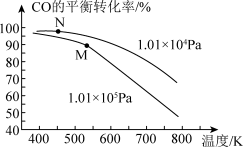
 和
和 充入密闭容器中进行如下反应:
充入密闭容器中进行如下反应:I:


II:


III:
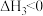
回答下列问题:
(1)
 转化率
转化率 、
、 选择性(产物中CH3OH的物质的量与参加反应
选择性(产物中CH3OH的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用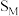 表示)、
表示)、 选择性(产物中
选择性(产物中 的物质的量与参加反应
的物质的量与参加反应 的物质的量之比,用
的物质的量之比,用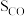 表示)随温度变化如图所示。
表示)随温度变化如图所示。
①反应I正反应活化能为
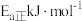 ,逆反应活化能为
,逆反应活化能为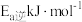 ,则
,则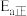
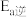 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②图1中表示
 的曲线是
的曲线是③已知T=240℃,
 ,
,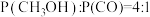 ,反应Ⅱ的分压平衡常数
,反应Ⅱ的分压平衡常数
(2)为探究原料气中混杂
 对反应的影响,测得
对反应的影响,测得 小、平衡时
小、平衡时 与初始
与初始 物质的量之比
物质的量之比 随原料气中
随原料气中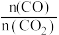 的变化如图所示。
的变化如图所示。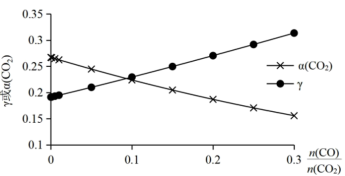
①图2中
 降低而
降低而 升高的原因是
升高的原因是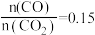 时,
时,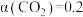 ,
,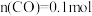 则
则
②下列措施能提高
 值的是
值的是A.恒容条件通入
 B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
B.恒压条件通入氩气 C.选用更高效的催化剂 D.将尾气进行循环使用
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为
②在一个体积固定的真空密闭容器中充入等物质的量的CO2和NH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示:
CO(NH2)2(s)+H2O(g)并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示: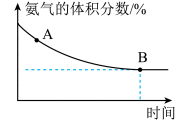
则A点的v正(CO2)
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:2NO(g)+O2(g)=2NO2(g)△H1=akJ·mol-1,NO(g)+O3(g)=NO2(g)+O2(g)△H2=bkJ·mol-1,6NO2(g)+O3(g)===3N2 O5(g)△H3=c kJ·mol-1,则反应4NO2(g)+O2(g)=2N2O5(g)的△H=
(3)氮氧化物也可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为
 NaNO2(ag)+H2O(1)的平衡常数K=
NaNO2(ag)+H2O(1)的平衡常数K=Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:
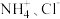 ,可用电化学氧化法加以处理。
,可用电化学氧化法加以处理。(1)图1是电化学氧化法的原理示意图。a的电极反应式是
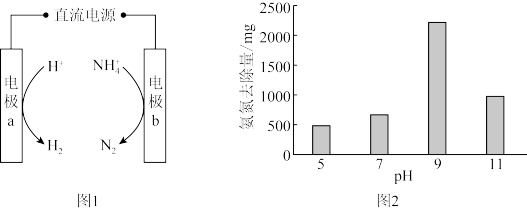
(2)研究显示,其他条件不变时,不同
 下氨氮的去除量如图2所示。已知:
下氨氮的去除量如图2所示。已知: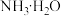 与
与 相比,在电极表面的吸附效果更好。结合平衡移动原理和图中数据,解释
相比,在电极表面的吸附效果更好。结合平衡移动原理和图中数据,解释 从5到9时氨氮去除量增大的原因:
从5到9时氨氮去除量增大的原因:(3)在电解废水的过程中,
 会经历“
会经历“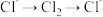 ”的过程。其他条件相同、
”的过程。其他条件相同、 的浓度不同时,废水中氨氮脱除效率的实验结果如下:
的浓度不同时,废水中氨氮脱除效率的实验结果如下: 的浓度/( 的浓度/(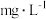 ) ) | 400 | 100 |
| 电解时间/h | 0.5 | 0.5 |
氨氮脱除效率/(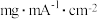 ) ) | 2.40.8 |
①其它条件相同、适当提高
 的浓度,可以显著增大废水中
的浓度,可以显著增大废水中 的脱除效率。
的脱除效率。用化学用语解释原因:
 。
。②图2中,
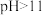 时,废水中
时,废水中 去除量下降,可能的原因是:
去除量下降,可能的原因是: CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体中碳元素的质量分数不再改变 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.2v(H2)正=v(CO)逆 |
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g)
 HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1③O2(g)+2H2(g)
 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。

A.电解池的阴极电极反应式为2CO2+2e-+H2O=HCOO-+HCO |
| B.b为电源正极 |
| C.电解一段时间后,阳极区的KHCO3 溶液浓度降低 |
| D.若以氢氧碱性燃料电池作直流电源,那么负极的电极反应式为H2-2e-+2OH-=2H2O |
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
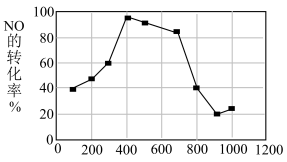
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。

| A.a | B.b | C.c | D.d |
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为
 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是