采矿废水中常含有氢氰酸(HCN)和亚砷酸(H3AsO3)等有害物质,必须经过处理达标后才能排放。
Ⅰ.金矿提金时,用NaCN溶液浸取获得Na[Au(CN)2]进一步处理时产生氢氰酸(HCN,电离常数K=5×10-10)。
(1)NaCN中σ键与π键数目之比为_______ 。
(2)通过电激发产生羟基自由基(HO*)和OH-可处理废水中的CN-,可能的反应机理如图所示。
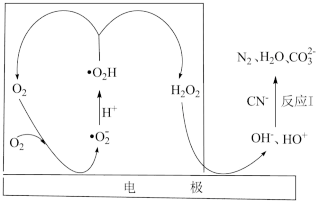
①反应I的离子方程式为_______ 。
②虚线方框内的过程可描述为_______ 。
Ⅱ.工业上常将废水中的亚砷酸(H3AsO3)氧化成砷酸(H3AsO4),再调节到合适的pH范围内用吸附剂脱除。砷酸(H3AsO4)溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。
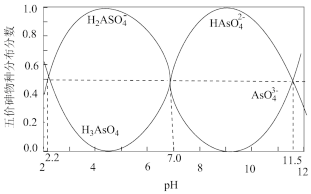
(3)砷元素基态原子的电子排布式为:_______ 。
(4)当溶液pH=4.1时,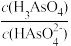 =
=_______ 。
(5)在25℃时,在浓度均为0.1 mol/L的NaCN溶液和NaH2AsO4溶液中,pH较大的是_______ 。
Ⅰ.金矿提金时,用NaCN溶液浸取获得Na[Au(CN)2]进一步处理时产生氢氰酸(HCN,电离常数K=5×10-10)。
(1)NaCN中σ键与π键数目之比为
(2)通过电激发产生羟基自由基(HO*)和OH-可处理废水中的CN-,可能的反应机理如图所示。

①反应I的离子方程式为
②虚线方框内的过程可描述为
Ⅱ.工业上常将废水中的亚砷酸(H3AsO3)氧化成砷酸(H3AsO4),再调节到合适的pH范围内用吸附剂脱除。砷酸(H3AsO4)溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。

(3)砷元素基态原子的电子排布式为:
(4)当溶液pH=4.1时,
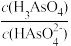 =
=(5)在25℃时,在浓度均为0.1 mol/L的NaCN溶液和NaH2AsO4溶液中,pH较大的是
更新时间:2022-01-23 10:16:41
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】表中是元素周期表的一部分,请参照元素①~③在表中的位置,回答下列问题:
(1)②与氢气化合产物的电子式是______________ 。
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为_____________ 。
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程____________ 。
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为____________ 。
(5)下列事实能判断①和②的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是__________ 。
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为_________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ |
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为
(5)下列事实能判断①和②的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】研究小组探究高铜酸钠(NaCuO2)的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:_____ ;制备时滴加的CuCl2溶液不宜过量。
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是______ 。
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是______ 。
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:___________ 。
②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,___________ 。
ii.提出假设2:___________ ,经证实该假设也成立。
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是___________ 。
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、___________ 溶液和___________ 溶液。
资料:高铜酸钠为棕黑色固体,难溶于水。
【实验I】向2mL1mol/LNaClO溶液中滴加1mL1mol/LCuCl2溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1) CuCl2溶液显酸性,用离子方程式解释原因:
探究棕黑色沉淀的组成。
【实验Ⅱ】将一份浊液a过滤、洗涤、干燥,得到固体b.取少量固体b,滴加稀H2SO4,沉淀溶解,有气泡产生,得到蓝色溶液。
(2)①另取少量固体b进行实验,证实了固体中钠元素的存在,实验操作的名称是
②经进一步检验确认棕黑色固体是NaCuO2。NaCuO2与稀H2SO4反应的离子方程式是
探究实验条件对NaCuO2制备的影响。
【实验Ⅲ】向另一份浊液a中继续滴加1.5mLlmol/L CuCl2溶液,沉淀由棕黑色变为蓝绿色,溶液的pH约为5,有产生。
(3)①对Cl2的来源,甲同学认为是NaCuO2和
 反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:
反应生成了Cl2,乙同学认为该说法不严谨,提出了生成Cl2的其他原因:②探究继续滴加CuCl2溶液,NaCuO2能氧化Cl-的原因。
i.提出假设1:c(Cl-)增大,Cl-的还原性增强。实验证明假设成立。
操作和现象是:取少量NaCuO2固体于试管中,
ii.提出假设2:
【实验Ⅳ】向1mL1mol/LNaClO溶液中滴加0.5mL1mol/LCuSO4溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体能使带火星木条复燃但不能使湿润的淀粉KI试纸变蓝。
(4)通过以上实验,对于NaCuO2化学性质的认识是
(5)根据上述实验,制备在水溶液中稳定存在的NaCuO2,应选用的试剂是NaClO溶液、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
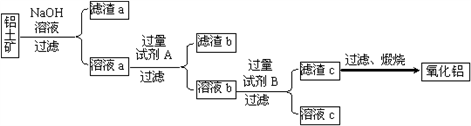
(1)试剂A是________ ;溶液b与试剂B反应的离子方程式为________ 。
(2)加入NaOH溶液进行的反应的离子方程式为_________ 、____________ 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2 AlN + CO(请配平)
AlN + CO(请配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(4)方法②比方法①在生产上更具优势。下列说法中,正确的是_______ 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:

(1)试剂A是
(2)加入NaOH溶液进行的反应的离子方程式为
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2
 AlN + CO(请配平)
AlN + CO(请配平)②氯化铝与氨气高温合成法:AlCl3+NH3
 AlN+3HCl
AlN+3HCl(4)方法②比方法①在生产上更具优势。下列说法中,正确的是
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】 是重要的化工原料,某化学小组探究不同的钾盐对
是重要的化工原料,某化学小组探究不同的钾盐对 水解平衡的影响是否相同。
水解平衡的影响是否相同。
实验Ⅰ:配制250mL 1mol/L的 溶液,测得其pH为1.62。
溶液,测得其pH为1.62。
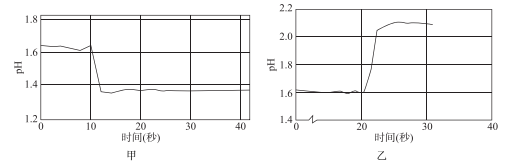
实验Ⅱ:常温下,用滴定管准确量取50.00mL的 溶液置于烧杯中,加入0.10mol的KCl固体,利用数字化仪器测得溶液pH与时间的关系如图甲所示。
溶液置于烧杯中,加入0.10mol的KCl固体,利用数字化仪器测得溶液pH与时间的关系如图甲所示。
实验Ⅲ:常温下,用滴定管准确量取50.00mL的 溶液置于烧杯中,加入0.05mol的
溶液置于烧杯中,加入0.05mol的 固体,利用数字化仪器测得溶液pH与时间的关系如图乙所示。
固体,利用数字化仪器测得溶液pH与时间的关系如图乙所示。
已知:
①常温下, 的第一步电离为完全电离,第二步电离为不完全电离且
的第一步电离为完全电离,第二步电离为不完全电离且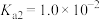 。
。
②在强酸弱碱盐溶液中加入强电解质,溶液中的离子总浓度增大,离子之间的相互牵制作用增强,易水解的阳离子的活性会增强。
回答下列问题:
(1)实验Ⅰ中配制的 溶液呈黄色,查阅资料得知是因为生成了少量的
溶液呈黄色,查阅资料得知是因为生成了少量的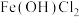 ,生成该物质的化学方程式为
,生成该物质的化学方程式为_________ 。
(2)实验Ⅱ和实验Ⅲ中量取 溶液时应选用
溶液时应选用_________ (填“酸式”或“碱式”)滴定管。
(3)常温下, 溶液中的下列关系错误的是_________(填序号)。
溶液中的下列关系错误的是_________(填序号)。
(4)实验Ⅱ和实验Ⅲ中,加入KCl固体和 固体的物质的量之比为2:1的原因为
固体的物质的量之比为2:1的原因为_________ 。
(5)图甲中10s后溶液的pH下降的主要原因为_________ 。图乙中20s后溶液pH增大的主要原因为_________ (从平衡角度进行分析)。
 是重要的化工原料,某化学小组探究不同的钾盐对
是重要的化工原料,某化学小组探究不同的钾盐对 水解平衡的影响是否相同。
水解平衡的影响是否相同。实验Ⅰ:配制250mL 1mol/L的
 溶液,测得其pH为1.62。
溶液,测得其pH为1.62。实验Ⅱ:常温下,用滴定管准确量取50.00mL的
 溶液置于烧杯中,加入0.10mol的KCl固体,利用数字化仪器测得溶液pH与时间的关系如图甲所示。
溶液置于烧杯中,加入0.10mol的KCl固体,利用数字化仪器测得溶液pH与时间的关系如图甲所示。实验Ⅲ:常温下,用滴定管准确量取50.00mL的
 溶液置于烧杯中,加入0.05mol的
溶液置于烧杯中,加入0.05mol的 固体,利用数字化仪器测得溶液pH与时间的关系如图乙所示。
固体,利用数字化仪器测得溶液pH与时间的关系如图乙所示。
已知:
①常温下,
 的第一步电离为完全电离,第二步电离为不完全电离且
的第一步电离为完全电离,第二步电离为不完全电离且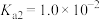 。
。②在强酸弱碱盐溶液中加入强电解质,溶液中的离子总浓度增大,离子之间的相互牵制作用增强,易水解的阳离子的活性会增强。
回答下列问题:
(1)实验Ⅰ中配制的
 溶液呈黄色,查阅资料得知是因为生成了少量的
溶液呈黄色,查阅资料得知是因为生成了少量的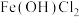 ,生成该物质的化学方程式为
,生成该物质的化学方程式为(2)实验Ⅱ和实验Ⅲ中量取
 溶液时应选用
溶液时应选用(3)常温下,
 溶液中的下列关系错误的是_________(填序号)。
溶液中的下列关系错误的是_________(填序号)。A.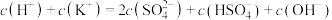 |
B.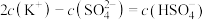 |
C. 的平衡常数 的平衡常数 |
D. |
 固体的物质的量之比为2:1的原因为
固体的物质的量之比为2:1的原因为(5)图甲中10s后溶液的pH下降的主要原因为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】焦亚硫酸钠( )在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
)在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
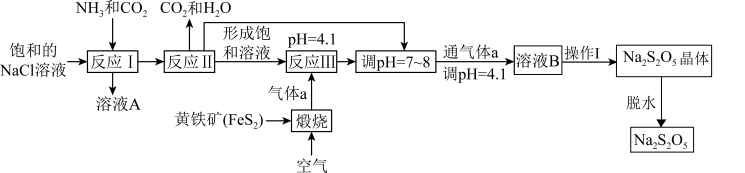
已知:① 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;
②焦亚硫酸钠 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。
回答下列问题:
(1)反应I中先通入气体___________ (填化学式),反应Ⅲ中通入的气体a为___________ (填化学式)。
(2)溶液A中含有三种阳离子,分别为 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是___________ 。
(3)反应Ⅲ调节pH为4.1,发生反应的离子方程式为___________ 。
(4)再次通入气体a得到溶液B的目的是___________ 。
 )在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
)在医药、橡胶、印染、食品等方面应用广泛,其制备流程如图所示。
已知:①
 过饱和溶液中更易形成
过饱和溶液中更易形成 ;
;②焦亚硫酸钠
 在空气中易氧化,受热易分解。
在空气中易氧化,受热易分解。回答下列问题:
(1)反应I中先通入气体
(2)溶液A中含有三种阳离子,分别为
 、
、 和离子X。检验溶液A中离子X的方法是
和离子X。检验溶液A中离子X的方法是(3)反应Ⅲ调节pH为4.1,发生反应的离子方程式为
(4)再次通入气体a得到溶液B的目的是
您最近一年使用:0次
【推荐3】锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
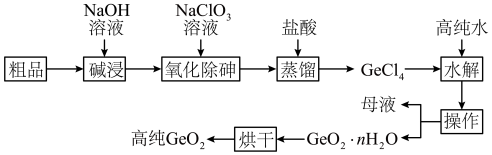
已知:①“碱浸”过程中的反应为GeO2+2NaOH=Na2GeO3+H2O As2O3+2NaOH=2NaAsO2+H2O
②“蒸馏”过程中的反应为Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
③GeCl4的熔点为-49. 5 ℃,AsCl3与GeCl4的沸点分别为130.2 ℃、84 ℃。
(1)锗的原子序数为32,锗在元素周期表中的位置为第___________ 周期___________ 族。
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的化学方程式为___________ 。
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是___________ 。
(4)“水解”操作时发生的化学反应方程式为___________ ,“水解”操作时保持较低温度有利于提高产率,其可能的原因是___________ (答一条即可)。
(5)若1 t二氧化锗粗品(含杂质30%)经提纯得0.745 t的高纯二氧化锗产品,则杂质脱除率为___________ 。

已知:①“碱浸”过程中的反应为GeO2+2NaOH=Na2GeO3+H2O As2O3+2NaOH=2NaAsO2+H2O
②“蒸馏”过程中的反应为Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
③GeCl4的熔点为-49. 5 ℃,AsCl3与GeCl4的沸点分别为130.2 ℃、84 ℃。
(1)锗的原子序数为32,锗在元素周期表中的位置为第
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的化学方程式为
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是
(4)“水解”操作时发生的化学反应方程式为
(5)若1 t二氧化锗粗品(含杂质30%)经提纯得0.745 t的高纯二氧化锗产品,则杂质脱除率为
您最近一年使用:0次
【推荐1】2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的核外电子排布式为_______ ,其中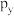 原子轨道上的电子数为
原子轨道上的电子数为_______ 个。
(2) 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为_______ ; 含有
含有_______ 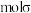 键;
键;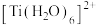 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是_______ ; 中
中 的化合价是
的化合价是_______ ; 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是_______ 。

(1)基态钛原子的核外电子排布式为
 原子轨道上的电子数为
原子轨道上的电子数为(2)
 的配合物有多种。在
的配合物有多种。在 和
和 三种微粒的配体中,所含原子电负性由大到小的排序为
三种微粒的配体中,所含原子电负性由大到小的排序为 含有
含有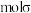 键;
键;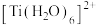 的配体中提供孤电子对的原子是
的配体中提供孤电子对的原子是 中
中 的化合价是
的化合价是 的球棍结构如图,
的球棍结构如图, 的配位数是
的配位数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮元素可以形成多种化合物,回答以下问题;
(1)基态氮原子的轨道表示式是___________ 。
(2)肼( )分子可视为
)分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。
①写出与 分子互为等电子体的一种离于的化学式
分子互为等电子体的一种离于的化学式___________ 。
②肼( )是
)是___________ 分子(填极性分子或非极性分子)。
③肼可用作火箭燃料,燃烧时发生的反应是: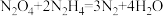
若该反应中有4mol N-H键断裂,则形成的 键有
键有___________ mol。
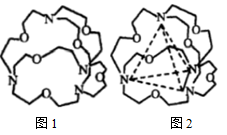
(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是___________ (填标号)。
a. b.
b. c.
c. d.
d.
(1)基态氮原子的轨道表示式是
(2)肼(
 )分子可视为
)分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。
(氨基)取代形成的另一种氮的氢化物。①写出与
 分子互为等电子体的一种离于的化学式
分子互为等电子体的一种离于的化学式②肼(
 )是
)是③肼可用作火箭燃料,燃烧时发生的反应是:
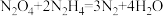
若该反应中有4mol N-H键断裂,则形成的
 键有
键有(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴、镍都属于第VIII族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_______________________________ 。
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是____________ 。(已知 的结构式为
的结构式为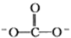 )
)
②NaNT可以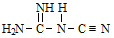 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1mol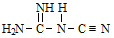 中含有σ键的物质的量为
中含有σ键的物质的量为___________ 。
③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_________________ 。
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为________ 。晶胞中离1个Mn原子最近的Ni原子有________ 个。
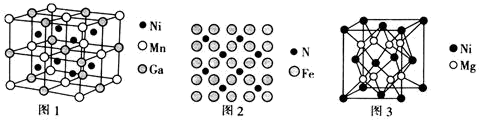
(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为________ 。
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________ g/cm3(列出计算表达式,NA表示阿伏加 德罗常数的数值).
(1)结合电子排布式分析Fe3+比Co3+氧化性弱的原因:
(2)BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①CTCN的化学式为[Co(NH3)4CO3]NO3,与Co3+形成配位键的原子是
 的结构式为
的结构式为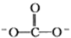 )
)②NaNT可以
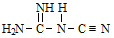 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为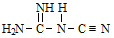 中含有σ键的物质的量为
中含有σ键的物质的量为③[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为
(3)一种新型的功能材料的晶胞结构如图1所示,它的化学式可表示为

(4)铁触媒是合成氨反应的催化剂,其表面存在氮原子。氮原子在铁表面上的单层附着,局部示意图如图2所示。则铁表面上氮原子与铁原子的数目比为
(5)镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图3所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】H2S广泛存在于许多燃气和工业废气中,脱除其中的H2S既可回收硫又可防止产生污染。回答下列问题:
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为_______ ;
②已知H2S、H2CO3的电离常数如下表所示:
纯碱溶液吸收H2S的离子方程式为______________ 。
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=_______ kJ/mol。
(3)H2S分解反应2H2S(g) 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:

①该反应的△H_______ (填“>”或“<”)0。
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是___________ ;在约1100 °C时,有无Al2O3催化,其转化率几乎相等,是因为___________ 。
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=______ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数,列出含p的代数式)。
(1)Tretford氧化法脱H2S,包括H2S的吸收、氧化析硫、焦钒酸钠的氧化等。
①焦钒酸钠的化学式为Na2V4O9,其中钒元素的化合价为
②已知H2S、H2CO3的电离常数如下表所示:
| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1.1×10-12 |
| H2CO3 | 4.3×10-7 | 5.61×10-11 |
纯碱溶液吸收H2S的离子方程式为
(2)Claus氧化回收硫的反应原理为:2H2S(g)+O2(g)=2S(g)+2H2O(g) △H1
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H2=-1124 kJ/mol
2H2S(g) +SO2(g)=S(g) +2H2O(g) △H3=- 233 kJ/mol
则△H1=
(3)H2S分解反应2H2S(g)
 2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
2H2(g)+S2(g)在无催化剂及Al2O3催化下,H2S在反应器中不同温度时反应,每间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
①该反应的△H
②在不加催化剂时,温度越高H2S的转化率越接近平衡时的转化率,原因是
③若起始时在恒容密闭容器中只充入H2S,在A点达到平衡时,若此时气体总压强为p,则此温度反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】常温下,几种酸或碱的电离常数如表所示。
回答下列问题:
(1)下列酸的酸性最强的是_____(填字母)。
(2)甲胺是一元弱碱,在水中电离方程式为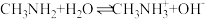 ,乙胺(H2NCH2CH2NH2)的第二步电离方程式为
,乙胺(H2NCH2CH2NH2)的第二步电离方程式为___________ 。
(3)已知: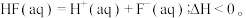
①对0.1mol/LHF溶液适当加热,HF的电离程度___________ (填“增大”“减小”或“不变”)。向HF溶液中滴加烧碱溶液,当c(HF)=10c(F-)时,c(H+)=_________ mol/L。
②如果用HF溶液替代盐酸测定中和反应热,测得ΔH会________ (填字母)。
A.偏高 B.偏低 C.无影响
(4)在KCN溶液中通入少量CO2离子方程式为________ 。
(5)次磷酸是一元酸,30mL0.1mol/LNaOH溶液和___________ mL0.1mol·L-1 溶液恰好完全反应。
溶液恰好完全反应。
(6)H2CO3的Ka1大于Ka2,其原因是___________ (从平衡移动角度分析)。
| 酸或碱 | HCN | H2CO3 | H3PO2(次磷酸) | HF | CH3NH2(甲胺) |
| Ka或Kb | 6.2×10-10 | 4.5×10-7、4.7×10-11 | 5.9×10-2 | 6.3×10-4 | 4.2×10-4 |
(1)下列酸的酸性最强的是_____(填字母)。
| A.HCN | B.H2CO3 | C.H3PO2 | D.HF |
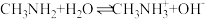 ,乙胺(H2NCH2CH2NH2)的第二步电离方程式为
,乙胺(H2NCH2CH2NH2)的第二步电离方程式为(3)已知:
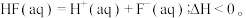
①对0.1mol/LHF溶液适当加热,HF的电离程度
②如果用HF溶液替代盐酸测定中和反应热,测得ΔH会
A.偏高 B.偏低 C.无影响
(4)在KCN溶液中通入少量CO2离子方程式为
(5)次磷酸是一元酸,30mL0.1mol/LNaOH溶液和
 溶液恰好完全反应。
溶液恰好完全反应。(6)H2CO3的Ka1大于Ka2,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO 占95%。写出CO2溶于水产生HCO
占95%。写出CO2溶于水产生HCO 的方程式:
的方程式:___________ 。
(2)25℃时,已知不同pH条件下,水溶液中碳元素的存在形态如图所示。
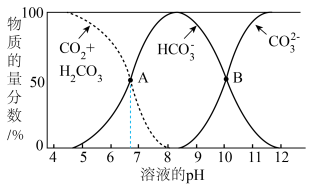
①下列说法错误的是___________ (填字母)。
A.pH=8时,溶液中含碳元素的微粒主要是HCO
B.H2CO3:Ka1的数量积为10-7
C.当c(HCO )=c(CO
)=c(CO )时,c(H+)>c(OH-)
)时,c(H+)>c(OH-)
②向上述pH=9.0的水溶液中加入NaOH溶液时发生反应的离子方程式是___________ 。
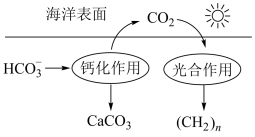
(3)在海洋碳循环中,通过下图所示的途径固碳。钙化反应的离子方程式为___________ 。
(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①a室的电极反应式为___________ 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是___________ 。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO
 占95%。写出CO2溶于水产生HCO
占95%。写出CO2溶于水产生HCO 的方程式:
的方程式:(2)25℃时,已知不同pH条件下,水溶液中碳元素的存在形态如图所示。

①下列说法错误的是
A.pH=8时,溶液中含碳元素的微粒主要是HCO

B.H2CO3:Ka1的数量积为10-7
C.当c(HCO
 )=c(CO
)=c(CO )时,c(H+)>c(OH-)
)时,c(H+)>c(OH-)②向上述pH=9.0的水溶液中加入NaOH溶液时发生反应的离子方程式是
(3)在海洋碳循环中,通过下图所示的途径固碳。钙化反应的离子方程式为

(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①a室的电极反应式为
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是
您最近一年使用:0次



