我国力争于2030年前做到碳达峰,2060年前实现碳中和,因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。在一定催化剂催化作用下CO2加氢合成甲酸发生反应如下:CO2(g)+H2(g) HCOOH(g) ΔH1=-30.9kJ/mol
HCOOH(g) ΔH1=-30.9kJ/mol
(1)温度为T1℃时,该反应平衡常数K=2,将等物质的量的CO2和H2充入体积为1L的密闭容器中,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___________ k正。
(2)当温度改变为T2℃时,k正=1.9 k逆,则T2℃时平衡压强______ (填“>”“<”或“=”) T1℃时平衡压强。
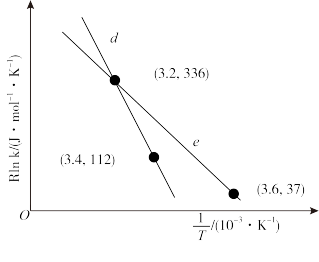
(3)该反应的 Arrhenius经验公式的实验数据如图中的曲线d所示,已知 Arrhenius经验公式为Rlnk=- +C(Ea为活化能,k为速率常数,R和C为常数),则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数),则该反应的活化能Ea=___________ kJ/mol。改变外界条件,实验数据如图中的曲e所示,则实验可能改变的外界条件是___________ 。
 HCOOH(g) ΔH1=-30.9kJ/mol
HCOOH(g) ΔH1=-30.9kJ/mol(1)温度为T1℃时,该反应平衡常数K=2,将等物质的量的CO2和H2充入体积为1L的密闭容器中,实验测得:v正=k正·c(CO2)·c(H2),v逆=k逆·c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=
(2)当温度改变为T2℃时,k正=1.9 k逆,则T2℃时平衡压强
(3)该反应的 Arrhenius经验公式的实验数据如图中的曲线d所示,已知 Arrhenius经验公式为Rlnk=-
 +C(Ea为活化能,k为速率常数,R和C为常数),则该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数),则该反应的活化能Ea=
更新时间:2022-03-25 17:23:25
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】填空
(1)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca( ),富氧区反应速率方程v=k∙c(
),富氧区反应速率方程v=k∙c( )∙c(O2),k为常数。
)∙c(O2),k为常数。
①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c( )与速率数值关系如下表所示,则a=
)与速率数值关系如下表所示,则a=______ 。
②由富氧区速率方程v=k∙c( )∙c(O2),当其他条件不变时,
)∙c(O2),当其他条件不变时, 、O2的浓度分别增大为原来的2倍,反应速率为原来的
、O2的浓度分别增大为原来的2倍,反应速率为原来的______ 倍。
(2)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln(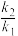 )=
)= ,R为常数,则Ea(富氧区)
,R为常数,则Ea(富氧区)______ (填“>”或“<”)Ea(贫氧区)。
(1)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k∙ca(
 ),富氧区反应速率方程v=k∙c(
),富氧区反应速率方程v=k∙c( )∙c(O2),k为常数。
)∙c(O2),k为常数。①当溶解氧浓度为4.0mg/L,此时Na2SO3的氧化位于贫氧区时,c(
 )与速率数值关系如下表所示,则a=
)与速率数值关系如下表所示,则a=| c(SO32-)×10-3 | 3.65 | 5.65 | 7.3 | 11.65 |
| V×106 | 10.2 | 24.5 | 40.8 | 104.4 |
 )∙c(O2),当其他条件不变时,
)∙c(O2),当其他条件不变时, 、O2的浓度分别增大为原来的2倍,反应速率为原来的
、O2的浓度分别增大为原来的2倍,反应速率为原来的(2)两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知ln(
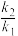 )=
)= ,R为常数,则Ea(富氧区)
,R为常数,则Ea(富氧区)| 反应阶段 | 速率方程 | k(297.9K)/k(291.5K) |
| 富氧区 | v=k∙c( )∙c(O2) )∙c(O2) | 1.47 |
| 贫氧区 | v=k∙ca( )∙cb(O2) )∙cb(O2) | 2.59 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g) ΔH>0。已知该反应在2404 ℃时的平衡常数K=6.4×10-3。
2NO(g) ΔH>0。已知该反应在2404 ℃时的平衡常数K=6.4×10-3。
请回答下列问题。
(1)该温度下,向2 L密闭容器中充入N2和O2各1 mol,平衡时N2的转化率是___________ %(保留整数)。
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol∙L-1、4.0×10-2 mol∙L-1、3.0×10-3 mol∙L-1,此时反应___________ (填“处于化学平衡状态”“正向进行”或“逆向进行”)。
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是___________ 。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2, 达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数___________ (填“变大”“变小”或“不变”)。
(5)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH___________ 0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=___________ eV,写出该步骤的化学方程式___________ 。
 2NO(g) ΔH>0。已知该反应在2404 ℃时的平衡常数K=6.4×10-3。
2NO(g) ΔH>0。已知该反应在2404 ℃时的平衡常数K=6.4×10-3。请回答下列问题。
(1)该温度下,向2 L密闭容器中充入N2和O2各1 mol,平衡时N2的转化率是
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol∙L-1、4.0×10-2 mol∙L-1、3.0×10-3 mol∙L-1,此时反应
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2, 达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数
(5)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

可知水煤气变换的ΔH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖。回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ ”表示。
”表示。

上述历程中反应速率最慢的步骤的化学方程式为_______ 。由图得出合成氨反应 的
的
 ,又已知:
,又已知: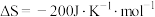 ,则合成氨反应在常温
,则合成氨反应在常温 下
下_______ (填“能”或“不能”)自发。
(2)_______ 温(填“高”或“低”,下同)有利于提高反应速率,_______ 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400C~500℃。
针对反应速率与平衡产率的矛盾,我国科学家提出了如下解决方案。
(3)方案: 复合催化剂。
复合催化剂。


下列说法正确的是_______ 。
A.300℃时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为: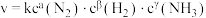 ,其中
,其中 为速率常数,根据表中数据,
为速率常数,根据表中数据,
_______ 。
在合成氨过程中,需要不断分离出氨的原因为_______ 。
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“
 ”表示。
”表示。
上述历程中反应速率最慢的步骤的化学方程式为
 的
的
 ,又已知:
,又已知: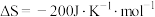 ,则合成氨反应在常温
,则合成氨反应在常温 下
下(2)
针对反应速率与平衡产率的矛盾,我国科学家提出了如下解决方案。
(3)方案:
 复合催化剂。
复合催化剂。

下列说法正确的是
A.300℃时,复合催化剂比单一催化剂效率更高
B.同温同压下,复合催化剂有利于提高氨的平衡产率
C.温度越高,复合催化剂活性一定越高
(4)某合成氨速率方程为:
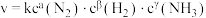 ,其中
,其中 为速率常数,根据表中数据,
为速率常数,根据表中数据,
| 实验 | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 | v/mol·L-1·s-1 |
| 1 | m | n | p | q |
| 2 | 2m | n | p | 2q |
| 3 | m | n | 0.1p | 10q |
| 4 | m | 2n | p | 2.828q |
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明: 为二元弱酸,其水溶液无色)
为二元弱酸,其水溶液无色)
(1)已知酸性 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: ,该反应中每转移
,该反应中每转移 电子,产生的
电子,产生的 在标况下的体积为
在标况下的体积为___________ 。
(2)其表格中
___________ 、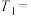
___________ ;通过实验___________ (只填a、b、c实验序号中的2个)可探究出温度变化对化学反应速率的影响,其表格中
___________ 。
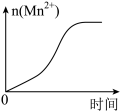
(3)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是___________ ;忽略溶液体积的变化,利用实验b中数据计算, 内,用
内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
___________ 。
(4)该小组的一位同学通过查阅资料发现,上述实验过程中 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是___________ 。
 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:(说明: 为二元弱酸,其水溶液无色)
为二元弱酸,其水溶液无色)| 实验 序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无 色所需时间/s | ||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
 |  |  |  |  | |||
| a | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| b |  | 2 | 0.02 | 3 | 0.1 |  | 8 |
| c | 313 | 2 | 0.02 |  | 0.1 | 1 |  |
 溶液与
溶液与 溶液反应的离子方程式为:
溶液反应的离子方程式为: ,该反应中每转移
,该反应中每转移 电子,产生的
电子,产生的 在标况下的体积为
在标况下的体积为(2)其表格中

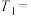

(3)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 内,用
内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(4)该小组的一位同学通过查阅资料发现,上述实验过程中
 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】丙烷氧化脱氢法制备丙烯的主要反应如下: ,在催化剂作用下,
,在催化剂作用下, 氧化脱氢除生成
氧化脱氢除生成 外,还生成
外,还生成 等物质。
等物质。 的转化率和
的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。

(1)图中 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是_______ 。
(2)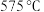 时,
时, 的选择性为
的选择性为_______ 。(结果保留3位有效数字, 的选择性
的选择性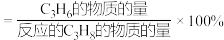 )
)
(3)基于本研究结果,能提高 选择性的措施是
选择性的措施是_______ 。
 ,在催化剂作用下,
,在催化剂作用下, 氧化脱氢除生成
氧化脱氢除生成 外,还生成
外,还生成 等物质。
等物质。 的转化率和
的转化率和 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
(1)图中
 的转化率随温度升高而上升的原因是
的转化率随温度升高而上升的原因是(2)
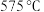 时,
时, 的选择性为
的选择性为 的选择性
的选择性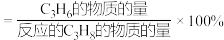 )
)(3)基于本研究结果,能提高
 选择性的措施是
选择性的措施是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】过氧化氢(H2O2)的水溶液俗称双氧水。双氧水常被称为化学反应中的“绿色试剂”。已知,在含少量I-的溶液中,H2O2会较快分解,反应如下:反应①:H2O2+I- → H2O+IO-; 反应②:H2O2+IO- → H2O+O2+I-,完成下列填空:
(1)反应①中的氧化产物是_________ ,被还原的元素是___________ 。
(2)标出反应②中电子转移的方向和数目。_______________
(3)H2O2分解过程中,I-的作用是__________ 。
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:________ ,双氧水可漂白纤维织物,目前认为是其中过氧化氢离子(HOO-)的作用。为了增强其漂白效果,应选择在____ (填“酸”、“碱”或“中”)性条件下进行。
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:_____________ 。
(1)反应①中的氧化产物是
(2)标出反应②中电子转移的方向和数目。
(3)H2O2分解过程中,I-的作用是
(4)根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
(5)H2O2是一种二元弱酸,写出第一步电离的电离方程式:
(6)向盐酸酸化的FeCl2溶液中加入双氧水,溶液由浅绿色变为棕黄色,写出该变化的化学反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】现有反应mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
(1)该反应的逆反应是________ 热反应,且m+n______ (填“>”“<”或“=”)p。
(2)减压时,A的质量分数________ (填“增大”“减小”或“不变”,下同)。
(3)若加入B(体积不变),则A的转化率________ ,B的转化率________ 。
(4)若升高温度,则平衡时,B、C的浓度之比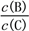 将
将________ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则(1)该反应的逆反应是
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时,B、C的浓度之比
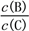 将
将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图表示298K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答下列问题:

(1)若反应中生成2mol氨,则反应____ (填“吸热”或“放热”)____ kJ。
(2)图中曲线____ (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是_____ 。
(3)合成氨反应中平衡混合物中氨的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是_____ (填字母)。


(1)若反应中生成2mol氨,则反应
(2)图中曲线
(3)合成氨反应中平衡混合物中氨的体积分数与压强、温度的关系如图所示。若曲线a对应的温度为500℃,则曲线b对应的温度可能是

| A.600℃ | B.550℃ | C.500℃ | D.450℃ |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某化学反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为___________ mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=___________ mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3___________ v1(填“>”“=”或“<”=,且C3___________ 1.0mol·L-1(填“>”“=”或“<”=)。
(4)比较实验4和实验1,可推测该反应是___________ 反应(选填“吸热”或“放热”),理由是___________ 。
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】可逆反应3A(g) 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①___ ;
b.若B、C都不是气体,气体的平均相对分子质量②____ ;
c.若B是气体,C不是气体,气体的平均相对分子质量③___ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④___ 态,C是⑤___ 态。
 3B(?)+C(?) △H>0达到化学平衡后,
3B(?)+C(?) △H>0达到化学平衡后,(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①
b.若B、C都不是气体,气体的平均相对分子质量②
c.若B是气体,C不是气体,气体的平均相对分子质量③
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】自然界的矿物,岩石的成因和变化受到许多条件的影响。地壳内每增加1 km,压强增大约25000~30000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)⇌SiF4(g)+ 2H2O(g)。
(1)写出SiF4的结构式:________ 。
(2)以上反应在地壳的那个区域先达平衡________ (选填编号,下同)。
a.地壳表层 b.地壳深层
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________ 。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2 的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0 L,反应时间 8.0 min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为_______ 。
(1)写出SiF4的结构式:
(2)以上反应在地壳的那个区域先达平衡
a.地壳表层 b.地壳深层
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2 的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0 L,反应时间 8.0 min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在某温度时,A+B⇌2C反应达到平衡。
(1)如果B为气态,增加体系的压强时,B的含量增加,则A为______ 态或______ 态,C为______ 态。
(2)如果升高温度,C的平衡浓度增大,则正反应方向是______ 热反应。
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
H2O2(l)= H2O(l)+ 1/2O2(g) ΔH=-98.23kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______ 。
(1)如果B为气态,增加体系的压强时,B的含量增加,则A为
(2)如果升高温度,C的平衡浓度增大,则正反应方向是
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+=Cu2+(aq)+H2(g) ΔH=+64.39 kJ·mol-1
H2O2(l)= H2O(l)+ 1/2O2(g) ΔH=-98.23kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
您最近一年使用:0次



