电离平衡常数有重要的功能,下列推测不合理的是
| 化学式 | H2CO3 | HCN | HF |
| 电离平衡常数(K) | Ka1=4.5×10-7 Ka2=4.7×10-11 | 6.2×10-10 | 6.8×10-4 |
A.电离出H+的能力:HF>H2CO3>HCN> |
| B.相同物质的量浓度溶液的pH:NaF<NaHCO3<NaCN |
| C.HCN和HF均能与Na2CO3溶液发生反应 |
D.CO2通入NaCN溶液中:CO2+2CN-+H2O=2HCN+ |
更新时间:2022-04-29 09:29:24
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】室温下,对于0.01 mol·L-1的氨水,下列判断正确的是
| A.用HNO3溶液恰好完全中和,溶液不显中性 |
| B.加水稀释后,溶液中c(OH-)变大 |
| C.与AlCl3溶液发生反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| D.该溶液的pH=12 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列电离方程式的书写正确的是
A.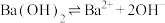 |
B.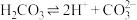 |
C.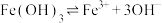 |
D.水溶液中 的电离: 的电离: |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知常温下,几种物质的电离平衡常数,下列反应的离子方程式合理的是
| 弱酸 | 甲酸(HCOOH) |  |  | HClO |
 |  |   |  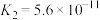 | 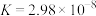 |
A.次氯酸钠溶液中通入少量二氧化碳: |
B.次氯酸钠溶液中通入少量二氧化硫: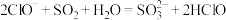 |
C.碳酸钠溶液中通入少量 : : |
D.纯碱溶液中滴加少量甲酸: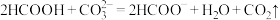 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列溶液中微粒的物质的量浓度关系正确的是
| A.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
B.等浓度等体积的碳酸钠、碳酸氢钠溶液混合后:c(CO )<c(HCO )<c(HCO ) ) |
| C.在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-) |
D.Na2CO3溶液中:2c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】已知25℃时二元弱酸H2A,下列说法不正确的是
| A.在等浓度的Na2A、NaHA溶液中,pH前者大于后者 |
| B.向0.1mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,若H2A的电离度为0.01%,则Ka1≈10-7 |
| C.向H2A溶液中加入NaOH溶液至中性,则c(A2-)>c(HA-) |
| D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100mL,则该溶液pH<a+1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列化学事实对应的原理或解释正确的是
| 化学事实 | 原理或解释 | |
| A | 焦炭在高温下与石英砂反应制备粗硅 | 非金属性:C>Si |
| B | 向NaAlO2溶液中滴加NaHCO3溶液,有白色沉淀生成 |  与 与 均发生水解反应并相互促进 均发生水解反应并相互促进 |
| C | 将浓硫酸加入蔗糖中,蔗糖变黑,放出大量热,生成有刺激性气味的气体 | 浓硫酸具有脱水性、强氧化性 |
| D | 将1 mL0.1 mol/L KI溶液与5 mL0.1 mol/L FeCl3溶液混合,再滴加KSCN溶液,溶液变为红色 | FeCl3与KI的反应有一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温下,下列实验方案能达到实验目的的是
| 选项 | 实验方案 | 实验目的 |
| A | 将1—溴丁烷与NaOH的乙醇溶液混合后加热,将生成的气体通入溴水中,观察溶液颜色变化 | 1—溴丁烷发生消去反应生成烯烃 |
| B | 用铂丝蘸取某溶液进行焰色试验,观察火焰颜色 | 溶液中存在 |
| C | 将中间裹有锌皮的铁钉(如图 )放在滴有酚酞的NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化 )放在滴有酚酞的NaCl溶液中,一段时间后观察铁钉周围溶液颜色变化 | 铁钉能发生吸氧腐蚀 |
| D | 用pH计分别测量 和HCOONa溶液的pH,比较溶液pH大小 和HCOONa溶液的pH,比较溶液pH大小 | 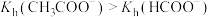 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



