 与烷烃耦合等很多反应均有利于减少空气中
与烷烃耦合等很多反应均有利于减少空气中 的含量,实现“碳达峰”“碳中和”的目标。
的含量,实现“碳达峰”“碳中和”的目标。Ⅰ.
 与
与 的耦合反应
的耦合反应已知反应:
①

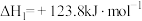
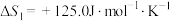
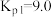
②
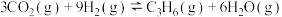
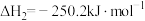
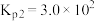
③

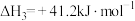
(1)
 与
与 耦合反应在
耦合反应在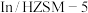 催化剂作用下的微观过程如下:
催化剂作用下的微观过程如下: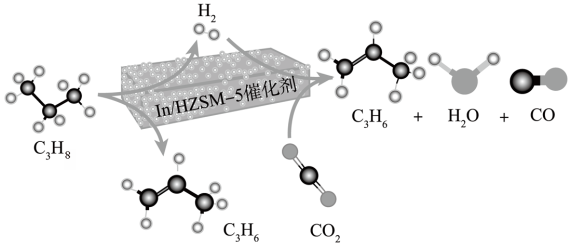
写出该过程的热化学方程式
(2)为提高丙烷与
 耦合过程中
耦合过程中 的产率,可采取的措施有
的产率,可采取的措施有a.恒容时充入惰性气体 b.增大
 的浓度 c.改善催化剂的性能
的浓度 c.改善催化剂的性能(3)在一定温度下,向恒容密闭容器中充入一定量的
 ,发生反应①,达到平衡时压强增大20%,则平衡时
,发生反应①,达到平衡时压强增大20%,则平衡时 的转化率为
的转化率为(4)
 与
与 耦合反应时发生另一反应:
耦合反应时发生另一反应: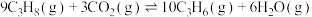 ,则该反应的平衡常数
,则该反应的平衡常数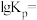
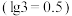 。
。Ⅱ.
 催化加氢制甲醇
催化加氢制甲醇已知反应:④

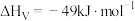
⑤

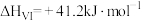
(5)不同条件下,相同的时间段内
 的选择性和产率随温度的变化如图。(
的选择性和产率随温度的变化如图。( 的选择性=
的选择性=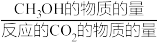 ×100%
×100%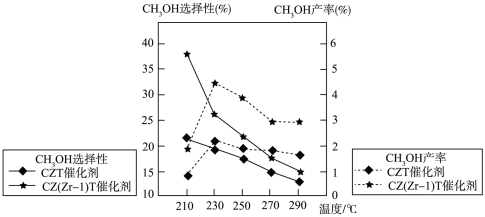
①由图可知,合成甲醇的适宜条件为
A.CZT催化剂 B.CZ(Zr-1)T催化剂 C.230℃ D.290℃
②在230℃以上,升高温度,
 的平衡转化率增大,但甲醇的产率降低,原因是
的平衡转化率增大,但甲醇的产率降低,原因是Ⅲ.利用电催化可将
 同时转化为多种燃料,装置如图:
同时转化为多种燃料,装置如图: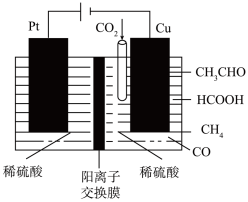
(6)其中铜电极上产生HCOOH的电极反应式为
更新时间:2022-05-31 23:47:36
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】利用如图所示装置测定中和热的实验步骤如下:
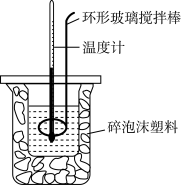
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是_________________________________________ 。
(2)使盐酸与NaOH溶液混合均匀的正确操作是_______ (填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________ (填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________ 。
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________ 。

①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是
(2)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ΔH1=-116kJ•mol-1。
(1)已知:CO(g)+ O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+
O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是___________。
CH3OH(g)的反应速率且利于反应正向进行的是___________。
(3)恒温条件下,可逆反应:CO(g)+2H2(g) CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ 。
A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
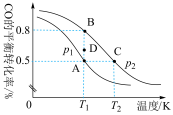
①A、B、C三点平衡常数KA、KB、KC的大小关系是___________ 。
②压强p1___________ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=___________ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正___________ v逆(填“>”“<”或“=”)。
(5)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是___________(填字母)。
(1)已知:CO(g)+
 O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+
O2(g)=CO2(g) ΔH2=-283kJ•mol-1,H2(g)+ O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
O2(g)=H2O(g) ΔH3=-242kJ•mol-1。则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为(2)下列措施中有利于增大反应:CO(g)+2H2(g)
 CH3OH(g)的反应速率且利于反应正向进行的是___________。
CH3OH(g)的反应速率且利于反应正向进行的是___________。| A.随时将CH3OH与反应混合物分离 |
| B.降低反应温度 |
| C.增大体系压强 |
| D.使用高效催化剂 |
(3)恒温条件下,可逆反应:CO(g)+2H2(g)
 CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
CH3OH(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成nmolCH3OH的同时生成2nmolH2
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.CO、H2、CH3OH浓度之比为1:2:1的状态
(4)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
①A、B、C三点平衡常数KA、KB、KC的大小关系是
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:v正
(5)在用浓硫酸配制稀硫酸过程中,下列操作中会造成稀硫酸溶液质量分数偏小的是___________(填字母)。
| A.在稀释时,未恢复至室温就转移入容量瓶 |
| B.在稀释过程中,有少量液体溅出 |
| C.在转移过程中,烧杯和玻璃棒没有进行洗涤 |
| D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线相平 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________ 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是____ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____ 。
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是____________ 。
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) 其平衡常数表达式为
CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________ 。
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为________ 。300 ℃时上述反应的平衡常数K=___________ 。200℃时该反应的平衡常数K=64.8,则该反应的△H_____ O (填“>”或“<”)。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)(1)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) 其平衡常数表达式为
CH4(g)+2H2O(g) 其平衡常数表达式为向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
① 2NO(g)+Cl2(g) 2ClNO(g) ΔH1<0 平衡常数为K1;
2ClNO(g) ΔH1<0 平衡常数为K1;
② 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________ 。ΔH3=__________ (用ΔH1、ΔH2表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应①达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=______ mol,NO的转化率α1=______ 。
②其他条件保持不变,反应②升高温度,平衡时NO2的转化率_____ ((填“增大”“减小”或“不变”),平衡常数K2______ (填“增大”“减小”或“不变”)。
① 2NO(g)+Cl2(g)
 2ClNO(g) ΔH1<0 平衡常数为K1;
2ClNO(g) ΔH1<0 平衡常数为K1;② 2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;(1)4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:(2)①为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应①达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=
②其他条件保持不变,反应②升高温度,平衡时NO2的转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
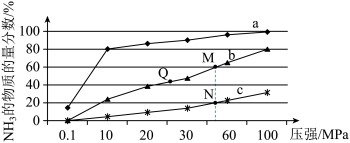
①曲线c对应的温度是_____ 。
②关于工业合成氨的反应,下列叙述正确的是_____ (填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______ 。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________ 。
②该反应的化学平衡常数表达式是_____ 。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____ 。
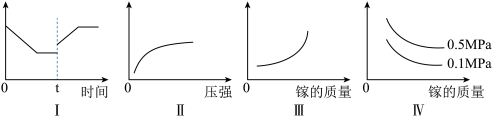
A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________ 。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____ 。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)
 2NH3(g) △H<0
2NH3(g) △H<0
①曲线c对应的温度是
②关于工业合成氨的反应,下列叙述正确的是
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是
②该反应的化学平衡常数表达式是
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是

A.I图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图象中纵坐标可以为镓的转化率
C.III图象中纵坐标可以为化学反应速率
D.Ⅳ图象中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】工业上制硫酸的主要反应之一为: ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
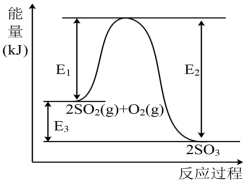
(1)向反应体系中加入催化剂后,图中
___________ (填“增大”、“减小”或“不变”,下同),
___________ 。
(2)已知:
 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(3)在接触室中,某温度下,反应的起始浓度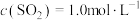 ,
,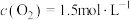 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为___________ 。
(4)在 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=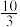 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时向
,则反应开始时向___________ (填“正反应方向”或“逆反应方向”)进行,正反应速率___________ (填“>”、“=”或“<”)逆反应速率。
(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是___________。(填字母)
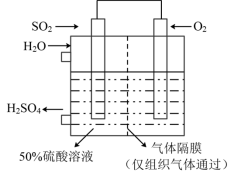
(6)若以如图所示装置生产硫酸,将 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为___________ 。
 ,反应过程中能量的变化如下图所示。
,反应过程中能量的变化如下图所示。
(1)向反应体系中加入催化剂后,图中


(2)已知:

 ;
;
 ;若
;若 与
与 反应产生
反应产生 和
和 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(3)在接触室中,某温度下,反应的起始浓度
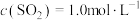 ,
,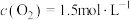 ,达到平衡后,
,达到平衡后, 的转化率为50%,则此温度下该反应的平衡常数K的数值为
的转化率为50%,则此温度下该反应的平衡常数K的数值为(4)在
 温度时,该反应的平衡常数K=
温度时,该反应的平衡常数K=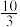 ,若在此温度下,向1L的恒容密闭容器中,充入0.03mol
,若在此温度下,向1L的恒容密闭容器中,充入0.03mol 、0.16mol
、0.16mol ,和0.03mol
,和0.03mol ,则反应开始时向
,则反应开始时向(5)恒温恒容条件下,下列叙述能证明该反应已达化学平衡状态的是___________。(填字母)
A. 的体积分数不再发生变化 的体积分数不再发生变化 |
| B.恒容时,容器内压强不再发生变化 |
| C.容器内,气体原子总数不再发生变化 |
D.相同时间内消耗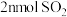 的同时生成 的同时生成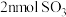 |
 、
、 以一定压强喷到活性电极上反应。负极的电极反应式为
以一定压强喷到活性电极上反应。负极的电极反应式为
您最近一年使用:0次
【推荐1】Ⅰ.二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ· mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如上图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ· mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如上图所示。
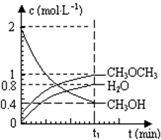
(1)该条件下反应平衡常数表达式K=_________________________ ;在t1℃时,反应的平衡常数为________ ,达到平衡时n(CH3OCH3) ∶n(CH3OH) ∶n(H2O)=_____________________ 。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正________ v逆(填“>”、“<”或“=”),反应向______ 反应方向进行(填“正”或“逆”)。
Ⅱ.已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为____________ 。
(2)若反应温度升高,M的转化率__________ (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a=____________ 。
 CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ· mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如上图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ· mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如上图所示。
(1)该条件下反应平衡常数表达式K=
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正
Ⅱ.已知可逆反应:M(g)+N(g)
 P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1。达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,M的转化率
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】萨巴蒂尔(Sabatier)反应是将 和
和 在一定温度和压强下发生反应:
在一定温度和压强下发生反应: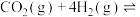
 。研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和
。研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和 选择性。请回答:
选择性。请回答:
(1)经计算,萨巴蒂尔反应在催化剂表面的反应历程如下图所示,其中“*”表示该粒子吸附在催化剂表面。
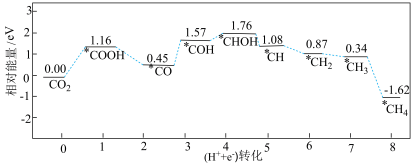
①该历程中, 最大的一步为
最大的一步为_______ (用方程式表示)。
②萨巴蒂尔反应在_______ (选填“高温”或“低温”)下能自发进行。
③速率与活化能关系可用Arrhenius经验公式表示: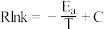 (
( 为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是
为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是_______ 。
(2)将 、
、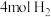 加入总压为p的恒温恒压容器中,达到平衡后,
加入总压为p的恒温恒压容器中,达到平衡后, 转化率为x,则萨巴蒂尔反应的平衡常数
转化率为x,则萨巴蒂尔反应的平衡常数
_______ (气相反应,用组分B的平衡压强p(B)代替物质的量浓度c(B)表示的平衡常数,记作 ,如
,如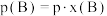 ,p为平衡总压强,x(B)为平衡时B的物质的量分数)。
,p为平衡总压强,x(B)为平衡时B的物质的量分数)。
(3)采取下列措施可提高萨巴蒂尔反应中 平衡转化率的是_______(选填序号)。
平衡转化率的是_______(选填序号)。
(4)下列关于萨巴蒂尔反应的说法中,正确的是_______(选填序号)。
(5)载人宇宙飞船中 再生分两步完成,萨巴蒂尔反应是第一步,第二步在太阳能电池作用下完成。请在下图中画出
再生分两步完成,萨巴蒂尔反应是第一步,第二步在太阳能电池作用下完成。请在下图中画出 再生过程的能量变化,要标注出相应的物质
再生过程的能量变化,要标注出相应的物质_______ 。

 和
和 在一定温度和压强下发生反应:
在一定温度和压强下发生反应: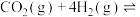
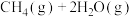
 。研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和
。研究标明,纳米铜线催化剂代替传统铜质催化剂可提高反应速率和 选择性。请回答:
选择性。请回答:(1)经计算,萨巴蒂尔反应在催化剂表面的反应历程如下图所示,其中“*”表示该粒子吸附在催化剂表面。

①该历程中,
 最大的一步为
最大的一步为②萨巴蒂尔反应在
③速率与活化能关系可用Arrhenius经验公式表示:
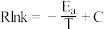 (
( 为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是
为活化能,k为速率常数,R和C为常数)。用纳米铜线时的变化曲线为图中曲线a,则传统铜质催化剂的变化曲线是
(2)将
 、
、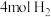 加入总压为p的恒温恒压容器中,达到平衡后,
加入总压为p的恒温恒压容器中,达到平衡后, 转化率为x,则萨巴蒂尔反应的平衡常数
转化率为x,则萨巴蒂尔反应的平衡常数
 ,如
,如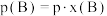 ,p为平衡总压强,x(B)为平衡时B的物质的量分数)。
,p为平衡总压强,x(B)为平衡时B的物质的量分数)。(3)采取下列措施可提高萨巴蒂尔反应中
 平衡转化率的是_______(选填序号)。
平衡转化率的是_______(选填序号)。| A.恒温减压 | B.恒温恒压增大 | C.恒压降温 | D.延长反应时间 |
| A.混合气体的密度不再改变,不一定能确定反应达到限度 |
| B.该反应的物质中,有2种是极性键构成的非极性分子 |
| C.升温可提高反应物活化分子百分数,加快反应速率 |
D.提高 平衡产率是推动科学家寻找性能更好的催化剂的重要因素之一 平衡产率是推动科学家寻找性能更好的催化剂的重要因素之一 |
 再生分两步完成,萨巴蒂尔反应是第一步,第二步在太阳能电池作用下完成。请在下图中画出
再生分两步完成,萨巴蒂尔反应是第一步,第二步在太阳能电池作用下完成。请在下图中画出 再生过程的能量变化,要标注出相应的物质
再生过程的能量变化,要标注出相应的物质
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】I.聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为
CH3COOCH3(l)+C6H13OH(l)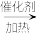 CH3COOC6H13(l)+CH3OH(l)。
CH3COOC6H13(l)+CH3OH(l)。
已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比为1∶1投料,测得348 K、343 K、338 K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
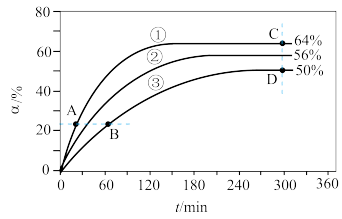
该醇解反应的ΔH___________ 0(填“>”或“<”)。348 K时,以物质的量分数表示的化学平衡常数Kx=___________ (保留2位有效数字)。在曲线①、②、③中,(k正-k逆)的值最大的曲线是___________ ;A、B、C、D四点中,v正最大的是___________ (填字母序号),v逆最大的是___________ (填字母序号)。
(2)343 K时,己醇和乙酸甲酯按物质的量之比为1∶1、1∶2和2∶1进行初始投料。则达到平衡后,初始投料比为____ 时,乙酸甲酯转化率最大;与按1∶2投料相比,按2∶1投料时化学平衡常数Kx___________ (填“增大”“减小”或“不变”)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是___________(填字母序号)。
II.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
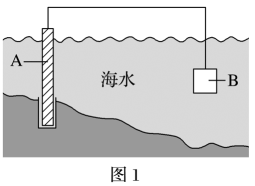
(4)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择____ (填字母)。
a.碳棒 b.锌板 c.铜板
(5)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图2所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
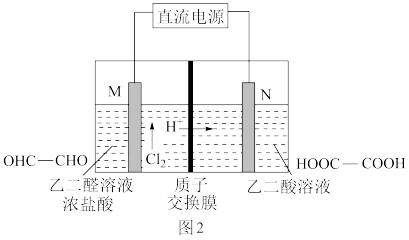
①N电极上的电极反应式为____ 。
②若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为____ mol。
CH3COOCH3(l)+C6H13OH(l)
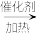 CH3COOC6H13(l)+CH3OH(l)。
CH3COOC6H13(l)+CH3OH(l)。已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比为1∶1投料,测得348 K、343 K、338 K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(2)343 K时,己醇和乙酸甲酯按物质的量之比为1∶1、1∶2和2∶1进行初始投料。则达到平衡后,初始投料比为
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是___________(填字母序号)。
| A.参与了醇解反应,但并不改变反应历程 |
| B.使k正和k逆增大相同倍数 |
| C.降低了醇解反应的活化能 |
| D.提高了乙酸甲酯的平衡转化率 |
II.电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(4)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择
a.碳棒 b.锌板 c.铜板

(5)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图2所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。

①N电极上的电极反应式为
②若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______ (填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g) CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g) 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g) CH4(g)+2H2O(l) △H=
CH4(g)+2H2O(l) △H=______ kJ· mol-1,升高温度,该反应的v(逆)__________ (填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=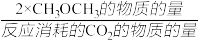 ×100%。
×100%。
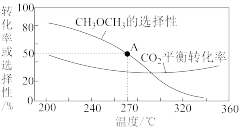
①CH3OCH3的选择性随温度的升高而降低的原因是___________ ,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________ 。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________ mol,反应I的化学平衡常数K=___________ (保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________ (填“阴极”或“阳极”),生成C2H4的电极反应式为_____________ 。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)
 CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1②2H2(g)+O2(g)
 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1则反应CO2(g)+4H2(g)
 CH4(g)+2H2O(l) △H=
CH4(g)+2H2O(l) △H=(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1反应II:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=
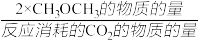 ×100%。
×100%。
①CH3OCH3的选择性随温度的升高而降低的原因是
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为
您最近一年使用:0次
【推荐2】化学变化中的能量转换对于生产具有重大意义和研究价值。回答下列问题:
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量__ (填“释放”或“吸收”。
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJ•mol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJ•mol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJ•mol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJ•mol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=__ kJ•mol-1。
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。
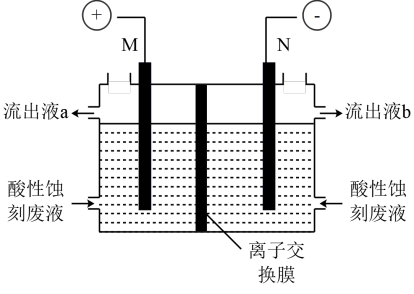
①再生的CuCl2蚀刻液为流出液__ (填“a”或“b”)。
②写出N极的电极反应:__ 。
③装置中使用___ 离子交换膜(填“阳”或“阴”)。若电解池工作前,阴极室和阳极室中电解液质量相等,当转移0.1mol电子,流出液未流出时,两侧电解液的质量差为__ g。
(l)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。

①过程Ⅰ能量
②已知:CO2(g)+H2(g)═CO(g)+H2O(g) △H═+41kJ•mol-1:
2CO2(g)+6H2(g)═C2H4(g)+4H2O(g) △H═-128kJ•mol-1:
3CO2(g)+9H2(g)═C3H6(g)+6H2O(g) △H═+157.5kJ•mol-l
C2H4(g)+C3H6(g)+H2(g)═C5H12(异戊烷,g) △H=+267.6kJ•mol-1。
则5CO(g)+11H2(g)═C5H12(异戊烷,g)+5H2O(g)△H=
(2)一种铜版画雕刻用的酸性蚀刻液的有效成份是CuCl2,蚀刻反应为:Cu2++Cu+6Cl-═2CuCl32-。工业上用电解法将CuCl32-转化为Cu2+,使蚀刻液再生并回收金属Cu。装置如图(电极不参与反应)。

①再生的CuCl2蚀刻液为流出液
②写出N极的电极反应:
③装置中使用
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。某化学小组模拟该方法回收铜和制取胆矾,流程简图如图:
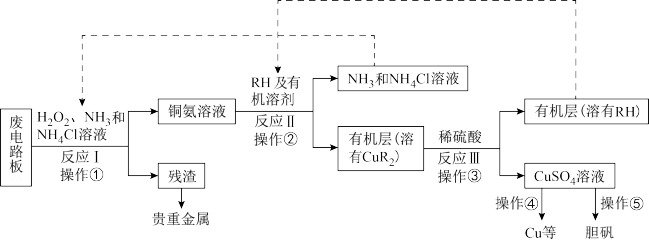
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3) ,反应中H2O2的作用是
,反应中H2O2的作用是___ 。写出操作①的名称:___ 。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3) 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:___ 。操作②用到的主要仪器名称为___ ,其目的是(填序号)___ 。
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和___ 。
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是___ 。
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是___ 。

回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)
 ,反应中H2O2的作用是
,反应中H2O2的作用是(2)反应Ⅱ是铜氨溶液中的Cu(NH3)
 与有机物RH反应,写出该反应的离子方程式:
与有机物RH反应,写出该反应的离子方程式:a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和
(4)操作④以石墨作电极电解CuSO4溶液。阴极析出铜,阳极产物是
(5)操作⑤由硫酸铜溶液制胆矾的主要步骤是
您最近一年使用:0次



