化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+ B(g)= C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题:

①该反应是_______ 。反应(填“吸热”或“放热”),ΔH=_______ (用E1、E2表示);
②加入催化剂对该反应的ΔH_______ 影响(填“有”或“无”)。
(2)已知:2CH3OH(1)+2O2(g)= 2CO(g)+4H2O(g) △H1=-a kJ·mol-1;
2CO(g)+O2(g)= 2CO2(g) △H2= -b kJ·mol-1;
H2O(g)= H2O(1) △H3=-c kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为_______ 。
(3)断裂1mol化学键所需的能量如表所示:
则N2(g)与H2O(g)反应生成NH3(g)和O2(g)的热化学方程式为_______ 。
(4)下列反应中,属于放热反应的是_______ ,属于吸热反应的是_______ 。
①物质燃烧②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的炭⑤食物因氧化而腐败⑥焦炭和水蒸气的反应⑦铁粉与稀盐酸反应
(1)反应A(g)+ B(g)= C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题:

①该反应是
②加入催化剂对该反应的ΔH
(2)已知:2CH3OH(1)+2O2(g)= 2CO(g)+4H2O(g) △H1=-a kJ·mol-1;
2CO(g)+O2(g)= 2CO2(g) △H2= -b kJ·mol-1;
H2O(g)= H2O(1) △H3=-c kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为
(3)断裂1mol化学键所需的能量如表所示:
共价键 | H- N | H- O | N≡N | O =O |
| 断裂1mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
(4)下列反应中,属于放热反应的是
①物质燃烧②炸药爆炸③酸碱中和反应④二氧化碳通过炽热的炭⑤食物因氧化而腐败⑥焦炭和水蒸气的反应⑦铁粉与稀盐酸反应
更新时间:2022-07-24 18:31:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=________ kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述能表示该反应在恒温恒容条件下达到平衡状态的是________ 。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
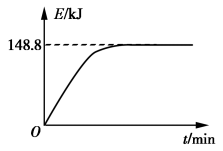
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为________ 。
(2)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2=2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________ mol·L1·min1。
(3)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为________ 。反应前后容器内气体压强之比为________ 。
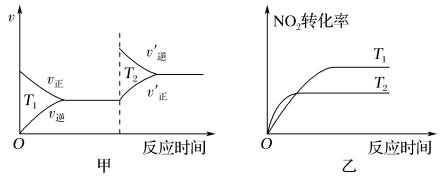
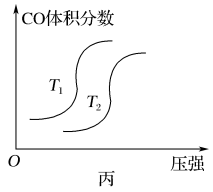
(4)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是________ (填代号)。
(1)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=
②CH4制备合成气的原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。A. 下列叙述能表示该反应在恒温恒容条件下达到平衡状态的是
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为

(2)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
| 序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
| Ⅰ | 0.10 | 0.10 | 0.414 |
| Ⅱ | 0.20 | 0.20 | 3.312 |
| Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2=2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=
(3)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为(4)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体:4CO(g)+2NO2(g)
 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1。对于该反应,温度不同(T2>T1),其他条件相同时,下列图象不正确的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为我国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一、请回答下列问题:
(1)已知:

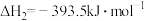

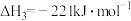
若某反应的平衡常数表达式为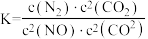 ,则此反应的热化学方程式为
,则此反应的热化学方程式为_______ 。
(2)在一定条件下可发生分解反应: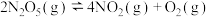 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为: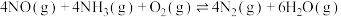
 。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
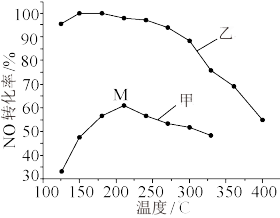
①工业上选择催化剂_______ (填“甲”或“乙”)。
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是_______ 。
(4)工业合成尿素的反应如下: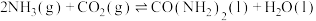
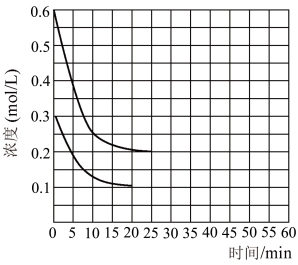
 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的
按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的 和1mol
和1mol ,在40min时重新达到平衡,请在图中画出25~50min内
,在40min时重新达到平衡,请在图中画出25~50min内 的浓度变化曲线。
的浓度变化曲线。_______ 。
(1)已知:

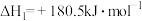

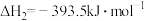

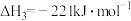
若某反应的平衡常数表达式为
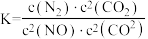 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)在一定条件下可发生分解反应:
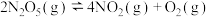 ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量 进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_______(填字母)。A. 和 和 的浓度之比保持不变 的浓度之比保持不变 | B.容器中压强不再变化 |
C.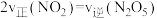 | D.气体的密度保持不变 |
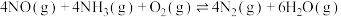
 。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图:
①工业上选择催化剂
②在催化剂甲作用下,温度高于210℃时,NO转化率降低的原因可能是
(4)工业合成尿素的反应如下:
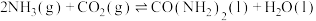
 ,在恒定温度下,将
,在恒定温度下,将 和
和 按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的
按2∶1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示,若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的 和1mol
和1mol ,在40min时重新达到平衡,请在图中画出25~50min内
,在40min时重新达到平衡,请在图中画出25~50min内 的浓度变化曲线。
的浓度变化曲线。
您最近一年使用:0次
【推荐3】氮的化合物在生产实践及科学研究中应用广泛。
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
Ⅱ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H为_______ 。
(2)在3.0L密闭容器中通入1molCH4和2mol NO2,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(P)的数据见下表:
该温度下的压强平衡常数Kp=_______ 。
(3)已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步2NO(g)⇌N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g)⇌2NO2(g)(慢反应)
用O2表示的速率方程为υ(O2)=k1•c2(NO)•c(O2),
用NO2表示的速率方程为υ(NO2)=k2•c2(NO)•c(O2),
k1与k2分别表示速率常数(与温度有关),则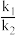 =
=_______ 。
(4)①25℃时,0.1mol/LNH4Cl溶液的pH为_______ (一水合氨Kb=1.8×10-5,lg1.8=0.26)。
②N2H4为二元弱碱,在水中的电离方程式与氨相似,25℃时,其第一步电离反应的平衡常数值为_______ (已知:N2H4+H+⇌N2H 的K=8.7×107;Kw=1.0×10-14)。
的K=8.7×107;Kw=1.0×10-14)。
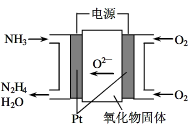
③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:_______ 。
(1)利用甲烷催化还原氮氧化物。已知:
Ⅰ.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
Ⅱ.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
则反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)的△H为
(2)在3.0L密闭容器中通入1molCH4和2mol NO2,在一定温度下进行反应Ⅱ,反应时间(t)与容器内气体总压强(P)的数据见下表:
| 反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强P/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
该温度下的压强平衡常数Kp=
(3)已知2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
第一步2NO(g)⇌N2O2(g)(快速平衡)
第二步N2O2(g)+O2(g)⇌2NO2(g)(慢反应)
用O2表示的速率方程为υ(O2)=k1•c2(NO)•c(O2),
用NO2表示的速率方程为υ(NO2)=k2•c2(NO)•c(O2),
k1与k2分别表示速率常数(与温度有关),则
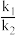 =
=(4)①25℃时,0.1mol/LNH4Cl溶液的pH为
②N2H4为二元弱碱,在水中的电离方程式与氨相似,25℃时,其第一步电离反应的平衡常数值为
 的K=8.7×107;Kw=1.0×10-14)。
的K=8.7×107;Kw=1.0×10-14)。③工业上利用NH3制备联氨(N2H4)装置如图,试写出其阳极电极反应式:

您最近一年使用:0次
【推荐1】回答下列问题:
(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,再向烧杯中加入约10gNH4Cl晶体,并立即用玻璃棒搅拌,使Ba(OH)2·8H2O与NH4Cl充分反应。
①写出反应的化学方程式:_______ 。
②根据_______ (现象),可知上述反应中反应物的总能量_______ (填“大于”“小于”或“等于”)生成物的总能量。
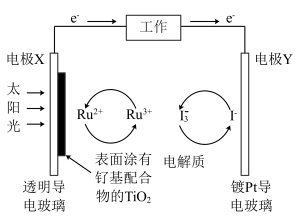
(2)钉 基配合物光敏染料敏化太阳能电池工作时的反应为
基配合物光敏染料敏化太阳能电池工作时的反应为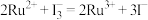 ,装置如图所示。该电池的负极为
,装置如图所示。该电池的负极为_______ (填“电极X”或“电极Y”),负极对应的产物为_______ ;正极反应式为_______ 。
(3)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态 ,发生反应
,发生反应 (该反应条件下所有物质均为气态)。某温度下,若
(该反应条件下所有物质均为气态)。某温度下,若 完全分解成气态
完全分解成气态 。在一定温度下,恒容密闭容器中,
。在一定温度下,恒容密闭容器中, 与
与 物质的量之比为2∶1时开始反应。回答下列问题:
物质的量之比为2∶1时开始反应。回答下列问题:
①当 的体积分数为10%时,
的体积分数为10%时, 的转化率为
的转化率为_______ 。
②当以下数值不变时,能说明该反应达到平衡的是_______ (填字母)。
a.气体密度 b.气体总压 c. 与
与 体积比 d.
体积比 d. 的体积分数
的体积分数
(4)在新型RuO2催化剂作用下,使HCl转化为Cl2的反应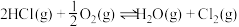 具有更好的催化活性。一定条件下测得反应过程中
具有更好的催化活性。一定条件下测得反应过程中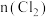 的数据如下:
的数据如下:
则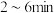 内以
内以 的物质的量变化表示的反应速率为
的物质的量变化表示的反应速率为_______  。
。
(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,再向烧杯中加入约10gNH4Cl晶体,并立即用玻璃棒搅拌,使Ba(OH)2·8H2O与NH4Cl充分反应。
①写出反应的化学方程式:
②根据
(2)钉
 基配合物光敏染料敏化太阳能电池工作时的反应为
基配合物光敏染料敏化太阳能电池工作时的反应为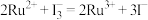 ,装置如图所示。该电池的负极为
,装置如图所示。该电池的负极为
(3)CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态
 ,发生反应
,发生反应 (该反应条件下所有物质均为气态)。某温度下,若
(该反应条件下所有物质均为气态)。某温度下,若 完全分解成气态
完全分解成气态 。在一定温度下,恒容密闭容器中,
。在一定温度下,恒容密闭容器中, 与
与 物质的量之比为2∶1时开始反应。回答下列问题:
物质的量之比为2∶1时开始反应。回答下列问题:①当
 的体积分数为10%时,
的体积分数为10%时, 的转化率为
的转化率为②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b.气体总压 c.
 与
与 体积比 d.
体积比 d. 的体积分数
的体积分数(4)在新型RuO2催化剂作用下,使HCl转化为Cl2的反应
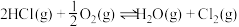 具有更好的催化活性。一定条件下测得反应过程中
具有更好的催化活性。一定条件下测得反应过程中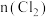 的数据如下:
的数据如下: | 0 | 2 | 4 | 6 | 8 |
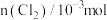 | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
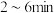 内以
内以 的物质的量变化表示的反应速率为
的物质的量变化表示的反应速率为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I.某同学设计下图简易装置测定中和热。回答下列问题:
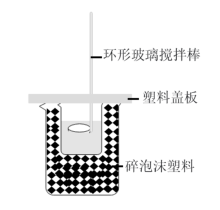
(1)该装置中缺少的仪器是___________ 。碎泡沫的作用:______
(2)50 mL 0.10 mol/L的盐酸与50 mL 0.11 mol/L的NaOH溶液混合后,测得反应放出的热量为285J,则中和热△H=___________ 。若将盐酸换成醋酸,会导致测定结果偏___________ (填小或者大)若将环形玻璃搅拌棒换为金属搅拌棒,则测得反应放出的热量将___________ (填“偏多”“偏少”或“不变”)。
II.氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(3)如图是 1 mol NO2(g)和 1 mol CO(g)反应生成 1 mol CO2(g)和 1 mol NO(g)过程中能量变化示意图。
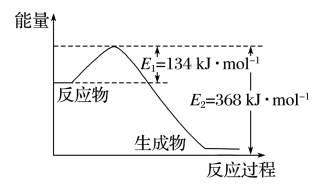
①该反应是___________ (填“吸热”或“放热”)反应。
②请写出反应的热化学方程式___________ 。
③若在该反应体系中加入催化剂对反应热___________ (填“有”或“没有”)影响。
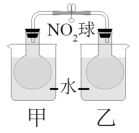
(4)已知,可逆反应2NO2(g) N2O4(g) ΔH = −56.9 kJ/mol。该反应正向是
N2O4(g) ΔH = −56.9 kJ/mol。该反应正向是___________ 反应。(填放热或吸热)在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色变深。说明CaO与水反应是___________ 反应(填吸热或者放热)

(1)该装置中缺少的仪器是
(2)50 mL 0.10 mol/L的盐酸与50 mL 0.11 mol/L的NaOH溶液混合后,测得反应放出的热量为285J,则中和热△H=
II.氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(3)如图是 1 mol NO2(g)和 1 mol CO(g)反应生成 1 mol CO2(g)和 1 mol NO(g)过程中能量变化示意图。

①该反应是
②请写出反应的热化学方程式
③若在该反应体系中加入催化剂对反应热
(4)已知,可逆反应2NO2(g)
 N2O4(g) ΔH = −56.9 kJ/mol。该反应正向是
N2O4(g) ΔH = −56.9 kJ/mol。该反应正向是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】(1)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是________ (填序号)
(2)某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
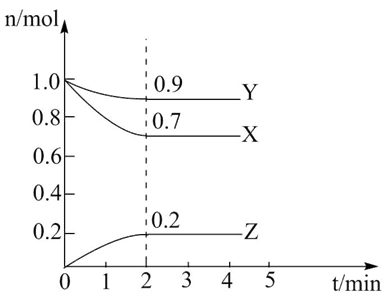
①该反应的化学方程式为________ ;
②将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________ 。
③一定能证明该反应达到平衡状态的是_______ 。
A.单位时间内生成3molX,同时消耗nmolY
B.某时刻X,Y,Z的浓度相等
C.混合气体的密度不变
D.混合气体的平均相对分子质量
E.各反应物或生成物的反应速率之比等于化学计量数之比
④在其他条件不变时,若改变下列条件,能使生成Z的速率变大的是________
A.升高温度
B.增大X的浓度
C.使用催化剂
D.恒容下充入Ne(不参与体系反应)
(2)某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为
②将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=
③一定能证明该反应达到平衡状态的是
A.单位时间内生成3molX,同时消耗nmolY
B.某时刻X,Y,Z的浓度相等
C.混合气体的密度不变
D.混合气体的平均相对分子质量
E.各反应物或生成物的反应速率之比等于化学计量数之比
④在其他条件不变时,若改变下列条件,能使生成Z的速率变大的是
A.升高温度
B.增大X的浓度
C.使用催化剂
D.恒容下充入Ne(不参与体系反应)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】按要求完成下列问题。
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出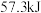 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:_______ 。
(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)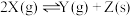
(乙)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成
 会放出
会放出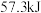 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)
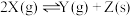
(乙)

当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】化学反应中的能量变化通常表现为热量变化,研究热量变化具有重要的意义。化学反应的反应热可通过实验测定,也可通过计算间接获得。
(1)下列变化属于吸热反应的是___________ (填序号)。
①液态水气化 ②胆矾加热变成白色粉末 ③浓硫酸稀释 ④氢气还原氧化铜 ⑤碳酸钙高温分解
⑥氢氧化钾和稀硫酸反应 ⑦灼热的木炭与 的反应 ⑧
的反应 ⑧ 晶体与
晶体与 晶体的反应 ⑨甲烷在空气中燃烧的反应
晶体的反应 ⑨甲烷在空气中燃烧的反应
(2)在25 ℃、101 kPa下,23 g乙醇 完全燃烧生成
完全燃烧生成 和被态水时放热638.4 kJ。则表示乙醇燃烧热的热化学方程式为
和被态水时放热638.4 kJ。则表示乙醇燃烧热的热化学方程式为___________ 。
Ⅰ.中和反应反应热的实验测定
(3)某化学兴趣小组要完成中和反应反应热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒2支、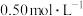 醋酸、
醋酸、 NaOH溶液,实验尚缺少的玻璃用品是
NaOH溶液,实验尚缺少的玻璃用品是___________ 、___________ 。
(4)在量热计中将100 mL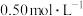 的醋酸溶液与100mL
的醋酸溶液与100mL  的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(各部件温度每升高1 K所需的热量)是
的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(各部件温度每升高1 K所需的热量)是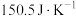 ,溶液密度均近似为
,溶液密度均近似为 ,充分混合后溶液的比热容
,充分混合后溶液的比热容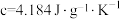 。求醋酸与氢氧化钠发生中和反应的反应热
。求醋酸与氢氧化钠发生中和反应的反应热
___________ 。(小数点后保留1位数字)
(5)若用KOH代替NaOH,对测定结果___________ (填“有”或“无”)影响;若用盐酸代替醋酸做实验,则测定结果
___________ (填“偏大”或“偏小”无影响)。
Ⅱ.通过计算间接获得反应热
(6)利用合成气(主要成分为CO、 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:
①

②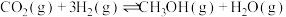

③
 ,已知反应①中相关的化学键键能数据如下:
,已知反应①中相关的化学键键能数据如下:
(已知 结构式为
结构式为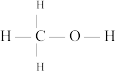 )
)
由此计算
___________ ;已知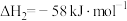 ,则
,则
___________ 。
(1)下列变化属于吸热反应的是
①液态水气化 ②胆矾加热变成白色粉末 ③浓硫酸稀释 ④氢气还原氧化铜 ⑤碳酸钙高温分解
⑥氢氧化钾和稀硫酸反应 ⑦灼热的木炭与
 的反应 ⑧
的反应 ⑧ 晶体与
晶体与 晶体的反应 ⑨甲烷在空气中燃烧的反应
晶体的反应 ⑨甲烷在空气中燃烧的反应(2)在25 ℃、101 kPa下,23 g乙醇
 完全燃烧生成
完全燃烧生成 和被态水时放热638.4 kJ。则表示乙醇燃烧热的热化学方程式为
和被态水时放热638.4 kJ。则表示乙醇燃烧热的热化学方程式为Ⅰ.中和反应反应热的实验测定
(3)某化学兴趣小组要完成中和反应反应热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒2支、
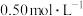 醋酸、
醋酸、 NaOH溶液,实验尚缺少的玻璃用品是
NaOH溶液,实验尚缺少的玻璃用品是(4)在量热计中将100 mL
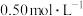 的醋酸溶液与100mL
的醋酸溶液与100mL  的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(各部件温度每升高1 K所需的热量)是
的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(各部件温度每升高1 K所需的热量)是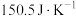 ,溶液密度均近似为
,溶液密度均近似为 ,充分混合后溶液的比热容
,充分混合后溶液的比热容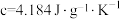 。求醋酸与氢氧化钠发生中和反应的反应热
。求醋酸与氢氧化钠发生中和反应的反应热
(5)若用KOH代替NaOH,对测定结果

Ⅱ.通过计算间接获得反应热
(6)利用合成气(主要成分为CO、
 和
和 )在催化剂作用下合成甲醇,发生的主要反应如下:
)在催化剂作用下合成甲醇,发生的主要反应如下:①


②
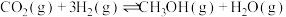

③

 ,已知反应①中相关的化学键键能数据如下:
,已知反应①中相关的化学键键能数据如下:| 化学键 |  |  |  |  |  |
 | 436 | 343 | 1076 | 465 | 413 |
 结构式为
结构式为 )
)由此计算

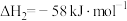 ,则
,则
您最近一年使用:0次
【推荐3】C、CO、CH4和CH3OH(l)均是常用的燃料。回答下列问题:
(1)金刚石、石墨是C的两种同素异形体。已知:
①C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol- 1
②C(s,金刚石)+O2(g)=CO2(g) △H2= -395.0 kJ·mol- 1
则稳定性:金刚石___________ (填“>”“=”或“<”)石墨。
(2)燃烧a g CH4生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) △H1=___________ kJ·mol- 1,其中a=___________ 。
(3)已知完全燃烧1 mol C、CO、CH3OH(l)(有水生成时水为液态),放出的热量依次为393.5 kJ、283.0 kJ和726.5 kJ。
①写出表示CH3OH燃烧热的热化学方程式:___________ 。
②结合(2)数据,相同质量的上述4种物质完全燃烧,放出热量最多的是___________ (填化学式)。
(4)工业上可通过CO和H2化合制备CH3OH,该反应的热化学方程式为CO(g) +2H2(g)=CH3OH(g) △H = -116 kJ·mol- 1。断裂1mol某些化学键所吸收的能量数据如表:
则CO中形成1molC O键所放出的能量是
O键所放出的能量是___________ kJ。
(5)用CO2与H2也可生产CH3OH。已知:H2的燃烧热为285.8 kJ·mol- 1,CH3OH(g) =CH3OH(l) △H = - 37.3 kJ·mol- 1 ,利用(2)、(3)、(4)中的有关数据,可得CO2(g)+3H2(g)=CH3OH(l)+ H2O(1)的△H=___________ kJ·mol- 1。
(1)金刚石、石墨是C的两种同素异形体。已知:
①C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol- 1
②C(s,金刚石)+O2(g)=CO2(g) △H2= -395.0 kJ·mol- 1
则稳定性:金刚石
(2)燃烧a g CH4生成二氧化碳气体和液态水,放出热量44.5 kJ。经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则CH4(g) + 2O2(g)=CO2(g) + 2H2O(l) △H1=
(3)已知完全燃烧1 mol C、CO、CH3OH(l)(有水生成时水为液态),放出的热量依次为393.5 kJ、283.0 kJ和726.5 kJ。
①写出表示CH3OH燃烧热的热化学方程式:
②结合(2)数据,相同质量的上述4种物质完全燃烧,放出热量最多的是
(4)工业上可通过CO和H2化合制备CH3OH,该反应的热化学方程式为CO(g) +2H2(g)=CH3OH(g) △H = -116 kJ·mol- 1。断裂1mol某些化学键所吸收的能量数据如表:
| 化学键 | C- H | H-H | C- O | H- O |
| 能量/kJ | 413 | 436 | 358 | 463 |
 O键所放出的能量是
O键所放出的能量是(5)用CO2与H2也可生产CH3OH。已知:H2的燃烧热为285.8 kJ·mol- 1,CH3OH(g) =CH3OH(l) △H = - 37.3 kJ·mol- 1 ,利用(2)、(3)、(4)中的有关数据,可得CO2(g)+3H2(g)=CH3OH(l)+ H2O(1)的△H=
您最近一年使用:0次
【推荐1】氨是重要的无机化工产品,工业合成涉及到的主反应是N2(g)+3H2(g)⇌2NH3(g)。回答下列问题:
(1)已知1molN2中的共价键断裂吸收Q1kJ能量;1molH2中的共价键断裂吸收Q2kJ能量;形成1molN-H释放Q3kJ能量。
①N2(g)+3H2(g)⇌2NH3(g) △H=_______ kJ·mol-1。
②Fe3O4为该反应的催化剂,使用时常加入Al2O3与之生成合金FeO·Al2O3使Fe3O4分布均匀,其目的是_______ 。
(2)用平衡分压p(NH3)、p(N2)、p(H2)代替平衡浓度表示化学平衡常数。温度不变,将平衡时体系的总压强p1增加到原来的两倍,则此时Qp=_______ (用含Kp的代数式表示)。
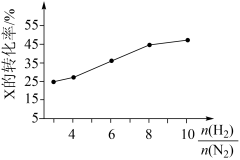
(3)T℃时,在有催化剂的恒容密闭容器只中充入N2和H2。如图所示为不同投料比[ ]时某反应物X的的平衡转化率的变化曲线。反应物X是
]时某反应物X的的平衡转化率的变化曲线。反应物X是_______ (填“N2”或“H2”),判断依据是______________ 。
(4)工业上可通过反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1制备原料气氢气。
①制备过程中一般采用较高的压强(3.0MPa),原因是_______ ;原料气在进入氨合成塔前需除去CO,原因是_______ 。
②在镍催化剂表面存在如下反应机理(*表示镍表面活性中心,上标*表示组分被活性中心吸附):
I.CH4+2*=CH3*+H*(慢)H2O+*=H2+O*
II.CH3*+*=CH2*+H*
III.CH2*+*=CH*+H*
IV.CH*+O*=CO*+H*
V.CO*=CO+*
甲烷在镍催化表面发生的五个基元反应中,活化能最大的是_______ (填标号)。若反应CH4(g)+H2O(g)=CO(g)+3H2(g)在任意温度下能自发进行,则ΔH1_______ 0(填“大于”或“小于”)。
(1)已知1molN2中的共价键断裂吸收Q1kJ能量;1molH2中的共价键断裂吸收Q2kJ能量;形成1molN-H释放Q3kJ能量。
①N2(g)+3H2(g)⇌2NH3(g) △H=
②Fe3O4为该反应的催化剂,使用时常加入Al2O3与之生成合金FeO·Al2O3使Fe3O4分布均匀,其目的是
(2)用平衡分压p(NH3)、p(N2)、p(H2)代替平衡浓度表示化学平衡常数。温度不变,将平衡时体系的总压强p1增加到原来的两倍,则此时Qp=
(3)T℃时,在有催化剂的恒容密闭容器只中充入N2和H2。如图所示为不同投料比[
 ]时某反应物X的的平衡转化率的变化曲线。反应物X是
]时某反应物X的的平衡转化率的变化曲线。反应物X是
(4)工业上可通过反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1制备原料气氢气。
①制备过程中一般采用较高的压强(3.0MPa),原因是
②在镍催化剂表面存在如下反应机理(*表示镍表面活性中心,上标*表示组分被活性中心吸附):
I.CH4+2*=CH3*+H*(慢)H2O+*=H2+O*
II.CH3*+*=CH2*+H*
III.CH2*+*=CH*+H*
IV.CH*+O*=CO*+H*
V.CO*=CO+*
甲烷在镍催化表面发生的五个基元反应中,活化能最大的是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式____________________________________ 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式_____________________________ 。
(3)断裂1 mol化学键所需的能量如表所示:
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为________________ 。
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(3)断裂1 mol化学键所需的能量如表所示:
| 共价键 | H—N | H—O | N≡N | O==O |
| 断裂1 mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出:
(1)W的化学式是________ ,W属于________ 化合物。
(2)X的电子式是________ ,X属于________ 化合物。
(3)1 mol Y在干燥的空气中质量会______ (填“增大”或“减小”),其变化量(Δm)为________ 。
(4)用电子式表示化合物Z的形成过程________ 。
Ⅱ.已知Si-Cl键、H-H键、H-Cl键、Si-Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si-Si键。
(5)工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)=Si(s)+4HCl(g) 则该反应的反应热是_______________ 。
(1)W的化学式是
(2)X的电子式是
(3)1 mol Y在干燥的空气中质量会
(4)用电子式表示化合物Z的形成过程
Ⅱ.已知Si-Cl键、H-H键、H-Cl键、Si-Si键的键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、d kJ·mol-1,1 mol硅晶体含2 mol Si-Si键。
(5)工业上,提纯硅的化学方程式是SiCl4(g)+2H2(g)=Si(s)+4HCl(g) 则该反应的反应热是
您最近一年使用:0次



