二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。已知二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),请回答下列问题:合成总反应在起始物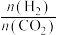 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
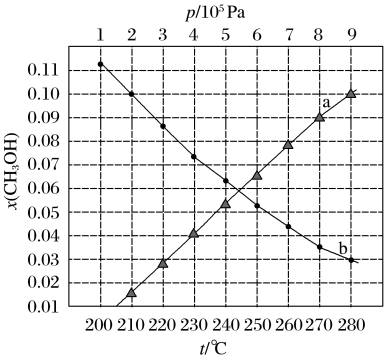
当x(CH3OH)=0.10时,CO2的平衡转化率α=___________ ,反应条件可能为___________ 或___________ 。
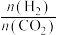 =3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250 ℃下的x(CH3OH)~p、在p=5×105 Pa下的x(CH3OH)~t如图所示。
当x(CH3OH)=0.10时,CO2的平衡转化率α=
更新时间:2022-09-22 09:31:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表____________ (表中不要留空格)。
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
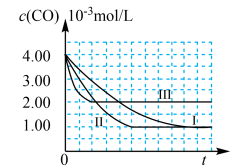
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为______ 。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________ (填“增大”、“减小”、“无影响”)。
 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g | |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4. 00×10-3 | 80 | |
| Ⅱ | ① | ② | ③ | ④ | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | ⑤ | ⑥ | 80 | |

(2)计算第Ⅰ组实验中,达平衡时NO的浓度为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】近年来我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知: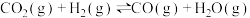
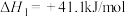


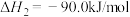

写出 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:___________ ;并用 、
、 表示此反应的化学平衡常数
表示此反应的化学平衡常数
___________ 。
(2)为提高 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是___________ (填字母)。
a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
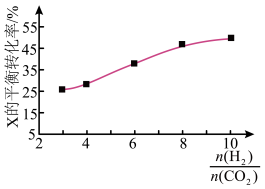
(3)在250℃时,在某恒容密闭容器中进行由 催化氢化合成
催化氢化合成 的反应,如图为不同投料比[
的反应,如图为不同投料比[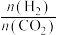 ]时某反应物X的平衡转化率的变化曲线。则反应物X是
]时某反应物X的平衡转化率的变化曲线。则反应物X是___________ (填“ ”或“
”或“ ”)。
”)。
(4)在250℃时,在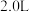 的恒容密闭容器中加入
的恒容密闭容器中加入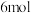
 、
、
 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得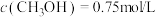 。
。
①前 内
内 的平均反应速率
的平均反应速率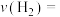
___________  。
。
②化学平衡常数
___________ (用分数表示)。
③下列描述中能说明上述反应已达平衡的是___________ (填字母)。
a.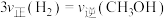
b.单位时间内生成
 的同时生成
的同时生成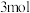

c.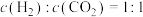
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
根据上表所给数据,用 生产甲醇的最优条件为
生产甲醇的最优条件为___________ (填实验编号)。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:(1)已知:
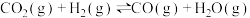
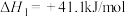


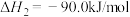

写出
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式: 、
、 表示此反应的化学平衡常数
表示此反应的化学平衡常数
(2)为提高
 的产率,理论上应采用的条件是
的产率,理论上应采用的条件是a.高温、高压 b.低温、低压 c.高温、低压 d.低温、高压
(3)在250℃时,在某恒容密闭容器中进行由
 催化氢化合成
催化氢化合成 的反应,如图为不同投料比[
的反应,如图为不同投料比[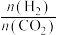 ]时某反应物X的平衡转化率的变化曲线。则反应物X是
]时某反应物X的平衡转化率的变化曲线。则反应物X是 ”或“
”或“ ”)。
”)。
(4)在250℃时,在
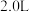 的恒容密闭容器中加入
的恒容密闭容器中加入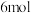
 、
、
 及催化剂,
及催化剂, 时反应达到平衡,测得
时反应达到平衡,测得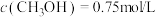 。
。①前
 内
内 的平均反应速率
的平均反应速率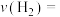
 。
。②化学平衡常数

③下列描述中能说明上述反应已达平衡的是
a.
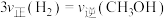
b.单位时间内生成

 的同时生成
的同时生成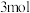

c.
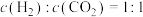
d.容器中气体的平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下表四组实验数据。
| 实验编号 | 温度/K | 催化剂 |  的转化率/% 的转化率/% | 甲醇的选择性/% |
| A | 543 |  纳米棒 纳米棒 | 12.3 | 42.3 |
| B | 543 |  纳米片 纳米片 | 11.9 | 72.7 |
| C | 553 |  纳米棒 纳米棒 | 15.3 | 39.1 |
| D | 553 |  纳米片 纳米片 | 12.0 | 70.6 |
 生产甲醇的最优条件为
生产甲醇的最优条件为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上利用天然气制备 ,还可得到
,还可得到 、
、 等化工产品。一定条件下,有关反应如下:
等化工产品。一定条件下,有关反应如下:
反应1:
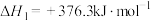
反应2: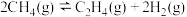
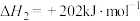
回答下列问题:
(1)相同条件下,反应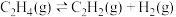
 ,
,
_______  。
。
(2)实验测得反应1的速率方程: ,
,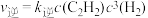 (
( 、
、 分别为正、逆反应速率常数)。
分别为正、逆反应速率常数)。
①结合速率的影响因素,推测速率常数k的影响因素有_______ (填标号)。
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时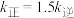 ,该温度下平衡常数
,该温度下平衡常数
_______ 。
(3)向恒温恒容密闭容器中充入适量 ,同时发生上述反应1和反应2,在不同催化剂
,同时发生上述反应1和反应2,在不同催化剂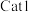 、
、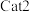 作用下,测得单位时间内
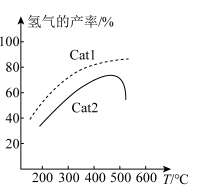
作用下,测得单位时间内 的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是_______ (填“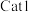 ”或“
”或“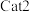 ”)。在
”)。在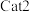 作用下,温度高于500℃时,
作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是_______ 。
(4)一定温度下,总压强恒定为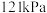 时,向密闭容器中充入
时,向密闭容器中充入 和
和 的混合气体(
的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如下图所示。
的物质的量分数的关系如下图所示。
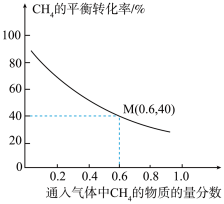
①随着通入气体中 的物质的量分数增大,
的物质的量分数增大, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是_______ 。
②已知M点对应的乙炔的选择性为75%(乙炔的选择性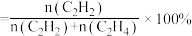 )。该温度下,反应2的平衡常数
)。该温度下,反应2的平衡常数
_______  (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为
(结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为 ,
, 。)
。)
 ,还可得到
,还可得到 、
、 等化工产品。一定条件下,有关反应如下:
等化工产品。一定条件下,有关反应如下:反应1:

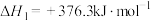
反应2:
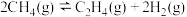
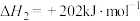
回答下列问题:
(1)相同条件下,反应
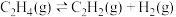
 ,
,
 。
。(2)实验测得反应1的速率方程:
 ,
,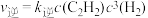 (
( 、
、 分别为正、逆反应速率常数)。
分别为正、逆反应速率常数)。①结合速率的影响因素,推测速率常数k的影响因素有
A.温度 B.浓度 C.催化剂 D.固体表面性质
②T℃下反应达到平衡时
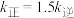 ,该温度下平衡常数
,该温度下平衡常数
(3)向恒温恒容密闭容器中充入适量
 ,同时发生上述反应1和反应2,在不同催化剂
,同时发生上述反应1和反应2,在不同催化剂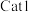 、
、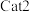 作用下,测得单位时间内
作用下,测得单位时间内 的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是
的产率与温度的关系如图所示。在其他条件相同时,催化效率较高的是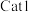 ”或“
”或“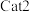 ”)。在
”)。在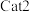 作用下,温度高于500℃时,
作用下,温度高于500℃时, 的产率降低的可能原因是
的产率降低的可能原因是
(4)一定温度下,总压强恒定为
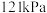 时,向密闭容器中充入
时,向密闭容器中充入 和
和 的混合气体(
的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如下图所示。
的物质的量分数的关系如下图所示。
①随着通入气体中
 的物质的量分数增大,
的物质的量分数增大, 的平衡转化率降低的主要原因是
的平衡转化率降低的主要原因是②已知M点对应的乙炔的选择性为75%(乙炔的选择性
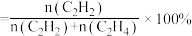 )。该温度下,反应2的平衡常数
)。该温度下,反应2的平衡常数
 (结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为
(结果保留2位有效数字)。(提示:用平衡时气体分压计算的平衡常数为 ,
, 。)
。)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】已知某反应的平衡常数表达式为:K=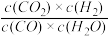 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:
(1)该反应的ΔH______ 0(填“>”或“<”)。
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应_____ 向进行中(“正”或“逆”);
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则
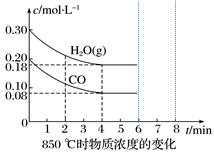
①4 min时H2的物质的量分数=___________ ;②K1=_____________ ;
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:_________ ;
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图象(注明起点坐标)______________ ;
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。
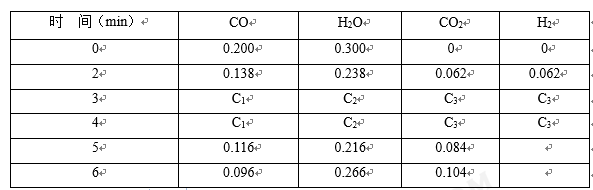
①3~4min时,v正________ v逆(填“>”或“=”或“<”),C1 ____ 0.08 mol/L(填“>”或“=”或“<”);
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是_________ (单选),反应在5 min~6 min,平衡向正方向移动,可能的原因是___________ (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | K1 |
(1)该反应的ΔH
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则

①4 min时H2的物质的量分数=
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图象(注明起点坐标)
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。

①3~4min时,v正
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
您最近一年使用:0次
【推荐2】氨气是基础有机合成工业和化肥工业的重要原料。
(1)诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:
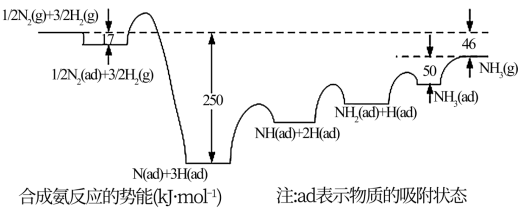
在合成氨吸附解离的过程中,下列状态最稳定的是___________ (填选项)。
A.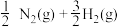 B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
其中,NH3(ad) NH3(g) ∆H=
NH3(g) ∆H= ___________ kJ·mol-1,若要使该平衡正向移动,可采取的措施是___________ (填选项)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
(2)在上述实验条件下,向一密闭容器中通入 1molN2和 3molH2充分反应,达到平衡时放出 46kJ 热量,计算该条件下 H2的转化率___________ 。
(3)在 t ℃、压强为 3.6 MPa 条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)] 为 3 的混合气体,体系中气体的含量与时间变化关系如图所示:
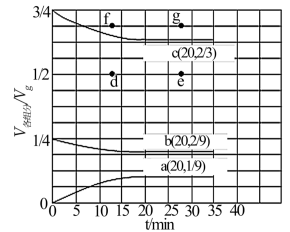
反应 20 min 达到平衡,试求 0~20 min 内氨气的平均反应速率 v(NH3)=___________ MPa·min-1。若起始条件一样,在恒容容器中发生反应,则达到平衡时 H2的含量符合上图中 ___________ 点(填“d”、“e”、“f”或“g”)。
(4)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为 3 时,平衡时氨气的含量关系式为:ω (NH3)=0.325·KP·P·(1-i ) 2,(KP:平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为 500℃,不含惰性气体时,平衡体系压强为 2.4MPa,氨气的含量为 ω ,若此时增大压强,Kp___________ 将(填“变大”、“变小”或“不变”)。若温度不变,体系中有 20%的惰性气体,欲使平衡时氨气的含量仍为 ω ,应将压强调整至___________ MPa。
(1)诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨势能如图所示:

在合成氨吸附解离的过程中,下列状态最稳定的是
A.
 B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)
B.NH3(g) C.NH(ad)+2H(ad) D.N(ad)+3H(ad)其中,NH3(ad)
 NH3(g) ∆H=
NH3(g) ∆H= A.升高温度 B.降低温度 C.增大压强 D.减小压强
(2)在上述实验条件下,向一密闭容器中通入 1molN2和 3molH2充分反应,达到平衡时放出 46kJ 热量,计算该条件下 H2的转化率
(3)在 t ℃、压强为 3.6 MPa 条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)] 为 3 的混合气体,体系中气体的含量与时间变化关系如图所示:

反应 20 min 达到平衡,试求 0~20 min 内氨气的平均反应速率 v(NH3)=
(4)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为 3 时,平衡时氨气的含量关系式为:ω (NH3)=0.325·KP·P·(1-i ) 2,(KP:平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为 500℃,不含惰性气体时,平衡体系压强为 2.4MPa,氨气的含量为 ω ,若此时增大压强,Kp
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:

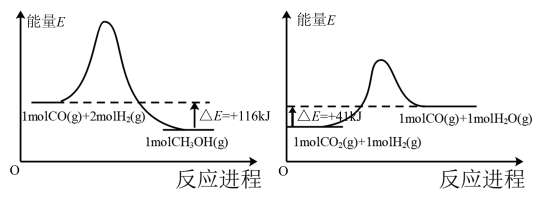
该反应一般认为通过如下步骤来实现:
①
②
总反应的
_______  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号),判断的理由是_______ 。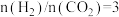 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为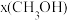 ,在
,在 ℃下的
℃下的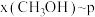 、在
、在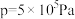 下的
下的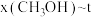 如图所示。
如图所示。
_______ ;
②图中对应等压过程的曲线是_______ ,判断的理由是_______ ;
③当 时,
时, 的平衡转化率
的平衡转化率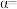
____ ,反应条件可能为___ 或___ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②

总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A.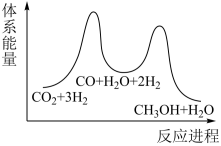 B.
B.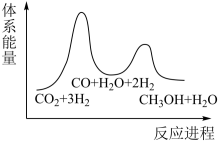 C.
C. D.
D.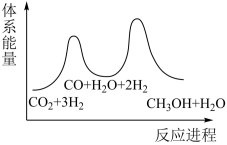
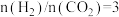 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为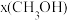 ,在
,在 ℃下的
℃下的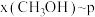 、在
、在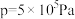 下的
下的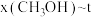 如图所示。
如图所示。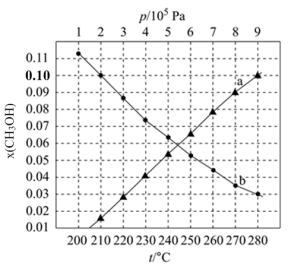

②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率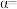
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氢能是一种极具发展潜力的清洁能源,以下反应是目前大规模制取氢气的重要方法之一:
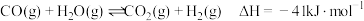
(1)为提高该反应中 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为___________ 。
a.增大压强 b.升高温度 c.通入过量水蒸气
(2) 时,该反应的平衡常数
时,该反应的平衡常数 。该温度下,在容积为
。该温度下,在容积为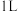 的密闭容器中进行反应,测得某一时刻反应混合物中
的密闭容器中进行反应,测得某一时刻反应混合物中 、
、 、
、 、
、 的物质的量分别为
的物质的量分别为 、
、 、
、 、
、 。
。
①该时刻反应的浓度商
___________ (填计算结果)。
②该时刻反应___________ (填“正向进行”或“逆向进行”或“已达平衡”)。
(3) 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下,在容积为
,该温度下,在容积为 的密闭容器中投入
的密闭容器中投入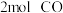 与
与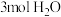 。反应达平衡时
。反应达平衡时 的转化率为
的转化率为___________ 。
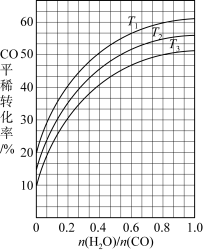
(4)下图表示不同温度下, 平衡转化率随
平衡转化率随 的变化趋势。
的变化趋势。 、
、 和
和 的三个温度中最大的是
的三个温度中最大的是___________ (填“ ”或“
”或“ ”或“
”或“ ”),原因是
”),原因是___________ 。
已知: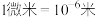 ,
,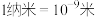
(5)实验发现,其它条件不变,一定反应时间内,向反应体系中投入一定量的 可以增大
可以增大 的物质的量分数,实验结果如图所示。相比使用微米
的物质的量分数,实验结果如图所示。相比使用微米 ,使用纳米
,使用纳米 时
时 的物质的量分数更大的可能原因是
的物质的量分数更大的可能原因是___________ 。

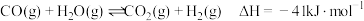
(1)为提高该反应中
 的平衡转化率,理论上可以采取的措施为
的平衡转化率,理论上可以采取的措施为a.增大压强 b.升高温度 c.通入过量水蒸气
(2)
 时,该反应的平衡常数
时,该反应的平衡常数 。该温度下,在容积为
。该温度下,在容积为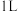 的密闭容器中进行反应,测得某一时刻反应混合物中
的密闭容器中进行反应,测得某一时刻反应混合物中 、
、 、
、 、
、 的物质的量分别为
的物质的量分别为 、
、 、
、 、
、 。
。①该时刻反应的浓度商

②该时刻反应
(3)
 时,该反应的平衡常数
时,该反应的平衡常数 ,该温度下,在容积为
,该温度下,在容积为 的密闭容器中投入
的密闭容器中投入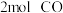 与
与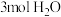 。反应达平衡时
。反应达平衡时 的转化率为
的转化率为(4)下图表示不同温度下,
 平衡转化率随
平衡转化率随 的变化趋势。
的变化趋势。 、
、 和
和 的三个温度中最大的是
的三个温度中最大的是 ”或“
”或“ ”或“
”或“ ”),原因是
”),原因是
已知:
 ,
,
(5)实验发现,其它条件不变,一定反应时间内,向反应体系中投入一定量的
 可以增大
可以增大 的物质的量分数,实验结果如图所示。相比使用微米
的物质的量分数,实验结果如图所示。相比使用微米 ,使用纳米
,使用纳米 时
时 的物质的量分数更大的可能原因是
的物质的量分数更大的可能原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】碳中和是目前全球关注的热点。将 加氢转化为甲醇是一种有效利用
加氢转化为甲醇是一种有效利用 的方式之一,回答下列问题:
的方式之一,回答下列问题:
(1)已知:
反应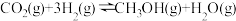 的
的
_______  。
。
(2)实验室在1L密闭容器中进行模拟合成实验。将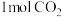 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
反应Ⅰ: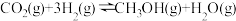 (主反应)
(主反应)
反应Ⅱ:
①反应开始10min内, 的平均反应速率为
的平均反应速率为_______ 。
②该温度下,反应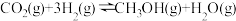 的平衡常数
的平衡常数
_______ 
③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是_______ (填标号)。
A. 减小
减小
B.反应Ⅰ正反应速率加快,逆反应速率减慢
C. 的物质的量增加
的物质的量增加
D.重新平衡时,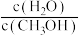 比值增大
比值增大
(3)在上述模拟合成实验中,测得不同温度下的 平衡转化率如下表所示:
平衡转化率如下表所示:
 平衡转化率先减小后增大的原因是
平衡转化率先减小后增大的原因是_______ 。
 加氢转化为甲醇是一种有效利用
加氢转化为甲醇是一种有效利用 的方式之一,回答下列问题:
的方式之一,回答下列问题:(1)已知:

反应
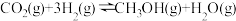 的
的
 。
。(2)实验室在1L密闭容器中进行模拟合成实验。将
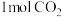 和
和 通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L)
通入容器中,在催化剂的作用下,恒温500℃反应,每隔一定时间测得容器中甲醇和水蒸气的浓度如下:(表中数据单位:mol/L) | 物质/时间 | 10min | 20min | 30min | 40min | 50min | 60min |
 | 0.40 | 0.55 | 0.65 | 0.73 | 0.80 | 0.80 |
 | 0.45 | 0.63 | 0.78 | 0.86 | 0.90 | 0.90 |
反应Ⅰ:
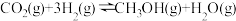 (主反应)
(主反应)反应Ⅱ:

①反应开始10min内,
 的平均反应速率为
的平均反应速率为②该温度下,反应
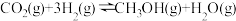 的平衡常数
的平衡常数

③500℃时,将容器的容积压缩到原来的一半,在其他条件不变的情况下,平衡体系中变化正确的是
A.
 减小
减小B.反应Ⅰ正反应速率加快,逆反应速率减慢
C.
 的物质的量增加
的物质的量增加D.重新平衡时,
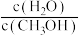 比值增大
比值增大(3)在上述模拟合成实验中,测得不同温度下的
 平衡转化率如下表所示:
平衡转化率如下表所示:| T/℃ | 300 | 500 | 700 |
 平衡转化率/% 平衡转化率/% | 93 | 90 | 92 |
 平衡转化率先减小后增大的原因是
平衡转化率先减小后增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】按要求填空:
(1)同温同压下,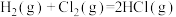 ,在光照和点燃条件下的
,在光照和点燃条件下的 (化学计量数相同)分别为
(化学计量数相同)分别为 、
、 ,
,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)已知
 ,则稳定性:白磷
,则稳定性:白磷___________ 红磷(填“>”、“<”或“=”)。
(3) 是一种无色气体,遇到空气能发生爆炸性自燃,生成
是一种无色气体,遇到空气能发生爆炸性自燃,生成 和液态
和液态 。已知室温下1 g
。已知室温下1 g  自燃放出热量a kJ。
自燃放出热量a kJ。 自燃的热化学方程式为
自燃的热化学方程式为___________ 。
(4)将C、Al和 按一定比例混合在高温下煅烧,所得物质可作导弹表面的耐高温材料:
按一定比例混合在高温下煅烧,所得物质可作导弹表面的耐高温材料: 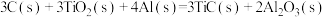
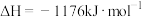 。则反应过程中,每转移1 mol
。则反应过程中,每转移1 mol 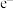 放出的热量为
放出的热量为___________ kJ。
(5)在密闭容器中,一定量混合气体发生下列反应: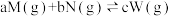 ,达一平衡后,测得M气体的浓度为0.5 mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3 mol/L。则平衡
,达一平衡后,测得M气体的浓度为0.5 mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3 mol/L。则平衡___________ (填“正向移动”、“逆向移动”或“不移动”),
___________ c(填“>”、“<”或“=”)。
(1)同温同压下,
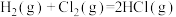 ,在光照和点燃条件下的
,在光照和点燃条件下的 (化学计量数相同)分别为
(化学计量数相同)分别为 、
、 ,
,
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)已知

 ,则稳定性:白磷
,则稳定性:白磷(3)
 是一种无色气体,遇到空气能发生爆炸性自燃,生成
是一种无色气体,遇到空气能发生爆炸性自燃,生成 和液态
和液态 。已知室温下1 g
。已知室温下1 g  自燃放出热量a kJ。
自燃放出热量a kJ。 自燃的热化学方程式为
自燃的热化学方程式为(4)将C、Al和
 按一定比例混合在高温下煅烧,所得物质可作导弹表面的耐高温材料:
按一定比例混合在高温下煅烧,所得物质可作导弹表面的耐高温材料: 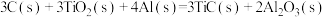
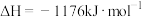 。则反应过程中,每转移1 mol
。则反应过程中,每转移1 mol 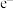 放出的热量为
放出的热量为(5)在密闭容器中,一定量混合气体发生下列反应:
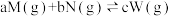 ,达一平衡后,测得M气体的浓度为0.5 mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3 mol/L。则平衡
,达一平衡后,测得M气体的浓度为0.5 mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3 mol/L。则平衡
您最近一年使用:0次



