下列有关电解质溶液的说法错误的是
A.加水稀释0.1 mol/LCH3COOH溶液,溶液中 增大 增大 |
B.加热CH3COONa溶液,溶液中 变小 变小 |
C.pH之和为14的盐酸与氨水等体积混合后,溶液中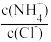 >1 >1 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 变大 变大 |
更新时间:2022-10-27 22:22:49
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】物质的量浓度均为0.1 mol/L的盐酸和醋酸溶液,下列说法正确的是( )
| A.两溶液加入等质量的锌粉,产生氢气的速率相同 |
B.两溶液中氢氧根离子浓度均为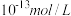 |
| C.加入醋酸钠固体,二者的pH均增大 |
| D.恰好完全反应时,两溶液消耗等浓度等体积的氢氧化钠 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】要使电离平衡HA  H+ + A-中的c(A-)/c(HA)增大,下列叙述不正确的是 ( )
H+ + A-中的c(A-)/c(HA)增大,下列叙述不正确的是 ( )
 H+ + A-中的c(A-)/c(HA)增大,下列叙述不正确的是 ( )
H+ + A-中的c(A-)/c(HA)增大,下列叙述不正确的是 ( )| A.升高溶液温度 | B.加入少量NaOH固体 |
| C.加水稀释 | D.加入HA浓溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】“劳动是一切幸福的源泉”,下列劳动项目与所述化学知识没有关联的是
| 选项 | 劳动项目 | 化学知识 |
| A | 用84消毒液进行环境消毒 | 含氯消毒剂具有氧化性 |
| B | 垃圾分类 | “可回收物”中的玻璃能被氢氟酸腐蚀 |
| C | 用热的纯碱溶液洗去油污 | 热的纯碱溶液能与油脂反应生成可溶于水的物质 |
| D | 用明矾净水 | 明矾水解产生的氢氧化铝胶体可使水中细小颗粒絮凝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列事实对应的化学用语不正确 的是
A.热的纯碱溶液清洗油污:CO +H2O +H2O HCO HCO +OH- +OH- |
B.0.1mol/L氨水的pH约为11.1:NH3·H2O NH NH +OH- +OH- |
| C.用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
D.明矾净水原理:Al3++3H2O Al(OH)3(胶体)+3H+ Al(OH)3(胶体)+3H+ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】根据下列实验操作和现象所得结论正确的是
| 实验操作和现象 | 实验结论 | |
| A | 室温下用pH试纸测0.1 mol/LNa2SO3溶液的pH约为10;0.1 mol/LNaHSO3溶液的pH约为5 | 结合H+的能力 比 比 的强 的强 |
| B | 向Na2S2O3溶液中滴加稀硫酸,将产生的气体通入溴水中,溴水褪色 | 该气体产物具有漂白性 |
| C | 向CuSO4溶液中加入KI溶液,再加入苯,振荡,静置,上层呈紫红色,下层有白色沉淀生成 | Cu2+可以氧化I-,白色沉淀可能为CuI |
| D | 将石蜡油蒸气通过炽热的碎瓷片,再将产生的气体通入酸性高锰酸钾溶液,紫色褪去 | 产生的气体一定是乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】NaH2A—Na2HA溶液是人体存在的缓冲溶液。常温下,H3A溶液中各微粒组成随着pH而变化,溶液中A3-、HA2-、H2A-、H3A浓度所占分数(δ)随pH变化的关系如图所示。
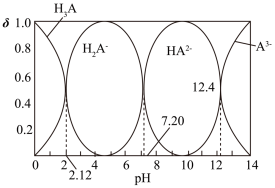
下列说法错误的是

下列说法错误的是
| A.0.1mol/LNaH2A溶液显酸性 |
| B.H3A+HA2—=2H2A—的平衡常数K=105.08 |
| C.将等物质的量的Na2HA和NaH2A配制成溶液,pH=7.20 |
| D.pH=12.40时,存在关系:c(H+)<2c(HA2—)+c(H2A—)+3c(A3—)+c(OH—) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是


| A.a点溶液中:c(H+)=6.0×10-3mol·L-1 |
| B.b点溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH) |
| C.c点溶液中:c(OH-)=c(CH3COOH)+ c(H+) |
| D.d点溶液中:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】在常温下,下列有关溶液中微粒的物质的量浓度关系不正确的是
| A.0.1mol/LpH=7.82的NH4HCO3溶液中:c (HCO3-) >c(NH4+) >c(OH-)> c(H+) |
| B.0.1mol/LNa2S溶液中:c(OH-) = c(H+)+c(HS-)+2c(H2S) |
| C.浓度均为0.1mol/L的NH3·H2O溶液和NH4Cl溶液等体积混合:c(NH4+) +c(H+)>c (NH3·H2O)+ c(OH-) |
| D.0.1mol/LNa2S溶液与NaHS溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在T℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知T℃时AgCl的Ksp=2×10 -10,下列说法不正确的是
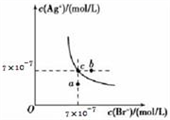

| A.在T℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr的饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是含AgBr的不饱和溶液 |
D.在T℃时,AgCl(s)+Br -(aq) AgBr(s)+Cl -(aq)的平衡常数K≈408 AgBr(s)+Cl -(aq)的平衡常数K≈408 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:25 ℃时,Mg(OH)2的Ksp=5.61×10−12,MgF2的Ksp=7.42×10−11。下列判断不正确的是
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)较小。 |
| B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大。 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol∙L−1的氨水中的Ksp与在20 mL 0.01 mol∙L−1 NH4Cl溶液中的Ksp相同,但前者的溶解度比后者小。 |
| D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2。 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列根据实验操作和现象和所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1 mol·L-1NaCl和NaI的混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或Ag+ |
| D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 CH3COO-+H+,下列叙述正确的是(
CH3COO-+H+,下列叙述正确的是(

