现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵;请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是
(3)已知T℃,KW=1×10-13,则T℃
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与bL该氢氧化钠溶液反应,恰好完全中和,两溶液的pH(x、y)的关系式为
(5)常温下,将浓度均为0.1 mol/L的醋酸溶液和氢氧化钠溶液混合后,若溶液的pH=7,则c(Na+)
相似题推荐
【推荐1】I.25℃时, 部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10⁻⁴mol·L⁻¹ | K₁=4.4×10-6mol•L⁻¹ K2=5.6×10-11mol•L-1 | 3.0×10-8mol·L⁻¹ |
请回答下列问题:
(1)同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是
(2)常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A. c(H⁺) 
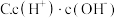

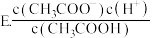
若该溶液升高温度,上述5种表达式的数据增大的是
(3)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL, 稀释过程pH变化如图:则HX的电离平衡常数

(4)已知100℃时,水的离子积为1×10⁻¹²,该温度下测得某溶液 pH=7,该溶液显
Ⅱ. NaHCO3是生活中常用的膨松剂, 也可作为抑酸剂, 更是一种重要的化工原料。
(5)为探究NaHCO3溶液的酸碱性,某同学用
 的电离程度
的电离程度(6)向 2 支盛有 10mL1.0mol/LNaHCO3溶液的试管中,分别加入 3mL0.1mol/L的 CaCl2、FeCl3溶液, 现象如下表:
| 加入CaCl2溶液 | 加入FeCl3溶液 |
现象 | 有白色沉淀产生 | 有红褐色沉淀、气泡产生 |
说明 CaCl2溶液 的电离;请写出 FeCl3溶液和 NaHCO3溶液反应的离子方程式
的电离;请写出 FeCl3溶液和 NaHCO3溶液反应的离子方程式
(7)请写出 NaHCO3的电离方程式
(1)已知t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若pH=3的H2SO4溶液中,由水电离出来的氢离子浓度为
②该温度下,若100 mLpH=a的H2SO4溶液与1 mLpH=b的NaOH溶液混合后溶液呈中性,则a+b=
(2)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
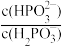 的是曲线
的是曲线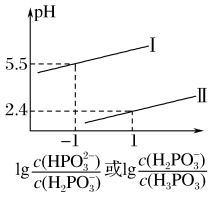
(3)将AlCl3溶液蒸干再灼烧,最后得到的主要固体物质是
(4)某燃料电池以氢氧化钠为电解质,C2H5OH为燃料,空气为氧化剂,铂为电极。
①负极的电极反应式为
②正极的电极反应式为
(1)除去
 固体中混有
固体中混有 的方法(用化学方程式表示)
的方法(用化学方程式表示)(2)已知:常温下,
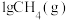 在足量的氧气中完全燃烧时放出55.6kJ热量,请写出表示
在足量的氧气中完全燃烧时放出55.6kJ热量,请写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:(3)25℃,某
 溶液中
溶液中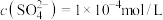 ,则该溶液中
,则该溶液中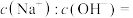
(4)判断
 反应的自发性,并说明理由
反应的自发性,并说明理由 )、氨气等。回答下列问题:
)、氨气等。回答下列问题:(1)工业上用
 和
和 反应合成甲醚:
反应合成甲醚: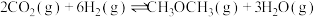
 在催化剂存在的恒容密闭容器里,保持
在催化剂存在的恒容密闭容器里,保持 、
、 初始加入量不变,测得在不同温度下,反应相同的时间,容器内
初始加入量不变,测得在不同温度下,反应相同的时间,容器内 的物质的量与温度的关系如图1所示。
的物质的量与温度的关系如图1所示。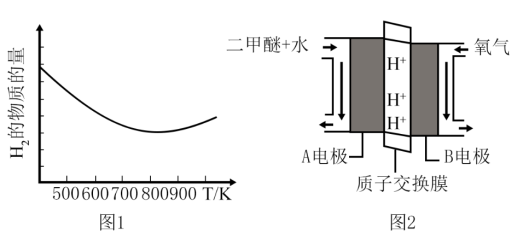
①氢气的物质的量在温度高于800后增大的可能原因是
②“直接二甲醚(
 )燃料电池”被称为绿色电源,其工作原理如图2所示,正极为
)燃料电池”被称为绿色电源,其工作原理如图2所示,正极为(2)工业上常用氨水吸收二氧化硫,可生成
 。判断常温下
。判断常温下 溶液呈
溶液呈 的
的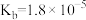 ;
; 的
的 ;
; )
)(3)一定条件下,
 与
与 可合成尿素
可合成尿素 :
: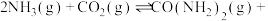
 。某温度下,在容积为1 L的恒容密闭容器中,按不同氨碳比加入总量为3 mol的
。某温度下,在容积为1 L的恒容密闭容器中,按不同氨碳比加入总量为3 mol的 和
和 混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图3所示。其中,曲线c表示尿素在平衡体系中的体积百分比。
混合气体发生反应。反应达到平衡时有关量随氨碳比的变化曲线如图3所示。其中,曲线c表示尿素在平衡体系中的体积百分比。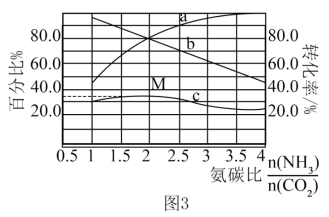
①表示
 转化率的曲线是
转化率的曲线是②M点对应的百分比为

(1)a点溶液中c(H+)为
(2)a、b、c、d四点中水的电离程度最大的是
(3)下列操作中可能使所测CH3COOH溶液的浓度数值偏低的是
| A.酸式滴定管未用待测溶液润洗 |
| B.锥形瓶用待测溶液润洗 |
| C.放出酸液的滴定管开始有气泡,放出液体后气泡消失 |
| D.碱式滴定管滴定前有气泡,滴定终点时气泡消失 |
E.碱式滴定管滴定前读数正确,滴定后俯视读数
(4)若向20ml稀氨水中逐滴加入等浓度的盐酸,下列变化趋势正确的是


(1)D溶液为
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率v(A)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈
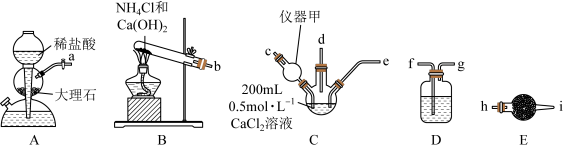
请回答下列问题:
(1)仪器甲的名称是
(2)将上述接口连接顺序补充完整:a
 ;b
;b ;d
;d 。
。(3)装置D中选择的试剂是
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO
 )/c(CO
)/c(CO )的值(x)的取值范围为
)的值(x)的取值范围为
(1)在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成。已知常温下,Al(OH)3浊液的pH=3,其Ksp=1×10-36,则其中c(Al3+)=
(2)生产流程中所得滤液的主要成分为
(3)假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%,试通过计算确定该分子筛的化学式
(4)分子筛的孔道直径为4Å称为4A型分子筛;当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65Å)和异丁烷(分子直径为5.6Å)应该选用
 )有重要作用,以氯磷灰石(主要成分为
)有重要作用,以氯磷灰石(主要成分为 ,还含有少量
,还含有少量 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
已知:①
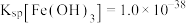
②
 与
与 均难溶于水,
均难溶于水, 能溶于水。
能溶于水。(1)“酸浸”时发生的化学反应为
 (浓)
(浓) ,该反应体现了浓硫酸的
,该反应体现了浓硫酸的(2)反应Ⅱ的化学方程式为
(3)滤渣的成分为
 mol⋅L
mol⋅L 时表明沉淀完全,计算
时表明沉淀完全,计算 完全沉淀时的
完全沉淀时的
(4)以熔融碳酸钠燃料电池(图1)为电源,
 可通过图2装置电解制备:
可通过图2装置电解制备: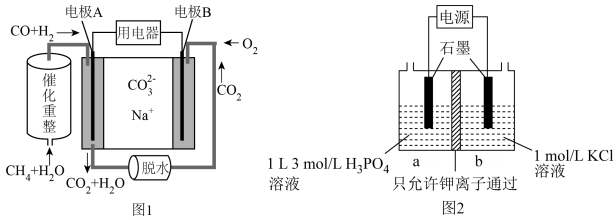
①燃料电池(图1)中电极A上
 参与的电极反应式为
参与的电极反应式为②电解池中若通电前a、b两室溶液的质量相等,若有
 个
个 通过交换膜,则两室溶液的质量差为
通过交换膜,则两室溶液的质量差为


