氯化铜晶体( )中含有
)中含有 杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
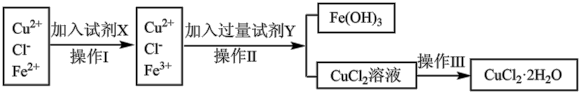
请参照下表给出的数据填空。
(1)操作I加入X的目的是___________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)___________。
(3)操作Ⅱ的Y试剂(氧化物)为___________ (填化学式);并调节溶液的pH在___________ 范围。
(4)实验室在配制 溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)
溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)___________ 。
(5)若将 溶液蒸干灼烧,得到的固体是
溶液蒸干灼烧,得到的固体是___________ (填化学式);若要得无水 ,请简述操作方法
,请简述操作方法___________ 。
(6)室温下 、
、 的
的 分别约为
分别约为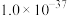 、
、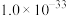 若要使溶液B中
若要使溶液B中 降低至
降低至 ,必须将溶液调节至pH
,必须将溶液调节至pH___________ 。在该温度下的 和
和 的混合悬浊液中,
的混合悬浊液中,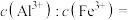
___________ 。
 )中含有
)中含有 杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| 4.7 | 6.7 |
| 7.0 | 9.0 |
| 1.9 | 3.2 |
(1)操作I加入X的目的是
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)___________。
A. | B. | C.NaClO | D. |
(4)实验室在配制
 溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)
溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示)(5)若将
 溶液蒸干灼烧,得到的固体是
溶液蒸干灼烧,得到的固体是 ,请简述操作方法
,请简述操作方法(6)室温下
 、
、 的
的 分别约为
分别约为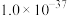 、
、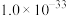 若要使溶液B中
若要使溶液B中 降低至
降低至 ,必须将溶液调节至pH
,必须将溶液调节至pH 和
和 的混合悬浊液中,
的混合悬浊液中,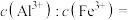
更新时间:2022-12-04 20:01:19
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
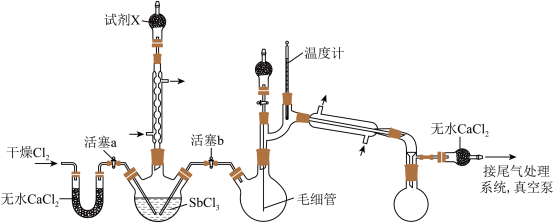
【推荐1】超酸是一类比纯硫酸更强的酸。某兴趣小组的同学对超酸 HSbF6 的制备及性质进行了探究。制备 HSbF6 的初始实验装置如图,夹持、加热及搅拌装置略。
已知:①制备 HSbF6 的反应为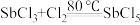 ,
,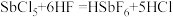 。
。
②有关物质的性质如表。
回答下列问题:
(1)试剂 X 的成分是________ (填化学名称)。
(2)毛细管的作用是_________ 。
(3)若无盛试剂 X 的装置,SbCl3可能发生水解生成 Sb2O3,其水解反应的化学方程式为_________ 。
(4)先关闭活塞 a,用真空泵抽气将 SbCl5 转移至双口烧瓶,再减压蒸馏而不是常压蒸馏的主要原因是_________ 。
(5)由 SbCl5 制备 HSbF6 时,应选用______材质的仪器。(填标号)
(6)为更好地理解超酸的强酸性,该小组的同学查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸反应: ,以此类推,H2SO4与 HSbF6 反应的化学方程式为
,以此类推,H2SO4与 HSbF6 反应的化学方程式为___________ 。

已知:①制备 HSbF6 的反应为
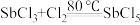 ,
,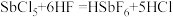 。
。②有关物质的性质如表。
| 物质 | 熔点 | 沸点 | 性质 |
| SbCl3 | 73.4℃ | 223.5℃ | 极易水解 |
| SbCl5 | 2.8℃ | 140℃分解,79℃/2.9kPa | 极易水解 |
(1)试剂 X 的成分是
(2)毛细管的作用是
(3)若无盛试剂 X 的装置,SbCl3可能发生水解生成 Sb2O3,其水解反应的化学方程式为
(4)先关闭活塞 a,用真空泵抽气将 SbCl5 转移至双口烧瓶,再减压蒸馏而不是常压蒸馏的主要原因是
(5)由 SbCl5 制备 HSbF6 时,应选用______材质的仪器。(填标号)
| A.玻璃 | B.陶瓷 | C.铁或铝 | D.聚四氟乙烯 |
(6)为更好地理解超酸的强酸性,该小组的同学查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸反应:
 ,以此类推,H2SO4与 HSbF6 反应的化学方程式为
,以此类推,H2SO4与 HSbF6 反应的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO 与水反应的方程式为:4FeO
与水反应的方程式为:4FeO + 10H2O
+ 10H2O  4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是
4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是________ 。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________ 。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO 在水溶液中的存在形态如右图所示。下列说法正确的是
在水溶液中的存在形态如右图所示。下列说法正确的是______ (填字母)。
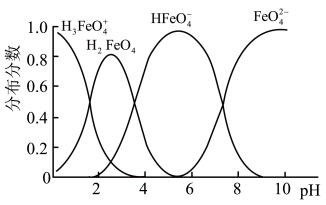
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO 的分布分数先增大后减小
的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO +H2O
+H2O
D.pH约为2.5 时,溶液中H3FeO 和HFeO
和HFeO 比例相当
比例相当
(4)HFeO
 H++FeO
H++FeO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=______________ ,其数值接近_______ (填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO )完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________ 。
(1)FeO
 与水反应的方程式为:4FeO
与水反应的方程式为:4FeO + 10H2O
+ 10H2O  4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是
4Fe(OH)3 + 8OH-+ 3O2↑,K2FeO4在处理水的过程中所起的作用是(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO
 在水溶液中的存在形态如右图所示。下列说法正确的是
在水溶液中的存在形态如右图所示。下列说法正确的是
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO
 的分布分数先增大后减小
的分布分数先增大后减小C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO
 +H2O
+H2OD.pH约为2.5 时,溶液中H3FeO
 和HFeO
和HFeO 比例相当
比例相当(4)HFeO

 H++FeO
H++FeO 的电离平衡常数表达式为K=
的电离平衡常数表达式为K=A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO
 )完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某实验小组对 与
与 的反应进行探究。
的反应进行探究。
【实验前的预测】
(1)甲同学认为配制 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:_______ 。
(2)乙同学分析 溶液中的微粒组成认为:
溶液中的微粒组成认为:
①溶液含 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且
你认为乙同学观点正确的是_______ (填序号)。
丙同学根据物质的价态预测 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
(4)两溶液接触的反应
在 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。
甲同学认为实验III红褐色的“溶液”可能是氢氧化铁胶体,他用_______ 实验证实了推测。
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
① 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。
②当 时水解反应占主导地位。
时水解反应占主导地位。
你同意他们的哪些观点_______ (填序号,若均不同意则填无)。此外,若兼顾化学反应速率和化学反应限度两个角度,你还能得出什么结论:_______ 。
 与
与 的反应进行探究。
的反应进行探究。【实验前的预测】
(1)甲同学认为配制
 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:(2)乙同学分析
 溶液中的微粒组成认为:
溶液中的微粒组成认为:①溶液含
 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且

你认为乙同学观点正确的是
丙同学根据物质的价态预测
 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
| 装置 | 实验现象 | 相关探究 |
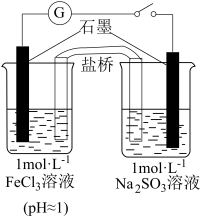 | 闭合开关后灵敏电流计指针发生偏转 | ①写出负极的电极反应式为 ②探究正极产物的实验方案为 |
在
 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。| 实验编号 |  | 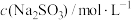 | 实验现象 |
| I | 1.0 | 1.0 | 溶液由橘黄色变为红褐色并有沉淀生成,振荡后沉淀消失。继续滴加 ,溶液颜色加深,放置一小时后溶液变为绿色 ,溶液颜色加深,放置一小时后溶液变为绿色 |
| II | 1.0 | 0.1 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液变为黄色 ,溶液颜色加深,放置一小时后溶液变为黄色 |
| III | 0.1 | 1.0 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 |
| IV | 0.1 | 0.1 | 溶液由橘黄色变为红色,没有沉淀生成,继续滴加 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 |
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
①
 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。②当
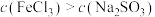 时水解反应占主导地位。
时水解反应占主导地位。你同意他们的哪些观点
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因_______ 。
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
①根据表中数据,将pH=2的下列四种酸的溶液分别稀释100倍,pH变化最小的是_______ 。
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是_______ 。(填字母)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
①若向该溶液中滴加NaOH溶液,则离子沉淀先后顺序是_______ (填离子符号)。
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=_______ 时,溶液中Cu2+沉淀完全。[已知1g2=0.3]
③下列说法不正确的是_______ (填字母)。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(1)配制FeCl3溶液时,需将固体溶于较浓的盐酸后按需要进行稀释,用离子方程式解释其原因
(2)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如下表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A. HCN B. HClO C. H2CO3 D. CH3COOH
②根据以上数据,判断下列反应可以成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2
(3)已知在Cu2+、Mg2+、Fe2+浓度相同的溶液中,其开始沉淀时的pH如下:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
②已知Ksp[Cu(OH)2]=2.5×10-20,若向该溶液中加入生石灰调节其pH,当pH=
③下列说法不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
B.一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
C.除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某同学实验室研究 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。
(1)配制 溶液
溶液
称取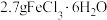 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
①配制的溶液不显黄色而显红褐色,原因是___________ ;若要获得黄色 溶液,改进配制方法是
溶液,改进配制方法是___________ 。
②配制溶液时没有使用容量瓶,所得溶液___________ (填“能”或“不能”)满足本实验要求。
(2)探究
“实验I”振荡后的现象是___________ ;用离子方程式解释该现象___________ 。
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物, ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。
为了进一步确定白色沉淀的成分,补充如下实验:
在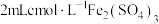 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
①c=_______ ,依据该实验可知白色沉淀一定含有_________ 。
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.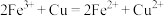 ;
;
ii.___________ 。
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:_____ 。
 时,进行了以下实验,回答有关问题。
时,进行了以下实验,回答有关问题。(1)配制
 溶液
溶液称取
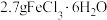 晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。
晶体溶解在盛有100mL蒸馏水的烧杯中,搅拌均匀即可制得。①配制的溶液不显黄色而显红褐色,原因是
 溶液,改进配制方法是
溶液,改进配制方法是②配制溶液时没有使用容量瓶,所得溶液
(2)探究

| 序号 | 实验步骤 | 实验现象 |
| I | 在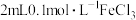 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铁粉,振荡。 溶液,再加入足量铁粉,振荡。 | 溶液变为血红色,振荡后… |
| II | 在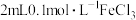 溶液中,加入3滴 溶液中,加入3滴 溶液,再加入足量铜粉,振荡。 溶液,再加入足量铜粉,振荡。 | 溶液变为血红色,振荡后红色褪去,产生白色沉淀。 |
(3)探究实验II中白色沉淀的成分
查阅资料:CuCl、CuSCN均为白色难溶物,
 ,
, ,
, 与卤素离子性质相似。
与卤素离子性质相似。为了进一步确定白色沉淀的成分,补充如下实验:
在
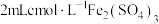 溶液中,加入3滴
溶液中,加入3滴 溶液,再加入足量铜粉,振荡,实验现象与“II”相同。
溶液,再加入足量铜粉,振荡,实验现象与“II”相同。①c=
②该实验中产生白色沉淀的反应分两步,请写出第二步反应的离子方程式。
i.
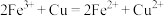 ;
; ii.
③依据以上实验,仍无法确定白色沉淀的组成;还需要将“补充实验”所得混合物进一步实验,即可得出结论。简述操作步骤:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】电子工业中,人们常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。某项目学习小组设计如下流程处理废液和资源回收:
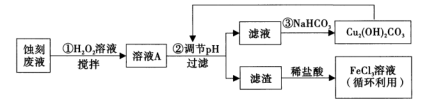
(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是___________ ;将FeCl3溶液蒸干、灼烧后,得到的主要固体产物是___________ 。
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有___________ (填离子符号)。
(3)步骤①中加入H2O2溶液的目的是___________ 。 (用离子方程式表示)。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是___________ 。
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式___________ 。
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为___________ (用字母表示,列出表达式即可)。

(1)FeCl3溶液中通常加入一定量的盐酸,其加入盐酸的目的是
(2)用足量FeCl3溶液蚀刻铜箔后的废液中含有的金属阳离子有
(3)步骤①中加入H2O2溶液的目的是
(4)已知:生成氢氧化物沉淀的pH
| Cu( OH)2 | Fe(OH)2 | Fe( OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)步骤③中,由于NaHCO3部分水解生成Cu2(OH)2CO3沉淀和CO2气体,写出其反应的离子方程式
(6)步骤③中生成的Cu2(OH)2CO3中会混有少量CuCO3取样品w g,测得n(Cu)=a mol, 则Cu2(OH)2CO3的纯度为
您最近一年使用:0次
【推荐1】金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。请回答下列问题:
①试推测,在金属系列中,钛属于______ (填“较活泼”或“较不活泼”)的金属,金属钛耐腐蚀可能原因是___________ 。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为___________ 。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化,有关氢氧化物开始沉淀的pH如表:
某地钛铁矿的主要成分为FeTiO3,含有少量杂质Al2O3、SiO2,提纯TiO2并得到副产品绿矾(FeSO4·7H2O)的工艺流程如图所示:
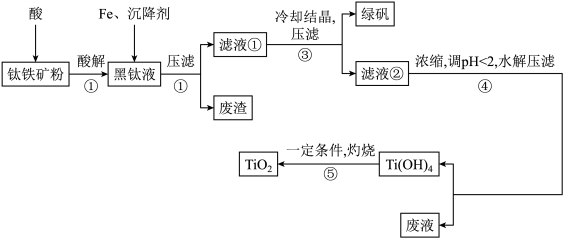
黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式:________ ;加入Fe的目的是________ ;步骤④生成Ti(OH)4的离子方程式:________ 。
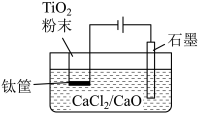
(3)钛冶炼的新法是电解法,下图是一种电解制钛的工艺(OS法)示意图,CaC12/CaO共熔体作为介质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式________ 。
(4)我国科学最新研发的技术——固体透氧膜提取金属钛SOM工艺见下图:将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阳极通入H2,则阳极电极反应式为_____ 。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。请回答下列问题:
①试推测,在金属系列中,钛属于
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化,有关氢氧化物开始沉淀的pH如表:
| 氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
| pH | 0.5 | 3.0 | 1.5 | 7.6 |
某地钛铁矿的主要成分为FeTiO3,含有少量杂质Al2O3、SiO2,提纯TiO2并得到副产品绿矾(FeSO4·7H2O)的工艺流程如图所示:

黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式:
(3)钛冶炼的新法是电解法,下图是一种电解制钛的工艺(OS法)示意图,CaC12/CaO共熔体作为介质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式

(4)我国科学最新研发的技术——固体透氧膜提取金属钛SOM工艺见下图:将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阳极通入H2,则阳极电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:________________________________
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是__________________
(3)在一定温度下,有a盐酸,b硫酸,c醋酸三种酸。(填序号 )
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_______________ 。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是____________ 。
③当三者c(H+)相同时,物质的量浓度由大到小的顺序为____________________ 。
(4)难溶电解质的水溶液中存在着溶解平衡。已知:在常温下, K sp [Cu(OH)2]=2.0×10-20写出Cu(OH)2溶度积常数表达式___________________________________ 当溶液中各离子浓度系数次方的乘积大于溶度积时,则产生沉淀,反之沉淀溶解。某CuSO4溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 _______________ 才能达到目的。
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)在一定温度下,有a盐酸,b硫酸,c醋酸三种酸。(
①当其物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
③当三者c(H+)相同时,物质的量浓度由大到小的顺序为
(4)难溶电解质的水溶液中存在着溶解平衡。已知:在常温下, K sp [Cu(OH)2]=2.0×10-20写出Cu(OH)2溶度积常数表达式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。
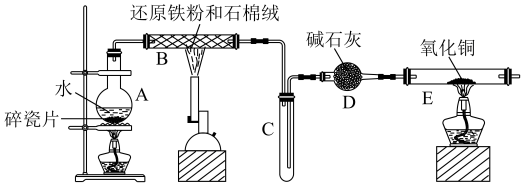
(1)装置B中发生反应的化学方程式是___________ 。
(2)装置E中的现象是___________ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法___________ 。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤I中通入Cl2的作用是___________ 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________ 。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)。___________ ;
高铁酸盐有极强的氧化性,是水处理中很好的试剂。低温下,往Na2FeO4溶液中加入KOH可析出K2FeO4。
(5)写出上述反应的化学方程式___________ 。
(6)配平化学方程式:__________
___________Na2FeO4+___________H2SO4=___________Fe2(SO4)3+___________O2+___________Na2SO4+___________H2O
若反应中产生了3.36L(标态下)O2,则转移电子数目是___________ 。
(7)在Fe2(SO4)3溶液中滴入NaHSO3溶液中n(SO )
)___________ (增大,减小,不变),则原因是___________ 。

(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液
 FeCl3溶液
FeCl3溶液 FeCl3·6H2O晶体
FeCl3·6H2O晶体①步骤I中通入Cl2的作用是
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)。
高铁酸盐有极强的氧化性,是水处理中很好的试剂。低温下,往Na2FeO4溶液中加入KOH可析出K2FeO4。
(5)写出上述反应的化学方程式
(6)配平化学方程式:
___________Na2FeO4+___________H2SO4=___________Fe2(SO4)3+___________O2+___________Na2SO4+___________H2O
若反应中产生了3.36L(标态下)O2,则转移电子数目是
(7)在Fe2(SO4)3溶液中滴入NaHSO3溶液中n(SO
 )
)
您最近一年使用:0次
【推荐1】铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿(主要成分是Fe(CrO2)2,Cr元素为+3价。含少量MgCO3、Al2O3、SiO2等杂质)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如图:

已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO 形式存在且易被氧化。
形式存在且易被氧化。
(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成__ 。
(2)若省略“过滤2”步骤,产品中可能混有__ (写化学式)。
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为__ 。
(4)制取铬酸钠后的酸性废水中含有Cr2O ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为__ ;沉降Cr3+的离子方程式为__ ,该反应的K=__ (列出计算式)。(已知Ksp[Ca(OH2)]=8×10-6,Ksp[Cr(OH)3]=6.3×10-31)
(5)产品铬酸钠可用如图所示方法冶炼铬。
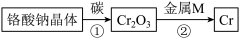
②的化学方程式为__ ,在实验室中引发该反应用到的两种药品是__ (填化学式)。

已知:+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO
 形式存在且易被氧化。
形式存在且易被氧化。(1)如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成
(2)若省略“过滤2”步骤,产品中可能混有
(3)流程中两次使用了H2O2进行氧化,第二次氧化时反应的离子方程式为
(4)制取铬酸钠后的酸性废水中含有Cr2O
 ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性Cr2O 溶液形成原电池,使Cr2O
溶液形成原电池,使Cr2O 转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为
转化为Cr3+,再用石灰乳对Cr3+进行沉降。该电池的正极反应式为(5)产品铬酸钠可用如图所示方法冶炼铬。

②的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。

回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为___________ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素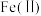 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;再加入石灰乳,所得滤渣中主要成分是 、
、___________ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是___________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是___________ 。

(4)①将“钴镍渣”酸溶后,先加入 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成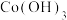 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②若“镍钴分离”后溶液中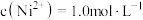 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中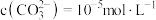 ,则沉镍率=
,则沉镍率=___________ 。[已知: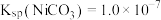 ,沉镍率
,沉镍率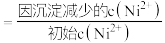 ]
]
 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
回答下列问题:
(1)工业上用一定浓度的硫酸浸取己粉碎的镍钴矿,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),其中S元素的化合价为
(3)已知:
 的电离方程式为
的电离方程式为 、
、
①氧化时,先通入足量混合气,溶液中的正二价铁元素
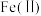 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是
(4)①将“钴镍渣”酸溶后,先加入
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成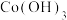 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
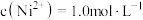 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中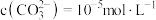 ,则沉镍率=
,则沉镍率=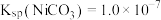 ,沉镍率
,沉镍率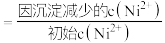 ]
]
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
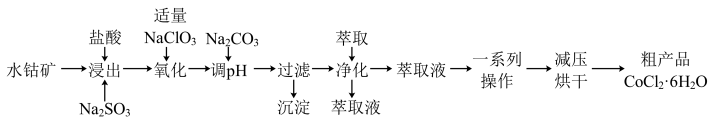
已知:①CoCl2·6H2O熔点为86℃,加热至110~120℃时,易分解。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01mol/L)
(1)已知氧化性Co3+ >Fe3+,浸出液中含有的阳离子主要有H+、___________ 、Na+、Fe2+、Mn2+、Al3+等。
(2)在“氧化”步骤中,发生的主要离子反应方程式为___________ 。
(3)加Na2CO3调pH可得到两种沉淀,则pH最佳范围是___________ 。
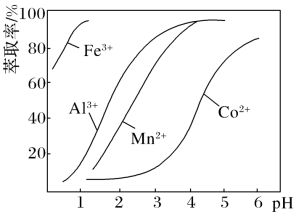
(4)已知萃取剂对金属离子的萃取率与pH的关系如图。控制溶液pH为3.0~3.5,则加入萃取剂的目的是除去___________ 。
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________ 。为测定粗产品中CoCl2·6H2O含量,称取3.00 g的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量为2.87g,则粗产品中CoCl2·6H2O的质量分数为___________ (结果保留三位有效数字)。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是___________(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20℃时的颜色及Ksp值如下表:

已知:①CoCl2·6H2O熔点为86℃,加热至110~120℃时,易分解。
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)在“氧化”步骤中,发生的主要离子反应方程式为
(3)加Na2CO3调pH可得到两种沉淀,则pH最佳范围是
(4)已知萃取剂对金属离子的萃取率与pH的关系如图。控制溶液pH为3.0~3.5,则加入萃取剂的目的是除去

(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是___________(填选项,忽略亚钴离子的颜色干扰)。已知几种物质在20℃时的颜色及Ksp值如下表:
| 化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 1.0×10-12 | 2.0 ×10-48 | 2.0×10-12 |
| A.KCl | B.KSCN | C.K2CrO4 | D.K2S |
您最近一年使用:0次






