 (重铬酸钾)是一种重要的化工原料。某兴趣小组用铬铁矿(主要成分是
(重铬酸钾)是一种重要的化工原料。某兴趣小组用铬铁矿(主要成分是 )为原料制备
)为原料制备 的流程如下:
的流程如下: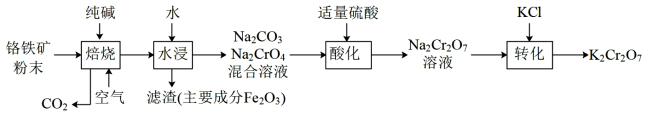
(1)将铬铁矿粉碎的目的是
(2)常温下,铬酸
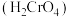 的电离常数:
的电离常数: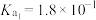 ,
,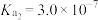 。
。
 溶液显碱性的原因是
溶液显碱性的原因是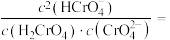
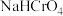 溶液显
溶液显(3)该小组用滴定法准确测得产品中
 的质量分数为96.5%。某同学还用分光光度法测定产品纯度(
的质量分数为96.5%。某同学还用分光光度法测定产品纯度( 溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制
溶液的吸光度与其浓度成正比例),但测得的质量分数明显偏低。分析其原因,发现配制 待测水溶液时少加了一种试剂。该试剂是
待测水溶液时少加了一种试剂。该试剂是(4)以
 标准液滴定溶液中的
标准液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 与
与 反应生成砖红色沉淀指示滴定终点。当溶液中的
反应生成砖红色沉淀指示滴定终点。当溶液中的 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 )时,溶液中
)时,溶液中
 ,
,
 (保留两位有效数字)。(已知25℃时
(保留两位有效数字)。(已知25℃时 、
、 的
的 分别为
分别为 、
、 )
)
更新时间:2022-12-13 20:52:20
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】KIO3是一种无色易溶于水的晶体,医药上可作防治地方甲状腺肿的药剂,目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:

(1)检验“含碘废水”中含有的单质I2,常用的试剂是______ 。
(2)进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加______ 盐溶液来检验其是否已洗涤干净。
(3)“滤渣2”的成分为______ (填化学式)。
(4)“制KI”时,发生反应的化学方程式为______ 。
(5)江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32—=2I-+S4O62—。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)_____ 。
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据______ 。

(1)检验“含碘废水”中含有的单质I2,常用的试剂是
(2)进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤过滤滤液中可通过滴加
(3)“滤渣2”的成分为
(4)“制KI”时,发生反应的化学方程式为
(5)江苏食用加碘盐新标准是每千克食盐中碘元素含量为25毫克(波动范围为18~33mg/kg)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4mol·L-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32—=2I-+S4O62—。
①计算该食盐试样中碘元素的含量(单位mg/kg,写出计算过程)
②该食盐试样是否符合江苏食用加碘盐新标准,并说明判断依据
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】已知:高锰酸钾易溶于水,具有强氧化性。某实验室配制 高锰酸钾溶液,并用其测定某绿矾样品中
高锰酸钾溶液,并用其测定某绿矾样品中 的含量。
的含量。
(1)计算所需 固体的质量为
固体的质量为_________ g(保留3位有效数字)
(2)将C和E的实验操作补充完整,然后写出配制的正确操作顺序_________ (字母表示,每个字母只能用一次)。
A.用蒸馏水洗涤烧杯及玻璃棒 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡
B.用电子天平称取一定质量的 固体,加适量蒸馏水,使其充分溶解
固体,加适量蒸馏水,使其充分溶解
C.将已冷却至室温的 溶液沿玻璃棒注入___________中
溶液沿玻璃棒注入___________中
D.将容量瓶塞盖紧,颠倒摇匀
E.改用___________加蒸馏水,至溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线 处
处
实验操作补充完整C:____________ ,E:____________ 。
(3)若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是________ (填字母)。
A.配制前,容量瓶中有量蒸馏水 B.定容时仰视刻度线
C.加蒸馏水时不慎超过了刻度线 D.定容时俯视刻度线
E.定容后将容量瓶塞盖紧颠倒摇匀后,发现液面低于刻度线;又滴加蒸馏水至刻度线
(4)取任意体积的高锰酸钾溶液,下列物理量不随所取体积的多少而变化的是___________。(填字母)
(5)含量测定:准确称取绿矾样品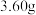 于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加配制好的高锰酸钾溶液,请填写并配平该反应的离子方程式:
于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加配制好的高锰酸钾溶液,请填写并配平该反应的离子方程式:__________________

当恰好完全反应时,消耗高锰酸钾溶液的体积为 。列式计算该样品中
。列式计算该样品中 的含量
的含量___________ (结果用百分数表示,保留一位小数)。已知: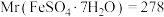 。
。
 高锰酸钾溶液,并用其测定某绿矾样品中
高锰酸钾溶液,并用其测定某绿矾样品中 的含量。
的含量。(1)计算所需
 固体的质量为
固体的质量为(2)将C和E的实验操作补充完整,然后写出配制的正确操作顺序
A.用蒸馏水洗涤烧杯及玻璃棒
 次,洗涤液均注入容量瓶,振荡
次,洗涤液均注入容量瓶,振荡B.用电子天平称取一定质量的
 固体,加适量蒸馏水,使其充分溶解
固体,加适量蒸馏水,使其充分溶解C.将已冷却至室温的
 溶液沿玻璃棒注入___________中
溶液沿玻璃棒注入___________中D.将容量瓶塞盖紧,颠倒摇匀
E.改用___________加蒸馏水,至溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线
 处
处实验操作补充完整C:
(3)若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是
A.配制前,容量瓶中有量蒸馏水 B.定容时仰视刻度线
C.加蒸馏水时不慎超过了刻度线 D.定容时俯视刻度线
E.定容后将容量瓶塞盖紧颠倒摇匀后,发现液面低于刻度线;又滴加蒸馏水至刻度线
(4)取任意体积的高锰酸钾溶液,下列物理量不随所取体积的多少而变化的是___________。(填字母)
A.溶液中 的物质的量 的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
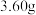 于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加配制好的高锰酸钾溶液,请填写并配平该反应的离子方程式:
于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加配制好的高锰酸钾溶液,请填写并配平该反应的离子方程式:
当恰好完全反应时,消耗高锰酸钾溶液的体积为
 。列式计算该样品中
。列式计算该样品中 的含量
的含量 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】在测定某铁矿石中的含铁量时,可准确称取2.0g铁矿石溶解在酸溶液里,然后把其中的Fe3+还原成Fe2+,制得100mL待测液,再取出10mL该待测液于锥形瓶中,然后用0.020mol·L-1的KMnO4标准溶液进行滴定,发生反应的离子方程式如下:Fe2++MnO4-+ 8H+ = 5Fe3++Mn2++4H2O , 滴定结果平均消耗KMnO4溶液的体积刚好等于下图中所示的消耗KMnO4溶液的体积,试回答下列问题:
(1)把待测液中的Fe3+还原成Fe2+,应选用下列试剂____________ , 充分反应再进行过滤、洗涤,将洗涤液并入待测液中。
A.氯水 B. H2O2 C. Fe屑 D. Cu
(2)滴定开始和结束时,滴定管中的液面如图所示,则终点读数为______________ mL

滴定过程中,用左手控制滴定管活塞,边滴边摇动锥形瓶,眼睛应注视______________________________ ,直至滴定终点。判断到达终点的现象是___________________________________________________________________________________
(3)下列操作会使测得样品中铁的质量分数偏高的是__________
A.滴定管用蒸馏水洗涤后,直接加入高锰酸钾标准溶液进行滴定。
B.锥形瓶用蒸馏水洗涤后,水未倒尽,就加入待测液进行滴定。
C.记录测定结果时,滴定前仰视液凹面最低处,滴定到达终点时又俯视读数。
(4)如果矿石是用盐酸溶解配制成待测液,则测定的结果矿石中含铁量______________ (填偏高、偏低、无影响),原因是_________________________________________
(5)矿石中含铁的质量分数为_________________ (已知铁的原子量为56)
(1)把待测液中的Fe3+还原成Fe2+,应选用下列试剂
A.氯水 B. H2O2 C. Fe屑 D. Cu
(2)滴定开始和结束时,滴定管中的液面如图所示,则终点读数为

滴定过程中,用左手控制滴定管活塞,边滴边摇动锥形瓶,眼睛应注视
(3)下列操作会使测得样品中铁的质量分数偏高的是
A.滴定管用蒸馏水洗涤后,直接加入高锰酸钾标准溶液进行滴定。
B.锥形瓶用蒸馏水洗涤后,水未倒尽,就加入待测液进行滴定。
C.记录测定结果时,滴定前仰视液凹面最低处,滴定到达终点时又俯视读数。
(4)如果矿石是用盐酸溶解配制成待测液,则测定的结果矿石中含铁量
(5)矿石中含铁的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】25 ℃时,三种酸的电离平衡常数如下:
(1)下列四种离子结合H+的能力由大到小的顺序是_______ (填编号)
a.CO b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(2)下列反应不能发生的是:_______ (填编号)
a.CO + CH3COOH=CH3COO-+ CO2↑+ H2 O
+ CH3COOH=CH3COO-+ CO2↑+ H2 O
b.ClO-+ CH3COOH=CH3COO-+ HClO
c.CO + HClO=HCO
+ HClO=HCO + ClO-
+ ClO-
d.2ClO- + CO2 + H2O=CO + 2HClO
+ 2HClO
(3)用蒸馏水稀释0.10 mol·L-1 的醋酸,则下列各式表示的数值随水量的增加而增大 的是 _______(填编号)
(4)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1 Ba(OH)2 溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:

①原混合溶液中c(H+)=_______ ;c(Cl-)=_______
②A点的pH=_______
(5)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是_______

(6)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va_______ Vb(填“>”、“<”或“=”)
| 化学式 | CH3 COOH | H2 CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)下列四种离子结合H+的能力由大到小的顺序是
a.CO
 b.ClO- c.CH3COO- d.HCO
b.ClO- c.CH3COO- d.HCO
(2)下列反应不能发生的是:
a.CO
 + CH3COOH=CH3COO-+ CO2↑+ H2 O
+ CH3COOH=CH3COO-+ CO2↑+ H2 O b.ClO-+ CH3COOH=CH3COO-+ HClO
c.CO
 + HClO=HCO
+ HClO=HCO + ClO-
+ ClO-d.2ClO- + CO2 + H2O=CO
 + 2HClO
+ 2HClO(3)用蒸馏水稀释0.10 mol·L-1 的醋酸,则下列各式表示的数值随水量的增加而增大 的是 _______(填编号)
A. | B. | C. | D. |

①原混合溶液中c(H+)=
②A点的pH=
(5)25 ℃时,向pH均为1的盐酸和醋酸溶液中分别加水,随加水量的增多,两溶液pH的变化如图所示,则符合盐酸pH变化的曲线是

(6)25 ℃时,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】食醋(主要成分CH3COOH )、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:CH3COOH、H2CO3、HNO2的电离常数(25℃)分别为Ka=1.8×10-5;Ka1=4.3×10-7、Ka2=5.6×10-11;Ka=5.0×10-4请回答下列问题:
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____ (填代号。)
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=____
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是_______ (填写序号);

⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示 ,则HX的电离平衡常数
,则HX的电离平衡常数______ (填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =___________
⑴一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)·c(H+)不变
⑵25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中:
c(CH3COO-)/c(CH3COOH)=
⑶常温下,将20mL 0.1mol/L CH3COOH溶液 和20mL 0.1mol/LHNO2 溶液分别与 20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,则表示CH3COOH溶液的曲线是

⑷体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示
 ,则HX的电离平衡常数
,则HX的电离平衡常数⑸25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3·H2O的电离常数Kb =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】已知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-akJ·mol-1(a>0)
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.__ ΔH2=__ kJ·mol-1(用含a和b的代数式表示)
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图___ 。

(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2⇌H++HO2-;HO2-⇌H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈__ 。(忽略H2O2的二级电离及水的电离)。
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度 ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是__ ,原因是__ 。
A. B.
B.
C. D.
D.
(1)KI溶液可作为H2O2分解反应的催化剂,催化过程按以下两步反应进行:
Ⅰ.H2O2(l)+I-(aq)=H2O(l)+IO-(aq) ΔH1=+bkJ·mol-1(b>0)
Ⅱ.
①请将上述过程补充完整(提示:反应Ⅱ不是分解反应)。
②已知:相同条件下,反应Ⅰ的反应速率小于反应Ⅱ的反应速率。如图为未加催化剂时H2O2分解反应的能量-反应历程示意图,请在图中画出加入KI溶液后该反应的能量-反应历程示意图

(2)H2O2的水溶液呈弱酸性,其电离过程如下:H2O2⇌H++HO2-;HO2-⇌H++O22-
某温度下,其电离平衡常数K1=1.1×10-11,则质量分数为30%(物质的量浓度为10mol·L-1)的H2O2水溶液的pH≈
(3)为研究温度对H2O2分解速率的影响(不加催化剂),可将一定浓度和体积的H2O2置于密闭容器中,在某温度下,经过一定的时间t,测定生成O2的体积V。然后保持其它初始条件不变,改变温度
 ,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是
,重复上述实验。获得V(O2)(转化成标况下的体积)~T关系曲线。下列趋势图可能符合实测V(O2)~T关系曲线的是A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】W、X、Y、Z四种元素均为短周期元素,原子序数依次增大,其它相关信息见下表。
根据上述信息,回答下列问题:
(l)元素Y在元素周期表中的位置是____ ;Y和Z的简单离子半径比较,较大的是 ___ (用离子符号表示)。
(2) XY2由固态变为气态所需克服的微粒间作用力是____ ;由元素W和Y组成的一种绿色氧化剂的电子式为____ 。
(3)由W、X、Y、Z四种元素组成的一种无机盐,水溶液呈碱性的原因是__ (用离子方程式表示)。
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 某种同素异形体是保护地球地表的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
(l)元素Y在元素周期表中的位置是
(2) XY2由固态变为气态所需克服的微粒间作用力是
(3)由W、X、Y、Z四种元素组成的一种无机盐,水溶液呈碱性的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】 是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:_______ 。
(2)仪器 的名称为
的名称为_______ 。
(3)实验前,应先检查装置的气密性,检查的方法为_______ 。
(4)装置Ⅰ中发生反应的化学方程式为_______ 。
(5)用电子式表示 的形成过程:
的形成过程:_______ 。
(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ. 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。
① 属于
属于_______ (填“离子”或“共价”)化合物。
②该小组乙同学认为猜想ⅰ错误,判断的理由为_______ 。
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为_______ (用离子方程式表示)。
 是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题: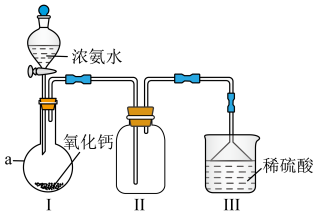
(2)仪器
 的名称为
的名称为(3)实验前,应先检查装置的气密性,检查的方法为
(4)装置Ⅰ中发生反应的化学方程式为
(5)用电子式表示
 的形成过程:
的形成过程:(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ.
 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。①
 属于
属于②该小组乙同学认为猜想ⅰ错误,判断的理由为
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极A上的电极反应式为___ 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为___ 。
(2)CO2一定条件可转化为CH3OH:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。
CH3OH(g)+H2O(g) ΔH<0。
①下列有关该反应的说法正确的是___ (填序号)。
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中CH3OH浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入N2,平衡向正反应方向移动
D.平衡时,若改变体积增大压强,则c(CO2)、c(CH3OH)均变大
②某温度下恒容密闭容器中,CO2和H2起始浓度分别为a mol•L-1和3a mol•L-1,反应达平衡时,CO2转化率为b,该温度下反应的平衡常数K=___ 。
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是____ 溶液。
②常温下,NaHSO3溶液显___ 性(填“酸”“碱”或“中”),判断的理由是___ (通过计算说明)。
(1)科学家利用电化学装置实现CH4和CO2两种分子的耦合转化来达到减碳的目的,其原理如图所示:

①电极A上的电极反应式为
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为
(2)CO2一定条件可转化为CH3OH:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0。
CH3OH(g)+H2O(g) ΔH<0。①下列有关该反应的说法正确的是
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中CH3OH浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入N2,平衡向正反应方向移动
D.平衡时,若改变体积增大压强,则c(CO2)、c(CH3OH)均变大
②某温度下恒容密闭容器中,CO2和H2起始浓度分别为a mol•L-1和3a mol•L-1,反应达平衡时,CO2转化率为b,该温度下反应的平衡常数K=
(3)工业上用氢氧化钠溶液来同时吸收SO2和氮的氧化物气体(NOx),可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。(已知:常温下,HNO2的电离常数为Ka=7×10-4,H2SO3的电离常数为Ka1=1.2×10-2、Ka2=5.8×10-8)。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是
②常温下,NaHSO3溶液显
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫化氢的转化是资源利用和环境保护的重要研究课题。
(1)工业上将含有硫化物的废水(以H2S、HS-、S2-的形式存在)引入氧化池,加入高锰酸钾溶液氧化。已知高锰酸钾在酸性条件下的还原产物为Mn2+,碱性条件下的为MnO2。
①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为____ 。
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因____ 。
(2)常温下,H2S的Ka1=1.3×10-7、Ka2=7.0×10-15,Ksp(MnS)=1.4×10-15。向含有0.0020mol·L-1Mn2+废水中通入一定量的H2S,当溶液的pH=a、c(HS-)=1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=____ 。
(3)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图1表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是____ 。
②若水膜过厚,H2S的氧化去除率减小的原因是____ 。
(4)甲硫醇是一种恶臭、有毒物质。生物法去除甲硫醇反应为2CH3SH+7O2=2CO2+2H2O+2H2SO4。研究表明,在H2S存在条件下,可改变甲硫醇(用 表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程____ 。
(1)工业上将含有硫化物的废水(以H2S、HS-、S2-的形式存在)引入氧化池,加入高锰酸钾溶液氧化。已知高锰酸钾在酸性条件下的还原产物为Mn2+,碱性条件下的为MnO2。
①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因
(2)常温下,H2S的Ka1=1.3×10-7、Ka2=7.0×10-15,Ksp(MnS)=1.4×10-15。向含有0.0020mol·L-1Mn2+废水中通入一定量的H2S,当溶液的pH=a、c(HS-)=1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
(3)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图1表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
②若水膜过厚,H2S的氧化去除率减小的原因是
(4)甲硫醇是一种恶臭、有毒物质。生物法去除甲硫醇反应为2CH3SH+7O2=2CO2+2H2O+2H2SO4。研究表明,在H2S存在条件下,可改变甲硫醇(用
 表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
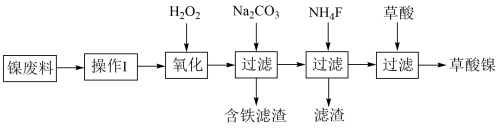
【推荐2】三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4)。再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
请回答下列问题:
(1)操作I为____ 。加入H2O2发生的主要反应的离子方程式为_____ ;加入碳酸钠溶液调节pH至4.0-5.0,其目的为______ 。
(2)若加入NH4F时滤液中c(Mg2+)=0.02mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___ 。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____ 。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____ 。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____ 。
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____ 。


请回答下列问题:
(1)操作I为
(2)若加入NH4F时滤液中c(Mg2+)=0.02mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】合理利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。
Ⅰ.一种从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)。

已知:①不同铅化合物的溶度积(25℃):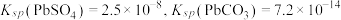 ;
;
②PbSiF6和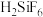 均为能溶于水的强电解质。
均为能溶于水的强电解质。
(1)过程i中,物质a表现___________ (填“氧化”或“还原”)性。
(2)过程ⅱ需要加入 溶液,从化学平衡的角度解释其作用原理:
溶液,从化学平衡的角度解释其作用原理:___________ 。
(3)过程ⅲ发生反应的离子方程式为___________ 。
Ⅱ.工业上用PbSiF6、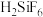 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
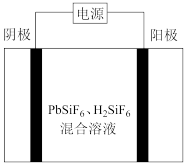
(4)下列说法正确的是___________ (填字母序号)。
a.阴极为粗铅,纯铅在阳极析出
b.电解产生的阳极泥的主要成分为Cu和Ag
c.工作一段时间后,需要补充Pb2+以保持溶液中c(Pb2+)的稳定
(5)铅的电解精炼需要调控好电解液中的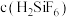 。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中
。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中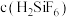 的变化趋势如图。由图可推知,随
的变化趋势如图。由图可推知,随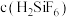 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是___________ 。

Ⅰ.一种从废旧铅蓄电池的铅膏中回收铅的生产流程如下图(部分产物已略去)。

已知:①不同铅化合物的溶度积(25℃):
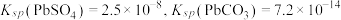 ;
;②PbSiF6和
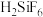 均为能溶于水的强电解质。
均为能溶于水的强电解质。(1)过程i中,物质a表现
(2)过程ⅱ需要加入
 溶液,从化学平衡的角度解释其作用原理:
溶液,从化学平衡的角度解释其作用原理:(3)过程ⅲ发生反应的离子方程式为
Ⅱ.工业上用PbSiF6、
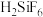 混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如下。
(4)下列说法正确的是
a.阴极为粗铅,纯铅在阳极析出
b.电解产生的阳极泥的主要成分为Cu和Ag
c.工作一段时间后,需要补充Pb2+以保持溶液中c(Pb2+)的稳定
(5)铅的电解精炼需要调控好电解液中的
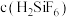 。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中
。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中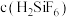 的变化趋势如图。由图可推知,随
的变化趋势如图。由图可推知,随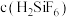 增大,铅产率先增大后减小,减小的原因可能是
增大,铅产率先增大后减小,减小的原因可能是
您最近一年使用:0次



