下列叙述正确的是
A.向氨水中加入醋酸使溶液呈酸性,则 |
B.向 溶液中加入少量 溶液中加入少量 固体,则 固体,则 的水解程度增大 的水解程度增大 |
C.向 相同,体积相等的盐酸和醋酸溶液中,分别加入等浓度的 相同,体积相等的盐酸和醋酸溶液中,分别加入等浓度的 溶液,则消耗 溶液,则消耗 溶液的体积前者小于后者 溶液的体积前者小于后者 |
D.向 磷酸中加水稀释至原体积的两倍,则 磷酸中加水稀释至原体积的两倍,则 |
更新时间:2023-01-13 19:22:39
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】草酸(H2C2O4) 常用于衣物除锈。25° C时,向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX [X表示c(HC2O4)/c(H2C2O4)或c(C2O )/c(HC2O4)]随溶液pH的变化关系如图所示。下列说法正确的是
)/c(HC2O4)]随溶液pH的变化关系如图所示。下列说法正确的是

 )/c(HC2O4)]随溶液pH的变化关系如图所示。下列说法正确的是
)/c(HC2O4)]随溶液pH的变化关系如图所示。下列说法正确的是
| A.草酸用于衣物除锈时体现氧化性 |
| B.直线II中X表示的是c(HC2O4 )/c(H2C2O4) |
C.0.1 mol·L-1 NaHC2O4溶液中:c(Na+)>c(HC2O )>c(H2C2O4)>c(C2O )>c(H2C2O4)>c(C2O ) ) |
D.当pH=4.22时,溶液中c(HC2O ):c(H2C2O4)=1000:1 ):c(H2C2O4)=1000:1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用0.10mol·L-1的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
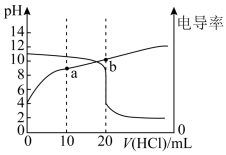
下列说法错误的是

下列说法错误的是
| A.BOH的Kb约为1×10-5 |
| B.a点:c(B+)+2c(H+)=2c(OH-)+c(BOH) |
| C.滴加盐酸的过程中,溶液中水的电离程度先减小后增大 |
| D.b点:c(B+)<0.05mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】室温下,通过实验研究亚硫酸盐的性质,已知 ,
,
下列说法正确的是
 ,
,
| 实验 | 实验操作和现象 |
| 1 | 把SO2通入氨水,测得溶液pH=7 |
| 2 | 向0.1mol·L-1Na2SO3溶液中加入过量0.2mol·L-1CaCl2溶液,产生白色沉淀 |
| 3 | 向0.1mol·L-1NaHSO3溶液中滴入等浓度等体积的NaOH溶液 |
| 4 | 把少量氯气通入Na2SO3溶液中,测得溶液pH变小 |
A.实验1中,可计算出 |
B.实验2反应静置后的上层清液中有 |
C.实验3中: |
| D.实验4中说明氯气溶于水显酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,下列能证明某酸 是弱酸的实验事实是
是弱酸的实验事实是
 是弱酸的实验事实是
是弱酸的实验事实是A. 溶液与 溶液与 反应放出 反应放出 |
B. 溶液与 溶液与 反应生成 反应生成 |
C. 溶液的 溶液的 大于7 大于7 |
D. 的 的 溶液,加蒸馏水稀释至 溶液,加蒸馏水稀释至 ,测得其 ,测得其 且 且 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】次磷酸(H3PO2)是一元酸,可用于金属的表面处理。已知常温下,NaH2PO2的水溶液呈碱性,下列说法错误的是
| A.0.01mol·L-1 H3PO2水溶液的pH>2 |
B.NaH2PO2的水溶液中:c(Na+)=c(H3PO2)+c(H2PO )+c(HPO )+c(HPO )+c(PO )+c(PO ) ) |
C.NaH2PO2在水溶液的电离方程式为:NaH2PO2=Na+ +H2PO |
D.NaH2PO2的水溶液加水稀释, 减小 减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下,向 溶液中滴加
溶液中滴加 溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表
溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表 ,Ⅱ代表
,Ⅱ代表 ,Ⅲ代表
,Ⅲ代表 )。下列说法正确的是
)。下列说法正确的是

 溶液中滴加
溶液中滴加 溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表
溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表 ,Ⅱ代表
,Ⅱ代表 ,Ⅲ代表
,Ⅲ代表 )。下列说法正确的是
)。下列说法正确的是
A. 点溶液呈酸性,则 点溶液呈酸性,则 |
B. 点溶液中: 点溶液中: |
C.若 点溶液 点溶液 ,则 ,则 的数量级为 的数量级为 |
D. 时,溶液中 时,溶液中 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】室温下,向20mL0.1mol·L-1HB溶液中逐滴加入0.1mol·L-1NaOH溶液,其pH变化曲线如图所示。下列说法正确的
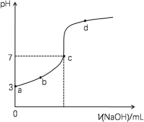

| A.由a点可计算出HB的电离平衡常数Ka约为10-5 |
| B.整个滴定过程中,在c点时,水的电离程度最大 |
| C.若在b点时加入的NaOH溶液的体积为10.00mL,则有:c(H+)+c(HB)=c(B-)+c(OH-) |
| D.若在d点时加入的NaOH溶液的体积为30.00mL,则有:2c(B-)+2c(HB)=3c(Na+) |
您最近一年使用:0次



