回答下列问题
(1)25℃,某 溶液中
溶液中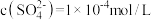 ,则该溶液中
,则该溶液中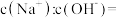
_______ 。
(2)某温度下,测得 的
的 溶液的
溶液的 ,该温度下,纯水的
,该温度下,纯水的
_______ 。此时,将 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得混合液为中性,则
混合,所得混合液为中性,则
_______ 。
(3)25℃时,已知 溶液
溶液 ,
,
①该溶液中离子浓度由大到小排列的顺序为:_______ ;
②精确表达下列算式的数学结果:
_______  ;
;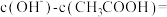
_______  。
。
(4)若向浓度均为 的
的 和
和 的混合液中逐渐加入
的混合液中逐渐加入 粉末,当溶液中
粉末,当溶液中 浓度下降到
浓度下降到_______  时,
时, 开始沉淀。已知:
开始沉淀。已知: 时,
时,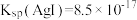 ;
;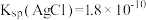 。
。
(1)25℃,某
 溶液中
溶液中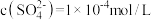 ,则该溶液中
,则该溶液中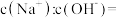
(2)某温度下,测得
 的
的 溶液的
溶液的 ,该温度下,纯水的
,该温度下,纯水的
 的
的 溶液
溶液 与
与 的
的 溶液
溶液 混合,所得混合液为中性,则
混合,所得混合液为中性,则
(3)25℃时,已知
 溶液
溶液 ,
,①该溶液中离子浓度由大到小排列的顺序为:
②精确表达下列算式的数学结果:

 ;
;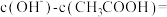
 。
。(4)若向浓度均为
 的
的 和
和 的混合液中逐渐加入
的混合液中逐渐加入 粉末,当溶液中
粉末,当溶液中 浓度下降到
浓度下降到 时,
时, 开始沉淀。已知:
开始沉淀。已知: 时,
时,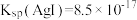 ;
;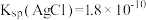 。
。
更新时间:2023-01-30 17:54:33
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】请回答下列问题:
(1)常温下,将pH=2的CH3COOH和pH=12的NaOH溶液等体积混合,溶液呈____ 性。(填“中”、“酸”或“碱”)。
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于_____ 。
(3)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡向_____ 移动,(填“左”或“右”);向H2S溶液中加入NaHS固体时,c(S2-)_____ 。(填“增大”、“减小”或“不变”)
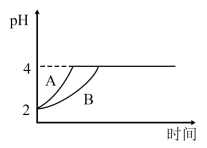
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是____ (填“A”或“B”)。
(5)常温下,将0.1mol/L盐酸和0.06mol/L氢氧化钡溶液以等体积混合后,该混合溶液的pH=____ 。
(6)25℃,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,所得混合液为中性。
若a=2,b=12,则Va:Vb=____ 。
若a=2,b=13,则Va:Vb=____ 。
(1)常温下,将pH=2的CH3COOH和pH=12的NaOH溶液等体积混合,溶液呈
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于
(3)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡向
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是

(5)常温下,将0.1mol/L盐酸和0.06mol/L氢氧化钡溶液以等体积混合后,该混合溶液的pH=
(6)25℃,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,所得混合液为中性。
若a=2,b=12,则Va:Vb=
若a=2,b=13,则Va:Vb=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】室温时,向amL0.10mol/L的稀氨水中逐滴加入bmL0.10mol/L的稀盐酸,试分析:
(1)滴加过程中反应的离子方程式为:____ 。
(2)当b=a时,溶液呈___ 性(填“酸”“碱”或“中”),此时溶液中,c(NH )
)___ c(Cl-)(填“>”“<”或“=”)。
(3)当溶液呈中性时,a___ b(填“>”“<”或“=”),此时溶液中c(NH )
)___ c(Cl-)(填“>”“<”或“=”)。
(1)滴加过程中反应的离子方程式为:
(2)当b=a时,溶液呈
 )
)(3)当溶液呈中性时,a
 )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水的离子积常数Kw与温度T(℃)有关:
(1)若T=25℃时,Kw=____________ ,若T=100℃时,Kw=1×10-12,则此温度下0.05mol/LBa(OH)2 溶液的pH=____________ .
(2)已知25℃时,0.1L 0.1mol•L-1的NaA溶液的pH=10,用离子方程式表示其原因为______________ ;
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为_____________ (混合后的体积变化忽略不计).
(1)若T=25℃时,Kw=
(2)已知25℃时,0.1L 0.1mol•L-1的NaA溶液的pH=10,用离子方程式表示其原因为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】“氰化提金”产生的废水中含有一定量的 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:
25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
(1)常温下,将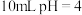 的HCN溶液加水稀释至1000mL,溶液的pH
的HCN溶液加水稀释至1000mL,溶液的pH_____ 6(填“>”“<”或“=”)。
(2)常温下,pH相等的NaCN和 溶液相比,浓度较大的是
溶液相比,浓度较大的是_____ (填化学式)溶液。
(3)常温下,在 溶液中加入
溶液中加入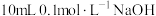 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是_____ 。
(4)HCN的电子式是_____ 。
 ,为处理含氰废水科研人员进行了大量研究。回答下列问题:
,为处理含氰废水科研人员进行了大量研究。回答下列问题:25℃,氢氰酸(HCN)、碳酸在水中的电离常数如下表:
| 酸 | HCN |  |
| Ka | Ka=6.2×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
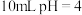 的HCN溶液加水稀释至1000mL,溶液的pH
的HCN溶液加水稀释至1000mL,溶液的pH(2)常温下,pH相等的NaCN和
 溶液相比,浓度较大的是
溶液相比,浓度较大的是(3)常温下,在
 溶液中加入
溶液中加入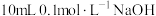 溶液。所得混合溶液中离子浓度由大到小的顺序是
溶液。所得混合溶液中离子浓度由大到小的顺序是(4)HCN的电子式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知某溶液中只存在 、
、 、
、 、
、 四种离子,某同学推测其离子浓度大小顺序有如下三种关系:
四种离子,某同学推测其离子浓度大小顺序有如下三种关系:
①
②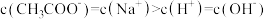
③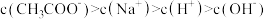
(1)若溶液中只存在一种溶质,则该溶质是__________ (填化学式),上述四种离子浓度的大小顺序为__________ (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为__________ (填化学式)。
(3)若该溶液是由体积相等的NaOH溶液和 溶液混合而成,且恰好呈中性,则溶液中四种离子浓度的大小顺序为
溶液混合而成,且恰好呈中性,则溶液中四种离子浓度的大小顺序为__________ (填序号),则混合前两溶液的物质的量浓度大小关系为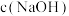
__________ (填“大于”“小于”或“等于”,下同)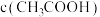 ,混合前酸中
,混合前酸中 与碱中
与碱中 的关系是
的关系是
__________  。
。
(4)将等物质的量浓度的 溶液和
溶液和 溶液等体积混合后,溶液呈酸性,混合后的溶液中各种微粒浓度由大到小的顺序(
溶液等体积混合后,溶液呈酸性,混合后的溶液中各种微粒浓度由大到小的顺序( 除外)为
除外)为____________________________ 。
 、
、 、
、 、
、 四种离子,某同学推测其离子浓度大小顺序有如下三种关系:
四种离子,某同学推测其离子浓度大小顺序有如下三种关系:①

②
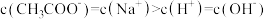
③
(1)若溶液中只存在一种溶质,则该溶质是
(2)若上述关系中③是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的NaOH溶液和
 溶液混合而成,且恰好呈中性,则溶液中四种离子浓度的大小顺序为
溶液混合而成,且恰好呈中性,则溶液中四种离子浓度的大小顺序为
 ,混合前酸中
,混合前酸中 与碱中
与碱中 的关系是
的关系是
 。
。(4)将等物质的量浓度的
 溶液和
溶液和 溶液等体积混合后,溶液呈酸性,混合后的溶液中各种微粒浓度由大到小的顺序(
溶液等体积混合后,溶液呈酸性,混合后的溶液中各种微粒浓度由大到小的顺序( 除外)为
除外)为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】我们的生活离不开化学,化学物质在不同的领域发挥着重要的作用。根据要求回答下列问题:
(1)将氯化铝溶液加热蒸干灼烧得到的固体为_______ , 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是_______ (结合文字和化学术语作答)。
(2)利用“亚硫酸盐法”吸收工业废气中的 。常温下,将工业废气通入
。常温下,将工业废气通入 溶液中,测得溶液
溶液中,测得溶液 与含硫组分物质的量分数
与含硫组分物质的量分数 的变化关系如图所示。
的变化关系如图所示。
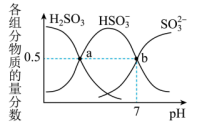
①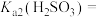
_______ 。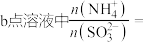
_______ 。
②常温下, 。
。 的
的 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为_______ (不考虑 )。
)。
(3)已知如下物质的溶度积常数: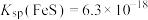 ,
, ,则向含有等物质的量的
,则向含有等物质的量的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,最先出现的沉淀是
溶液,最先出现的沉淀是_______ (填化学式),除去工业废水中的 和
和 ,可以选用
,可以选用 作沉淀剂,写出除去废水中
作沉淀剂,写出除去废水中 的离子方程式:
的离子方程式:_______ 。
(1)将氯化铝溶液加热蒸干灼烧得到的固体为
 是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将
是一种液态化合物,遇水剧烈反应,有白雾和使滴有品红试液的滤纸褪色的刺激性气味产生,实际工业上将 与
与 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是(2)利用“亚硫酸盐法”吸收工业废气中的
 。常温下,将工业废气通入
。常温下,将工业废气通入 溶液中,测得溶液
溶液中,测得溶液 与含硫组分物质的量分数
与含硫组分物质的量分数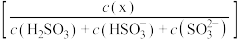 的变化关系如图所示。
的变化关系如图所示。
①
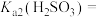
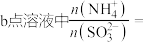
②常温下,
 。
。 的
的 溶液中离子浓度由大到小的顺序为
溶液中离子浓度由大到小的顺序为 )。
)。(3)已知如下物质的溶度积常数:
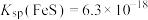 ,
, ,则向含有等物质的量的
,则向含有等物质的量的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,最先出现的沉淀是
溶液,最先出现的沉淀是 和
和 ,可以选用
,可以选用 作沉淀剂,写出除去废水中
作沉淀剂,写出除去废水中 的离子方程式:
的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】弱电解质有许多,如醋酸、碳酸、氢氰酸、一水合氨等。已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如表。
(1)25℃时,pH相等的三种溶液:① 溶液、②
溶液、② 溶液、③NaCN溶液,浓度由大到小的顺序为
溶液、③NaCN溶液,浓度由大到小的顺序为_______ (填序号)。
(2)25℃时,向NaCN溶液中通入少量 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)将浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合,则混合溶液中
_______  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
(4)常温下,向 溶液中加入
溶液中加入 溶液后过滤,若测得滤液中
溶液后过滤,若测得滤液中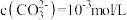 ,则
,则
_______ (填“已”或“未”)沉淀完全。[已知该温度下,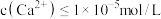 时可视为沉淀完全;
时可视为沉淀完全;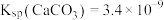 ]
]
(5)已知常温下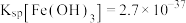 ,某
,某 溶液中含有
溶液中含有 ,可以加入
,可以加入_______ 调节溶液的pH为_______ ,使溶液中的 恰好沉淀完全[
恰好沉淀完全[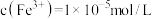 时]而除去[
时]而除去[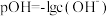 ,
, ]。
]。
| 氢氰酸 | 碳酸 | 醋酸 |
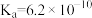 | 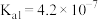 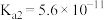 | 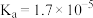 |
 溶液、②
溶液、② 溶液、③NaCN溶液,浓度由大到小的顺序为
溶液、③NaCN溶液,浓度由大到小的顺序为(2)25℃时,向NaCN溶液中通入少量
 ,反应的离子方程式为
,反应的离子方程式为(3)将浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合,则混合溶液中

 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。(4)常温下,向
 溶液中加入
溶液中加入 溶液后过滤,若测得滤液中
溶液后过滤,若测得滤液中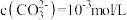 ,则
,则
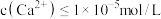 时可视为沉淀完全;
时可视为沉淀完全;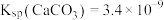 ]
](5)已知常温下
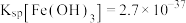 ,某
,某 溶液中含有
溶液中含有 ,可以加入
,可以加入 恰好沉淀完全[
恰好沉淀完全[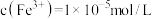 时]而除去[
时]而除去[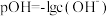 ,
, ]。
]。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】冰醋酸的结构简式为:______ ,其属于______ 电解质(填非、强或弱),溶于水的电离方程式为:_________ ,在此溶液中滴加紫色石蕊溶液,溶液变红,加热溶液红色_____ (填加深、变浅或不变),说明冰醋酸溶于水的电离是________ 过程(填吸热或放热)。在100mL0.1mol/L的CH3COOH溶液中,加入100mL0.1mol/L NaOH溶液,恰好反应后溶液呈______ 性(填碱性或酸性),反应后溶液中离子浓度大小为:_______ 溶液中c(CH3COOH)+c(CH3COO-)=______ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.已知水在25℃和95℃时的电离平衡曲线如图所示:

(1)25℃时水的电离平衡曲线应为_____ (填“A”或“B”)。
(2)95℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为_____ 。
(3)25℃时,等体积的 的NaOH溶液和氨水分别与
的NaOH溶液和氨水分别与 的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积
的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积_____ (填“前者多”“后者多”或“一样多”)。
Ⅱ.NaOH溶液可用于多种气体的处理。
(4) 是温室气体,可用NaOH溶液吸收得到
是温室气体,可用NaOH溶液吸收得到 或
或 ,已知25℃时,
,已知25℃时, 第一步水解的平衡常数
第一步水解的平衡常数 ,当溶液中
,当溶液中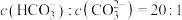 时,溶液的
时,溶液的
_____ 。
(5)已知金属与浓硝酸反应产生的 可用NaOH溶液吸收,反应的化学方程式为:
可用NaOH溶液吸收,反应的化学方程式为: 。含0.2molNaOH的水溶液与
。含0.2molNaOH的水溶液与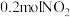 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为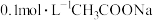 溶液,则两份溶液中
溶液,则两份溶液中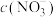 、
、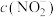 和
和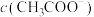 由大到小的顺序为
由大到小的顺序为_____ (已知 的电离常数
的电离常数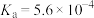 ,
, 的电离常数
的电离常数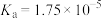 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是_____ (填字母)。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水

(1)25℃时水的电离平衡曲线应为
(2)95℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(3)25℃时,等体积的
 的NaOH溶液和氨水分别与
的NaOH溶液和氨水分别与 的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积
的盐酸发生中和反应,恰好完全反应时消耗盐酸的体积Ⅱ.NaOH溶液可用于多种气体的处理。
(4)
 是温室气体,可用NaOH溶液吸收得到
是温室气体,可用NaOH溶液吸收得到 或
或 ,已知25℃时,
,已知25℃时, 第一步水解的平衡常数
第一步水解的平衡常数 ,当溶液中
,当溶液中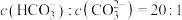 时,溶液的
时,溶液的
(5)已知金属与浓硝酸反应产生的
 可用NaOH溶液吸收,反应的化学方程式为:
可用NaOH溶液吸收,反应的化学方程式为: 。含0.2molNaOH的水溶液与
。含0.2molNaOH的水溶液与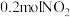 恰好完全反应得1L溶液A,溶液B为
恰好完全反应得1L溶液A,溶液B为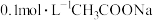 溶液,则两份溶液中
溶液,则两份溶液中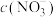 、
、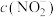 和
和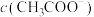 由大到小的顺序为
由大到小的顺序为 的电离常数
的电离常数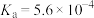 ,
, 的电离常数
的电离常数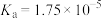 )。可使溶液A和溶液B的pH相等的方法是
)。可使溶液A和溶液B的pH相等的方法是A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】水溶液广泛存在于生命体及其赖以生存的环境中,与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答:
(1)人体血浆中的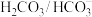 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是_______ (用离子方程式表示),肾脏通过分泌 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH_______ (填“升高”或“降低”)。人体血液的pH=7.4[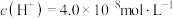 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的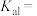
_______ 。
(2) 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为_______ ;反应后期还要加入少量氨水,目的是_______ 。
(3)工业上处理废水时,可采用FeS除去废水中的 ,原因是
,原因是_______ (用离子方程式表示),已知: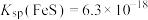 、
、 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=_______ 。
(1)人体血浆中的
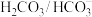 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH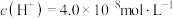 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的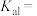
(2)
 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为(3)工业上处理废水时,可采用FeS除去废水中的
 ,原因是
,原因是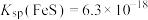 、
、 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________ 。
(2)要使0.2mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为___ 。
 Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。
Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)·c2(OH-)=2×10-20。当溶液中各种离子的浓度幂的乘积大于溶度积时,则产生沉淀,反之固体溶解。(1)某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
(2)要使0.2mol·L-1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】表为几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃)。
回答下列问题:
(1)由表分析,若①CH3COOH ②HCO ③C6H5OH ④H2PO
③C6H5OH ④H2PO 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为_______ (须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:_______ ;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)_______ c(NH );(填“>”、“=”或“<”)
);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是_______ ;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH ) >c (C6H5O-) >c (H+)>c (OH-)
) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2c(NH )= c (C6H5O-)+ c(C6H5OH)
)= c (C6H5O-)+ c(C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______ 。
(6)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

① T1_______ T2(填>、=、<),T2温度时Ksp(BaSO4)=_______ ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是_______
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理_______ 次。[提示: BaSO4(s)+ CO (aq)⇌BaCO3(s)+ SO
(aq)⇌BaCO3(s)+ SO (aq)]
(aq)]
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH⇌CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3⇌H++HCO HCO  ⇌H++CO ⇌H++CO | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH⇌C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4⇌H++H2PO H2PO  ⇌H++HPO ⇌H++HPO HPO  ⇌H++PO ⇌H++PO | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3 H2O H2O | NH3 H2O⇌NH H2O⇌NH +OH- +OH- | 1.76×10-5 | |
| BaSO4 | BaSO4⇌Ba2++SO | 1.07×10-10 | |
| BaCO3 | BaCO3⇌ Ba2++CO | 2.58×10-9 |
回答下列问题:
(1)由表分析,若①CH3COOH ②HCO
 ③C6H5OH ④H2PO
③C6H5OH ④H2PO 均可看作酸,则它们酸性由强到弱的顺序为
均可看作酸,则它们酸性由强到弱的顺序为(2)写出C6H5OH与Na3PO4反应的离子方程式:
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
 );(填“>”、“=”或“<”)
);(填“>”、“=”或“<”)(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH
 ) >c (C6H5O-) >c (H+)>c (OH-)
) >c (C6H5O-) >c (H+)>c (OH-)C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2c(NH
 )= c (C6H5O-)+ c(C6H5OH)
)= c (C6H5O-)+ c(C6H5OH)(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式
(6)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

① T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO
 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理 (aq)⇌BaCO3(s)+ SO
(aq)⇌BaCO3(s)+ SO (aq)]
(aq)]
您最近一年使用:0次



