制造航天飞船的主要材料是铝,工业上制铝时用冰晶石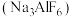 做助熔剂,已知
做助熔剂,已知 微溶于水。某工厂采用含氟矿石(主要成分为
微溶于水。某工厂采用含氟矿石(主要成分为 、
、 )和含铝废渣(主要成分为
)和含铝废渣(主要成分为 、
、 ,含有
,含有 、
、 杂质)联合制备冰晶石的流程如下:
杂质)联合制备冰晶石的流程如下:

回答下列问题:
(1)基态 原子的价层电子排布式是
原子的价层电子排布式是_______ ,基态 原子核外有
原子核外有_______ 个未成对电子。
(2)“酸浸1”得到 和
和 的化学方程式为
的化学方程式为_______ 。
(3)“氧化”时反应的离子方程式为_______ ; 也可用
也可用 代替,
代替, 的电子式为
的电子式为_______ 。
(4)“萃取”过程可表示为 (水层)
(水层) (有机层)
(有机层) (有机层)
(有机层) (水层)。在实验室中模拟由“有机层”获取
(水层)。在实验室中模拟由“有机层”获取 溶液的具体操作是
溶液的具体操作是_______ 。
(5)“合成”时反应的化学方程式为_______ [另一生成物为 ]。
]。
(6)“系列操作”包含过滤、_______ 、_______ 。
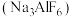 做助熔剂,已知
做助熔剂,已知 微溶于水。某工厂采用含氟矿石(主要成分为
微溶于水。某工厂采用含氟矿石(主要成分为 、
、 )和含铝废渣(主要成分为
)和含铝废渣(主要成分为 、
、 ,含有
,含有 、
、 杂质)联合制备冰晶石的流程如下:
杂质)联合制备冰晶石的流程如下:
回答下列问题:
(1)基态
 原子的价层电子排布式是
原子的价层电子排布式是 原子核外有
原子核外有(2)“酸浸1”得到
 和
和 的化学方程式为
的化学方程式为(3)“氧化”时反应的离子方程式为
 也可用
也可用 代替,
代替, 的电子式为
的电子式为(4)“萃取”过程可表示为
 (水层)
(水层) (有机层)
(有机层) (有机层)
(有机层) (水层)。在实验室中模拟由“有机层”获取
(水层)。在实验室中模拟由“有机层”获取 溶液的具体操作是
溶液的具体操作是(5)“合成”时反应的化学方程式为
 ]。
]。(6)“系列操作”包含过滤、
更新时间:2023-02-09 22:04:08
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】 -
- 干重整技术(简称“DRM技术”)在转化利用
干重整技术(简称“DRM技术”)在转化利用 的同时可以大量利用
的同时可以大量利用 ,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:
,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:
主反应:

副反应:

回答下列问题:
(1)已知 、CO和
、CO和 的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
_____ kJ/mol。
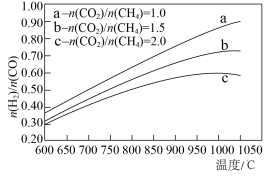
(2)在刚性密闭容器中,反应达到平衡状态时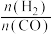 随温度变化的关系如图甲所示,随着进料比
随温度变化的关系如图甲所示,随着进料比 的增加,
的增加,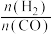 值的变化趋势及原因是
值的变化趋势及原因是_____ 。
(3)在1000℃、压强为P时,按投料比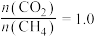 加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为
加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为_____ ,副反应的压强平衡常数
_____ (注:对于可逆反应: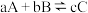 达到化学平衡时,
达到化学平衡时, )
)
(4)DRM技术主反应的催化转化原理的如图乙所示:
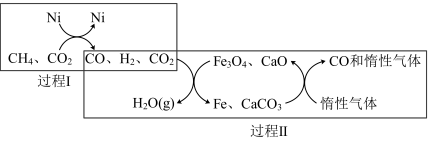
①过程Ⅱ实现了含氢物种与含碳物种的分离。生成 (g)的化学方程式是
(g)的化学方程式是_____ 。
②过程Ⅱ的催化剂是_____ ,只有过程Ⅰ投料比
_____ ,含铁催化剂组成才会保持不变,维持循环使用。
 -
- 干重整技术(简称“DRM技术”)在转化利用
干重整技术(简称“DRM技术”)在转化利用 的同时可以大量利用
的同时可以大量利用 ,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:
,从而成为一项“绿色”的化工技术而受到科研人员的广泛关注。该过程中涉及的反应如下:主反应:


副反应:


回答下列问题:
(1)已知
 、CO和
、CO和 的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
的燃烧热分别为-890.3kJ/mol、-283.0kJ/mol和-285.8kJ/mol,DRM技术主反应的
(2)在刚性密闭容器中,反应达到平衡状态时
 随温度变化的关系如图甲所示,随着进料比
随温度变化的关系如图甲所示,随着进料比 的增加,
的增加, 值的变化趋势及原因是
值的变化趋势及原因是
(3)在1000℃、压强为P时,按投料比
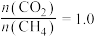 加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为
加入刚性密闭容器中,达平衡时甲烷的转化率为80%,二氧化碳的转化率为90%,则反应前后气体的总物质的量之比为
 达到化学平衡时,
达到化学平衡时, )
)(4)DRM技术主反应的催化转化原理的如图乙所示:

①过程Ⅱ实现了含氢物种与含碳物种的分离。生成
 (g)的化学方程式是
(g)的化学方程式是②过程Ⅱ的催化剂是

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某学习小组欲利用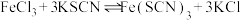 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:
实验Ⅰ.改变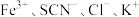 等离子浓度对平衡的影响
等离子浓度对平衡的影响
(1)取 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是___________ (填A或B)。原因是:___________ 。
(2)取 溶液X,加入5滴
溶液X,加入5滴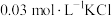 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:①___________ 对平衡产生了影响;②不直接参与平衡体系的 或
或 对平衡产生了影响。
对平衡产生了影响。
实验Ⅱ.为了探究KCl对 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
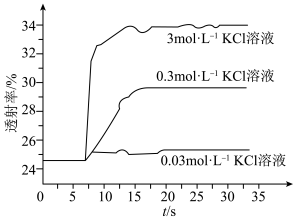
(3)上述实验可以得到以下结论:一是KCl对 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响___________ 移动(填“正向、逆向或不”)。
(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①: 产生的影响。
产生的影响。
猜想②: 产生的影响。
产生的影响。
猜想③:___________ 。
实验Ⅲ.探究盐对 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:
a.溶液中的 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
b.在 溶液中存在反应
溶液中存在反应 。
。
(5)根据上述信息,学习小组同学各取 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②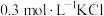 溶液、③
溶液、③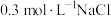 溶液、④
溶液、④ 溶液、⑤
溶液、⑤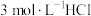 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
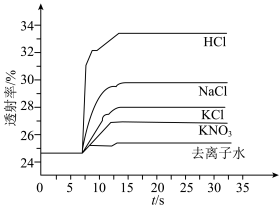
上述实验能证明阳离子盐效应影响 平衡体系的实验组是
平衡体系的实验组是___________ 。盐效应影响较大的阳离子是___________ 。
A.实验①②③ B.实验①②④ C.实验①③④
(6)已知 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:___________ 。
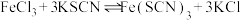 平衡体系探究影响平衡的因素,将
平衡体系探究影响平衡的因素,将
 溶液和
溶液和 溶液混合,得血红色溶液X,进行下列实验:
溶液混合,得血红色溶液X,进行下列实验:实验Ⅰ.改变
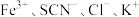 等离子浓度对平衡的影响
等离子浓度对平衡的影响(1)取
 溶液X,加入5滴
溶液X,加入5滴 溶液,得到溶液A;另取
溶液,得到溶液A;另取 溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是
溶液X,插入经砂纸打磨过的铁丝得到溶液B,A、B两溶液颜更深的是(2)取
 溶液X,加入5滴
溶液X,加入5滴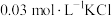 溶液,观察到溶液红色变浅,产生该现象的原因可能是:①
溶液,观察到溶液红色变浅,产生该现象的原因可能是:① 或
或 对平衡产生了影响。
对平衡产生了影响。实验Ⅱ.为了探究KCl对
 平衡体系的影响某学习小组同学进行如下探究:各取
平衡体系的影响某学习小组同学进行如下探究:各取 溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
溶液X放入3支比色皿中,分别滴加5滴不同浓度的KCl溶液,并测定各溶液的透射率随时间的变化(已知溶液颜色越深,透射率越小),结果如图所示。
(3)上述实验可以得到以下结论:一是KCl对
 平衡有影响,且KCl浓度越大,影响
平衡有影响,且KCl浓度越大,影响(4)针对产生上述影响的可能原因,学习小组同学提出以下猜想:
猜想①:
 产生的影响。
产生的影响。 猜想②:
 产生的影响。
产生的影响。 猜想③:
实验Ⅲ.探究盐对
 和
和 平衡体系产生的影响资料信息:
平衡体系产生的影响资料信息:a.溶液中的
 离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。
离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。b.在
 溶液中存在反应
溶液中存在反应 。
。(5)根据上述信息,学习小组同学各取
 溶液X,分别加入5滴①去离子水、②
溶液X,分别加入5滴①去离子水、②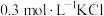 溶液、③
溶液、③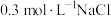 溶液、④
溶液、④ 溶液、⑤
溶液、⑤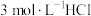 溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
溶液进行实验,测得各溶液的透射率随时间的变化如图所示。
上述实验能证明阳离子盐效应影响
 平衡体系的实验组是
平衡体系的实验组是A.实验①②③ B.实验①②④ C.实验①③④
(6)已知
 对平衡没有明显的影响,解释出现实验⑤现象的原因:
对平衡没有明显的影响,解释出现实验⑤现象的原因:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】实验小组模拟工业上回收“分银渣”中的银,过程如下:
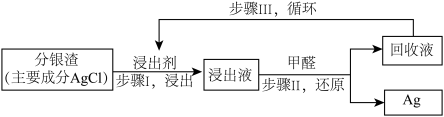
①Ⅰ中反应: (杂质不反应)
(杂质不反应)
②在上述反应的温度下,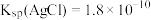 、
、
(1)过程Ⅰ中,向 溶液中加入分银渣,10分钟后,固体质量减少
溶液中加入分银渣,10分钟后,固体质量减少 ,则反应速率
,则反应速率
___________ (忽略溶液体积变化)。
(2)“分银”时, 与
与 反应生成
反应生成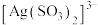 ,该反应的平衡常数
,该反应的平衡常数
___________ 。
(3)其他条件不变,反应Ⅰ在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是___________ (用离子方程式解释)。
(4)配平步骤Ⅱ中反应的离子方程式并标出电子转移的方向和数目:_________
___________ ___________
___________ ___________
___________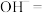 ___________
___________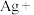 ___________
___________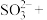 ___________
___________ ___________
___________
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:___________ 。

①Ⅰ中反应:
 (杂质不反应)
(杂质不反应)②在上述反应的温度下,
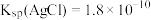 、
、
(1)过程Ⅰ中,向
 溶液中加入分银渣,10分钟后,固体质量减少
溶液中加入分银渣,10分钟后,固体质量减少 ,则反应速率
,则反应速率
(2)“分银”时,
 与
与 反应生成
反应生成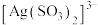 ,该反应的平衡常数
,该反应的平衡常数
(3)其他条件不变,反应Ⅰ在敞口容器中进行,若反应时间过长反而银的产率降低,银产率降低的可能原因是
(4)配平步骤Ⅱ中反应的离子方程式并标出电子转移的方向和数目:
___________
 ___________
___________ ___________
___________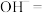 ___________
___________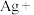 ___________
___________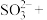 ___________
___________ ___________
___________
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银浸出率降低。从回收液离子浓度变化和平衡移动的角度分析原因:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铬(Cr)及其化合物用途广泛。请回答:
(1)基态铬原子的价层电子排布式_______ ,属于周期表的_______ 区。同周期的基态原子中,与Cr最高能层电子数相同的还有_______ (写元素符号)。
(2) 的三种结构:①
的三种结构:①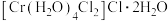 、②
、② 、③
、③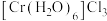 ,下列说法正确的是_______。
,下列说法正确的是_______。
(3)对配合物 进行加热时,配体
进行加热时,配体 比
比 更容易失去,请解释原因
更容易失去,请解释原因_______ 。
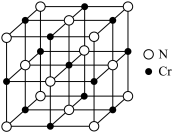
(4)铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Cr原子之间的最近核间距为
,则晶胞中Cr原子之间的最近核间距为_______ pm(写出表达式即可)。
(1)基态铬原子的价层电子排布式
(2)
 的三种结构:①
的三种结构:①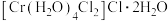 、②
、② 、③
、③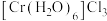 ,下列说法正确的是_______。
,下列说法正确的是_______。| A.①②③中Cr的配位数都是6 |
B.①中配合离子空间结构为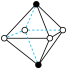 或 或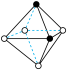 (已略去位于正八面体中心的Cr) (已略去位于正八面体中心的Cr) |
| C.②中存在的化学键有离子键、共价键、配位键和氢键 |
D.等物质的量的①②③分别与足量 溶液反应,得到AgCl物质的量也相等 溶液反应,得到AgCl物质的量也相等 |
 进行加热时,配体
进行加热时,配体 比
比 更容易失去,请解释原因
更容易失去,请解释原因(4)铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中Cr原子之间的最近核间距为
,则晶胞中Cr原子之间的最近核间距为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】全固态激光器所用的磷酸钛氧钾、氟硼铍酸钾是一种非线性光学晶体,我国是率先掌握通过非线性光学晶体变频来获得深紫外激光技术的国家,回答下列问题。
(1)写出Ti基态原子的价电子排布式___________ ,Ti4+电子占据的轨道数为___________ 个。
(2)Be和B的第一电离能I1(Be)>I1(B)的原因是___________ 。
(3)H3BO3在水溶液中存在解离反应:H3BO3+H2O H++B(OH)
H++B(OH) ,B(OH)
,B(OH) 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是___________ ,从原子结构分析B(OH) 中能形成配位键的原因是
中能形成配位键的原因是___________ 。
(4)氟硼酸钾是制备氟硼铍酸钾的原料之一、氟硼酸钾在高温下分解为KF和BF3,二者的沸点分别为1500℃、-101℃。KF的沸点远高于BF3的原因是___________ 。
(5)KIO3晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________ nm,与K紧邻的O个数为___________ 。
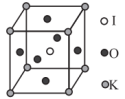
(6)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于___________ 位置,O处于___________ 位置。
(1)写出Ti基态原子的价电子排布式
(2)Be和B的第一电离能I1(Be)>I1(B)的原因是
(3)H3BO3在水溶液中存在解离反应:H3BO3+H2O
 H++B(OH)
H++B(OH) ,B(OH)
,B(OH) 中存在配位键,其中B原子的杂化类型是
中存在配位键,其中B原子的杂化类型是 中能形成配位键的原因是
中能形成配位键的原因是(4)氟硼酸钾是制备氟硼铍酸钾的原料之一、氟硼酸钾在高温下分解为KF和BF3,二者的沸点分别为1500℃、-101℃。KF的沸点远高于BF3的原因是
(5)KIO3晶体也是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为

(6)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】原子序数小于36的X、Y、Z、W、J、G六种元素,原子序数依次增大,其中X元素的原子在所有原子中半径最小,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子核外的3p能级有两个电子,G元素原子核外有6个未成对电子(用元素符号或化学式表示)。
(1)写出G元素的基态原子的价电子排布式_______ ;Y2X2分子中σ键与π键数目之比为_______ 。
(2)Y、Z、W三种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。
(3)ZX3在水中的溶解度较大,可能的原因有_______ 、_______ 。(写出两个即可)
(4)J与W形成的化合物JW2的晶体类型为_______ 晶体;XYZ分子中Y原子轨道的杂化类型为_______ 。
(5)G元素有δ、γ、α三种同素异形体,晶胞结构如图所示。三种晶体的晶胞中所含有的G原子数之比为_______ 。

(1)写出G元素的基态原子的价电子排布式
(2)Y、Z、W三种元素第一电离能由大到小的顺序为
(3)ZX3在水中的溶解度较大,可能的原因有
(4)J与W形成的化合物JW2的晶体类型为
(5)G元素有δ、γ、α三种同素异形体,晶胞结构如图所示。三种晶体的晶胞中所含有的G原子数之比为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁( )的工艺流程如下:
)的工艺流程如下:
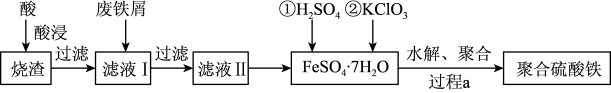
(1)酸浸时最合适的酸是_____ (写化学式)。
(2)酸浸后溶液中主要的阳离子有_____ 。
(3)加入KClO3的目的是_____________________________ (结合离子方程式说明)。
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。
_____ Fe2(SO4)3+_____ H2O
______ Fe2(OH)x(SO4)3-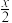 +
+ _____ ______
(5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因__________ 。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式: (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
①该聚合硫酸铁样品中n(OH-) =_________ mol。
②已知该样品中Fe的质量分数w,则盐基度B=_______________ 。
 )的工艺流程如下:
)的工艺流程如下:
(1)酸浸时最合适的酸是
(2)酸浸后溶液中主要的阳离子有
(3)加入KClO3的目的是
(4)过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。

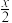 +
+ (5)过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:
 (n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:
(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作:ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
①该聚合硫酸铁样品中n(OH-) =
②已知该样品中Fe的质量分数w,则盐基度B=
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
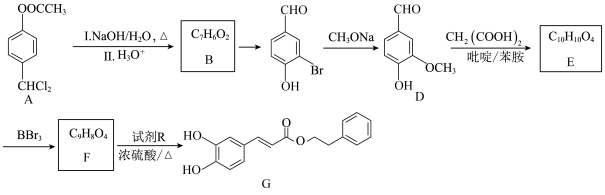
【推荐2】以芳香族化合物A为原料制备某药物中间体G的路线如图:
已知:①同一碳原子上连两个羟基时不稳定,易发生反应: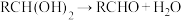 ;
;
②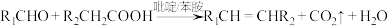 ;
;
③
回答下列问题:
(1)B的化学名称为_______ 。
(2)A中官能团的名称为_______ 。
(3) 的反应类型为
的反应类型为_______ 。
(4) 的化学方程式为
的化学方程式为_______ 。
(5)溴原子直接连苯环的 的同分异构体
的同分异构体 有
有_______ 种。其中 消耗
消耗 的同分异构体的结构简式为
的同分异构体的结构简式为_______ (任写一种)。
(6)根据上述路线中的相关知识,设计以 和乙酸为原料制备
和乙酸为原料制备 的合成路线
的合成路线_______ (无机试剂任选)。

已知:①同一碳原子上连两个羟基时不稳定,易发生反应:
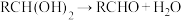 ;
;②
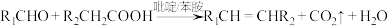 ;
;③

回答下列问题:
(1)B的化学名称为
(2)A中官能团的名称为
(3)
 的反应类型为
的反应类型为(4)
 的化学方程式为
的化学方程式为(5)溴原子直接连苯环的
 的同分异构体
的同分异构体 有
有 消耗
消耗 的同分异构体的结构简式为
的同分异构体的结构简式为(6)根据上述路线中的相关知识,设计以
 和乙酸为原料制备
和乙酸为原料制备 的合成路线
的合成路线
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】苯酚是生产某些树脂、染料、防腐剂以及药物的重要化工原料。实验室常用氯化铁溶液检验苯酚(或酚类)。某小组为研究外界条件的改变对苯酚显色反应的影响而进行下列实验。
(一)制备无水氯化铁
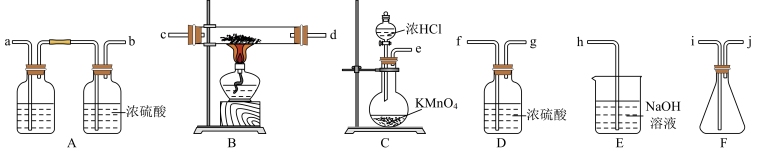
已知:FeCl3易潮解,100℃左右时升华。请利用下列装置制备无水FeCl3并回答下列问题。
(1)装置C中发生反应的化学方程式为_______ 。
(2)实验室制备无水氯化铁时,导管连接顺序为为e→_____→____c→d→____→____→_____→___→h。(填字母)_______
(二)探究外界条件的改变对苯酚显色反应的影响
已知:I.苯酚显色反应的原理为 。
。
II.苯酚易溶于苯,难溶于石油醚。石油醚无色且密度小于水。
探究有机溶剂对氯化铁的苯酚紫色混合液的影响,相关实验记录如下:
(3)x值为_______ ,结合上述实验,预测实验④中的现象为_______ 。
(4)对比实验①②的现象,颜色变化的原因为_______ ;对比实验③④的现象,颜色变化的原因为_______ 。
(5)若想探究pH对显色反应的影响,不可加入____ (填“稀盐酸”、“稀硫酸”或“硝酸”)进行调节。
(一)制备无水氯化铁

已知:FeCl3易潮解,100℃左右时升华。请利用下列装置制备无水FeCl3并回答下列问题。
(1)装置C中发生反应的化学方程式为
(2)实验室制备无水氯化铁时,导管连接顺序为为e→_____→____c→d→____→____→_____→___→h。(填字母)
(二)探究外界条件的改变对苯酚显色反应的影响
已知:I.苯酚显色反应的原理为
 。
。II.苯酚易溶于苯,难溶于石油醚。石油醚无色且密度小于水。
探究有机溶剂对氯化铁的苯酚紫色混合液的影响,相关实验记录如下:
| 序号 | 一定浓度的苯酚水溶液的体积/mL |   溶液 溶液 | 加入物质 | 实验现象 |
| ① | x | 2滴 | 无 | 溶液呈深紫色 |
| ② | 2 | 2滴 | 1mL | 溶液呈紫色 |
| ③ | 2 | 2滴 | 1mL苯 | 溶液分层,上层为无色,下层为浅紫色 |
| ④ | 2 | 2滴 | 1mL石油醚 | _______ |
(4)对比实验①②的现象,颜色变化的原因为
(5)若想探究pH对显色反应的影响,不可加入
您最近一年使用:0次



