食醋有效成分主要为醋酸(用HAc表示),常温下HAc的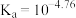 。下列说法错误的是
。下列说法错误的是
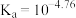 。下列说法错误的是
。下列说法错误的是| 选项 | 实验操作 | 结论 |
| A | 加热醋酸水溶液(忽略溶质的挥发) | 溶液的导电能力、HAc的电离程度均增大 |
| B | 常温下测得NH4Ac水溶液 | NH4Ac溶于水不发生水解 |
| C | 加入NaOH溶液与醋酸溶液恰好中和 | 中和后: |
| D | 常温下,HAc溶液与NaOH溶液混合,测得溶液pH为4.76 | 反应后: |
| A.A | B.B | C.C | D.D |
2023·广东佛山·一模 查看更多[5]
广东省佛山市2023届普通高中教学质量检测(一)化学试题(已下线)2022年福建省高考真题变式题(选择题1-5)(已下线)专题16 水溶液中的离子平衡吉林省长春外国语学校2022-2023学年高二下学期开学考试化学试题(已下线)电离平衡
更新时间:2023-02-09 09:59:13
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是( )
| A.将Ca(OH)2饱和溶液加热,溶液的pH增大 |
| B.常温下,pH=11的氨水与pH=3的盐酸等体积混合后,溶液的pH>7 |
| C.将0.1mol·L—1的HI溶液加水稀释100倍,溶液中所有离子的浓度随之减小 |
| D.两种酸溶液的pH分别为a和(a+1),物质的量浓度分别为c1和c2,则c1=10c2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列关于电解质溶液的叙述正确的是
| A.室温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
| B.将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
D.室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是( )
A.向含有相等物质的量的 、ClO-、 、ClO-、 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 、ClO-、 、ClO-、 |
| B.向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+ |
D.向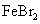 溶液中滴加少量氯水,再加入 溶液中滴加少量氯水,再加入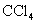 溶液振荡,静置,有机层呈橙色 溶液振荡,静置,有机层呈橙色 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于电离平衡常数(K)的说法中正确的是( )
| A.电离平衡常数(K)越小,表示弱电解质电离能力越弱 |
| B.电离平衡常数(K)与温度无关 |
| C.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 |
| D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,下列各组离子在指定条件下一定能大量共存的是
A.无色透明的水溶液中:Na+、NH 、SO 、SO 、Cl- 、Cl- |
B.pH=0的溶液中:K+、Na+、SO 、S2O 、S2O |
C.中性溶液中:Fe3+、Al3+、SO 、Cl- 、Cl- |
D.含有大量Ca2+的溶液中:Al3+、CO 、NH 、NH 、Br- 、Br- |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列各组离子在水溶液中能大量共存的是
A.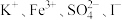 | B.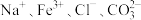 |
C.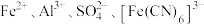 | D.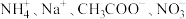 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】将一定量的稀盐酸滴入氨水中,充分反应后,下列关系一定错误的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】25℃时,用2amol•L-1NaOH溶液滴定1.0L2amol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示。下列说法正确的是


| A.pH=3时,溶液中:c(Na+)>c(F-) |
| B.当c(F-)>c(HF)时,一定有c(OH-)>c(H+) |
| C.pH=3.45时,NaOH溶液与HF恰好完全反应 |
| D.pH=4时溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2amol•L-1 |
您最近一年使用:0次

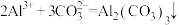
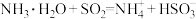
 时:
时: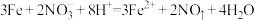
 溶液中逐滴加入
溶液中逐滴加入 溶液至
溶液至 恰好完全沉淀:
恰好完全沉淀: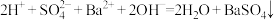
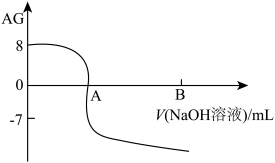
 。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是
。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是