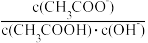丙二酸是一种二元弱酸(用 表示),改变
表示),改变
 溶液的pH,得到含碳粒子的物质的量分数(
溶液的pH,得到含碳粒子的物质的量分数( )与溶液pH的关系如图所示,下列说法正确的是
)与溶液pH的关系如图所示,下列说法正确的是

 表示),改变
表示),改变
 溶液的pH,得到含碳粒子的物质的量分数(
溶液的pH,得到含碳粒子的物质的量分数( )与溶液pH的关系如图所示,下列说法正确的是
)与溶液pH的关系如图所示,下列说法正确的是
A. 的数量级为 的数量级为 |
| B.将丙二酸与等物质的量的氢氧化钠混合后,溶液呈碱性 |
C.反应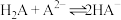 的平衡常数 的平衡常数 |
D.将丙二酸与氢氧化钠按物质的量2:3混合,溶液中: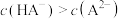 |
更新时间:2023-05-22 11:32:51
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】常温下,用NaOH溶液滴定 时,各含砷微粒的物质的量分数随pH的变化如图所示,下列说法不正确的是
时,各含砷微粒的物质的量分数随pH的变化如图所示,下列说法不正确的是

 时,各含砷微粒的物质的量分数随pH的变化如图所示,下列说法不正确的是
时,各含砷微粒的物质的量分数随pH的变化如图所示,下列说法不正确的是
A.曲线②代表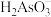 |
B. 的第一电离常数 的第一电离常数 |
C.等物质的量浓度的 溶液与NaOH溶液等体积混合,所得溶液促进水的电离 溶液与NaOH溶液等体积混合,所得溶液促进水的电离 |
D.b点溶液中 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,向 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或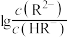 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
 的某二元酸(
的某二元酸( )溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与
)溶液中滴加等浓度的NaOH溶液,滴加过程中,混合溶液的pH与 或
或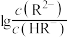 的变化关系如图所示。下列叙述错误的是
的变化关系如图所示。下列叙述错误的是
A.a表示 与pH的关系 与pH的关系 |
B.pH=7时,存在 |
C.常温下,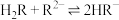 的平衡常数 的平衡常数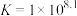 |
| D.加入等体积的NaOH溶液时,溶液显酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】常温下,将浓度均为0.1mol·L-1的一元酸HX和NaOH溶液等体积混合后,测得溶液的pH=a。下列有关说法错误的是( )
| A.若a=8,则此时溶液中:c(Na+)-c(X-)=9.9×10-7mol·L-1 |
| B.若HX为弱酸,混合后的溶液中:c(X-)+c(HX)=0.05mol·L-1 |
C.若混合后c(H+)<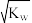 ,则反应后的溶液中:c(Na+)>c(X-)>c(OH-) ,则反应后的溶液中:c(Na+)>c(X-)>c(OH-) |
| D.若混合后a=7,则0.1mol·L-1的HX溶液中:c(OH-)+c(X-)<0.1mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
真题
名校
【推荐1】下列说法不正确 的是
| A.pH<7的溶液不一定呈酸性 |
| B.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 |
| C.在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-) |
| D.氨水和盐酸反应后的溶液,若c(Cl―)=c(NH4+),则溶液呈中性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】室温下,用0.100mol/LNaOH浴液分别滴定25.00mL0.1000mol/L一元弱酸HX、HY、HZ,已知三种弱酸的电离常数Ka(HX)>Ka(HY)>Ka(HZ)。滴定过程中,滴定曲线(pH-Φ)与一元弱酸电离常数的关系如图所示(滴定分数φ= ,R代表X、Y、Z)。下列说法错误的是
,R代表X、Y、Z)。下列说法错误的是
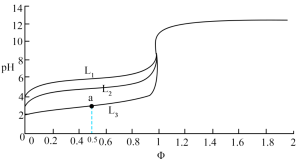
 ,R代表X、Y、Z)。下列说法错误的是
,R代表X、Y、Z)。下列说法错误的是
| A.L3代表HX的滴定曲线 |
| B.φ=0.5时,溶液中水的电离程度:HX>HY>HZ |
| C.a.点时,溶液中存在:c(HX)+2c(H+)=c(X-)+2c(OH-) |
| D.φ=0时,HZ的初始pH为4,则Ka(HZ)≈10-7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列说法正确的是
A.常温下,将0.1mol·L-1NH4Cl溶液与0.05mol·L-1NaOH溶液等体积混合,(pH=9.25):c(Cl-)>c(Na+)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c( )大小顺序为①>②>③ )大小顺序为①>②>③ |
| C.常温下,0.1mol·L-1NaHA溶液的pH=8,则溶液中:c(HA-)>c(OH-)>c(H2A)>c(A2-) |
| D.常温下,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-9mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知:δ(X)=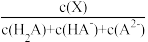 ]。下列叙述错误的是
]。下列叙述错误的是

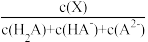 ]。下列叙述错误的是
]。下列叙述错误的是
| A.K1(H2A)=10-1.2 |
| B.pH=2.7时,c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1 |
| C.pH=2.7时,c(HA-)>c(H2A)=c(A2-) |
| D.pH=4.2时,c(HA-)=c(A2-)=c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,某同学在特制容器中加入20 mL0.4 mol/LNa2CO3溶液,用0.4 mol/L盐酸滴定,利用pH计和气体压力传感器检测,得到如图曲线。下列说法错误的是


A.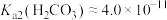 |
B.c→d主要发生反应: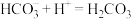 |
C.b点对应的溶液中:c(Na+)>c(Cl-)>c( )>c(OH-) )>c(OH-) |
| D.e→f压强仍继续增大,主要是因为HCl挥发 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
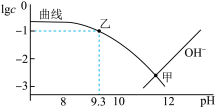
【推荐1】常温下,分别向 溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数
溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数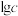 与pH的关系如图所示。已知HX为一元弱酸;常温下,
与pH的关系如图所示。已知HX为一元弱酸;常温下,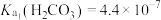 ,
,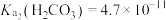 ,下列说法正确的是
,下列说法正确的是
 溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数
溶液加入少量NaOH固体或通入HCl气体时,所得溶液中部分微粒浓度的对数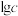 与pH的关系如图所示。已知HX为一元弱酸;常温下,
与pH的关系如图所示。已知HX为一元弱酸;常温下,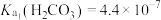 ,
,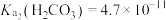 ,下列说法正确的是
,下列说法正确的是
A.曲线代表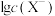 与pH的关系 与pH的关系 |
B.常温下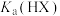 的数量级为 的数量级为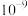 |
C.甲点溶液存在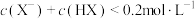 |
D.向NaX溶液中通入 气体,发生的反应是: 气体,发生的反应是: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列离子方程式书写正确的是
A.同浓度同体积的 溶液与 溶液与 溶液混合: 溶液混合: |
B.用惰性电极电解饱和 溶液: 溶液: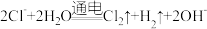 |
C.将硫酸氢钠溶液与氢氧化钡溶液混合,溶液显中性: |
D.向 溶液中滴加 溶液中滴加 溶液: 溶液: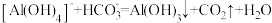 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】室温下,下列说法正确的是
| A.0.1 mol/L的NaHA溶液pH=1,则有:c(Na+)=c(H2A)+c(HA-)+2c(A2-) |
| B.向NaAlO2溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+) |
C.将a mol/L的醋酸溶液与0.01 mol/L的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),醋酸的电离常数Ka= (用含a的代数式表示) (用含a的代数式表示) |
D.向NH4Cl溶液中加入量等物质的量浓度的稀盐酸,则 的值增大 的值增大 |
您最近一年使用:0次