室温下,以酚酞为指示剂,用 溶液滴定
溶液滴定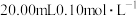 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积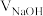 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: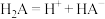 ,
, 。下列叙述正确的是
。下列叙述正确的是

 溶液滴定
溶液滴定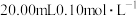 二元酸
二元酸 溶液。溶液pH随滴加NaOH溶液体积
溶液。溶液pH随滴加NaOH溶液体积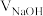 的变化关系如图所示。已知
的变化关系如图所示。已知 的电离过程为:
的电离过程为: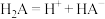 ,
, 。下列叙述正确的是
。下列叙述正确的是
A.室温下,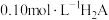 溶液 溶液 |
| B.滴定过程中,水的电离程度一直在增大 |
C.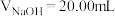 时,溶液中 时,溶液中 |
D.滴定终点时,溶液中 |
更新时间:2023-06-08 21:53:14
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】常温下,用 NaOH溶液分别滴定20.00mL浓度均为
NaOH溶液分别滴定20.00mL浓度均为 的HA溶液和HB溶液,滴定曲线如图。下列说法错误的是
的HA溶液和HB溶液,滴定曲线如图。下列说法错误的是

 NaOH溶液分别滴定20.00mL浓度均为
NaOH溶液分别滴定20.00mL浓度均为 的HA溶液和HB溶液,滴定曲线如图。下列说法错误的是
的HA溶液和HB溶液,滴定曲线如图。下列说法错误的是
| A.HB为强酸 |
| B.水的电离程度:④>①>③>② |
| C.将①和②对应的溶液混合,所得溶液为碱性 |
D.将①和④对应的溶液混合,所得溶液满足 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】类比是重要的学习方法,类比pH的定义可定义pOH和pKW。在某弱酸HX及其盐NaX的混合溶液中(HX和NaX的含量不确定),c(H+)和c(OH-)存在如图所示的关系,则下列说法不正确的是


| A.图中温度T2>25℃ |
| B.若此混合溶液呈酸性且c(HX)=c(NaX),则HX电离能力大于NaX的水解能力 |
C.位于AB线段上任意点的溶液均有pH=pOH=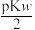 |
| D.图中D点处溶液中离子浓度:c(Na+)>c(X-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,向20mL0.1mol/L的CH3COOH溶液中逐滴加入0. 1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
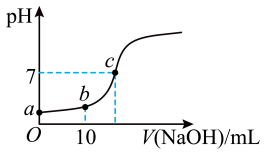

| A.反应过程中,Ka值不断增大 | B.b点时,c(CH3COO- ) = 0.05mol/L |
| C.c点时,V(NaOH) =20mL | D.反应过程中, 的值不断增大 的值不断增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是


| A.N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+) |
| B.常温下,0.1000mol/LHY溶液的电离度约为1% |
| C.Ka(HX)数量级为10-9 |
| D.用NaOH溶液滴定HY可用酚酞做指示剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】二元有机酸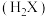 的电离常数
的电离常数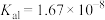 、
、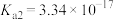 。
。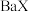 难溶于水,常温下,将
难溶于水,常温下,将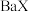 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与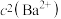 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是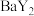 易溶于水。
易溶于水。
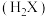 的电离常数
的电离常数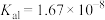 、
、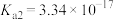 。
。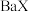 难溶于水,常温下,将
难溶于水,常温下,将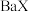 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与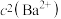 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是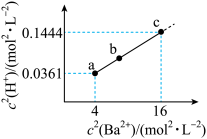
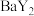 易溶于水。
易溶于水。A.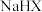 溶液显碱性 溶液显碱性 |
B.溶度积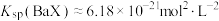 |
C.b点: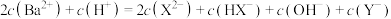 |
D.若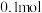 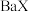 溶于 溶于 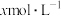 HY溶液中得到氢离子浓度与 HY溶液中得到氢离子浓度与 点相等,则 点相等,则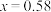 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】常温下,向体积均为V0、浓度均为0.10 mol·L-1的MOH和ROH溶液中分别加水稀释至体积为V,溶液pH随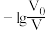 的变化如图所示,
的变化如图所示,
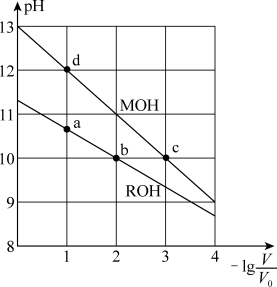
下列叙述正确的是
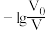 的变化如图所示,
的变化如图所示,
下列叙述正确的是
A.b、c两点的溶液中: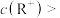 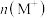 |
| B.MOH的电离程度:c点小于d点 |
| C.溶液中水的的电离程度:b>c>a>d |
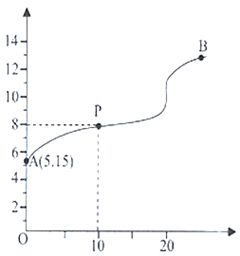
D.当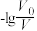 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则 增大 增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )


| A.加入10 mL NaOH溶液时,a点c(X−)<b点c(Y−) |
| B.HY中加NaOH溶液至pH=7时,所得溶液中c(Y−)=c(Na+)=c(OH−)=c(H+) |
| C.b点溶液中,c(Y−)+2c(OH−)=c(HY)+2c(H+) |
| D.25℃时,HX为强酸,HY为弱酸且Ka=10−8 |
您最近一年使用:0次


 中
中 的平衡浓度随温度变化的曲线,说明平衡常数
的平衡浓度随温度变化的曲线,说明平衡常数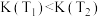
 时刻溶液的温度最高
时刻溶液的温度最高 溶液中滴加
溶液中滴加 溶液之后,溶液的导电能力随滴入
溶液之后,溶液的导电能力随滴入

