2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向1L的刚性密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4kJ•mol-1
CO(g)+H2(g) ΔH1=+131.4kJ•mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1
①下列说法正确的是______ 。
A.平衡时向容器中充入惰性气体,反应I、Ⅱ的平衡均不移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数一定小于
D.增加碳块用量,可加快反应速率
②反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系______ (填“吸收”或“放出”)热量_______ kJ,反应I的平衡常数Kc=_______ 。
(2)一种脱除和利用水煤气中CO2方法的示意图如图:
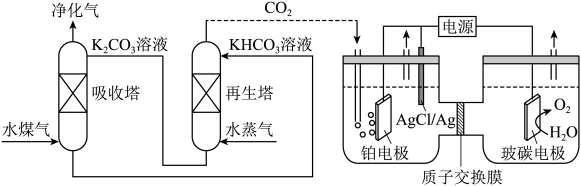
①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后溶液pH=10,则此时溶液中c(CO )∶c(HCO
)∶c(HCO )=
)=_____ (该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11)。
②再生塔中产生CO2的离子方程式为_______ 。
③利用电化学原理,将CO2电催化还原为C2H4的电极反应式为______ ;AgCl/Ag电极的质量______ (填变大、变小或不变);放电结束后,铂电极所在的区域溶液的pH_______ (填变大、变小或不变)。
(1)在一定温度下,向1L的刚性密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:
I.C(s)+H2O(g)
 CO(g)+H2(g) ΔH1=+131.4kJ•mol-1
CO(g)+H2(g) ΔH1=+131.4kJ•mol-1Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH2=-41.1kJ•mol-1①下列说法正确的是
A.平衡时向容器中充入惰性气体,反应I、Ⅱ的平衡均不移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数一定小于

D.增加碳块用量,可加快反应速率
②反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系
(2)一种脱除和利用水煤气中CO2方法的示意图如图:

①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后溶液pH=10,则此时溶液中c(CO
 )∶c(HCO
)∶c(HCO )=
)=②再生塔中产生CO2的离子方程式为
③利用电化学原理,将CO2电催化还原为C2H4的电极反应式为
更新时间:2023-06-03 10:30:55
|
相似题推荐
【推荐1】运用化学反应原理知识研究如何利用 、
、 等污染物有重要意义。
等污染物有重要意义。
(1)用 可以合成甲醇。已知:
可以合成甲醇。已知:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ∆H1kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ∆H1kJ·mol-1
CO(g)+ O2(g)=CO2(g) ∆H2kJ·mol-1
O2(g)=CO2(g) ∆H2kJ·mol-1
H2(g)+ O2(g)=H2O(g) ∆H3kJ·mol-1
O2(g)=H2O(g) ∆H3kJ·mol-1
则CO(g)+2 H2(g) CH3OH(g) ∆H=
CH3OH(g) ∆H=_______  。
。
(2)一定压强下,在容积为 的密闭容器中充入
的密闭容器中充入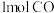 与
与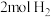 ,在催化剂作用下发生反应:CO(g)+2 H2(g)
,在催化剂作用下发生反应:CO(g)+2 H2(g) CH3OH(g) ∆H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ∆H,平衡转化率与温度、压强的关系如图所示。
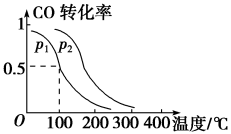
①下列说法正确的是_______
A.若容器内气体的密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.若容器内各气体压强恒定,反应达到平衡状态
D.反应中,催化剂能使平衡向正反应方向移动
②上述反应中,∆H_______ 0(填“ ”、“
”、“ ”或“
”或“ ”)
”)
③p2_______ p1(填“ ”、“
”、“ ”或“
”或“ ”);
”);
④100℃时,该反应的化学平衡常数
_______ ;
 、
、 等污染物有重要意义。
等污染物有重要意义。(1)用
 可以合成甲醇。已知:
可以合成甲醇。已知:CH3OH(g)+
 O2(g)=CO2(g)+2H2O(l) ∆H1kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ∆H1kJ·mol-1CO(g)+
 O2(g)=CO2(g) ∆H2kJ·mol-1
O2(g)=CO2(g) ∆H2kJ·mol-1H2(g)+
 O2(g)=H2O(g) ∆H3kJ·mol-1
O2(g)=H2O(g) ∆H3kJ·mol-1则CO(g)+2 H2(g)
 CH3OH(g) ∆H=
CH3OH(g) ∆H= 。
。(2)一定压强下,在容积为
 的密闭容器中充入
的密闭容器中充入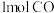 与
与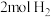 ,在催化剂作用下发生反应:CO(g)+2 H2(g)
,在催化剂作用下发生反应:CO(g)+2 H2(g) CH3OH(g) ∆H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ∆H,平衡转化率与温度、压强的关系如图所示。
①下列说法正确的是
A.若容器内气体的密度恒定,反应达到平衡状态
B.若容器内各气体浓度恒定,反应达到平衡状态
C.若容器内各气体压强恒定,反应达到平衡状态
D.反应中,催化剂能使平衡向正反应方向移动
②上述反应中,∆H
 ”、“
”、“ ”或“
”或“ ”)
”)③p2
 ”、“
”、“ ”或“
”或“ ”);
”);④100℃时,该反应的化学平衡常数

您最近一年使用:0次
【推荐2】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
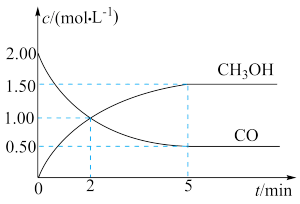
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________ 。
②下列说法正确的是____________ (填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=__________ kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________ (用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________ 。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
 CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=
②下列说法正确的是
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=
②对于可逆反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________ 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是____ (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____ 。
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是____________ 。
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g) 其平衡常数表达式为
CH4(g)+2H2O(g) 其平衡常数表达式为_____________________________ 。
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为________ 。300 ℃时上述反应的平衡常数K=___________ 。200℃时该反应的平衡常数K=64.8,则该反应的△H_____ O (填“>”或“<”)。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)
 CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)(1)①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1molCO2生成的同时有3mol H-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是
(3)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) 其平衡常数表达式为
CH4(g)+2H2O(g) 其平衡常数表达式为向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,300℃时发生上述反应,达到平衡时各物质的浓度分别为:CO2:0.2 mol·L一1,H2:0.8 mol·L一1,CH4:0.8 mol·L一1,
H2O:1.6 mol·L一1。
则CO2的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】亚磷酸(H3PO3)是重要的化工原料,可作尼龙增白剂、农药中间体等。
(1)亚磷酸溶液与硝酸银溶液混合生成黑色的银和一氧化氮气体,反应的化学方程式为________ 。
(2)亚磷酸为二元弱酸。
已知:
① H3PO3(aq)+NaOH(aq) NaH2PO3(aq)+H2O(l)△H=-akJ/mol
NaH2PO3(aq)+H2O(l)△H=-akJ/mol
②HCl(aq)+NaOH(aq) NaCl(aq)H2O(l)△H=-bkJ/mol
NaCl(aq)H2O(l)△H=-bkJ/mol
求H3PO3(aq) H+(aq)+H2PO3-(aq) △H=
H+(aq)+H2PO3-(aq) △H= ______
(3)25℃时,H3PO3电离常数Ka1=8.4×10-3,则NaH2PO3水解常数Kh=_____ (结果保留两位有效数字);Na2HPO3为________ (填“正盐”或“酸式盐”),其溶液显_____ (填“酸性”、“中性”、“碱性”或“无法判断”);浓度均为0.1mol/L的Na2HPO3和NaOH的混合液,加水稀释10倍后的溶液中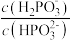 将
将_______ (填“增大”、“不变”或“减小”)。
(4)亚磷酸可用电解Na2HPO3溶液来制得,装置如图所示:
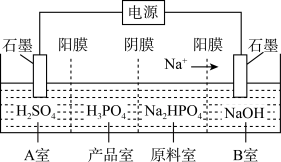
①A室的电极反应式为_________________ ;
②产品室中反应的离子方程式为____________ 。
(1)亚磷酸溶液与硝酸银溶液混合生成黑色的银和一氧化氮气体,反应的化学方程式为
(2)亚磷酸为二元弱酸。
已知:
① H3PO3(aq)+NaOH(aq)
 NaH2PO3(aq)+H2O(l)△H=-akJ/mol
NaH2PO3(aq)+H2O(l)△H=-akJ/mol②HCl(aq)+NaOH(aq)
 NaCl(aq)H2O(l)△H=-bkJ/mol
NaCl(aq)H2O(l)△H=-bkJ/mol求H3PO3(aq)
 H+(aq)+H2PO3-(aq) △H=
H+(aq)+H2PO3-(aq) △H= (3)25℃时,H3PO3电离常数Ka1=8.4×10-3,则NaH2PO3水解常数Kh=
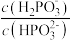 将
将(4)亚磷酸可用电解Na2HPO3溶液来制得,装置如图所示:

①A室的电极反应式为
②产品室中反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1=akJ·mol−1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2=bkJ·mol−1
2CO(g) + O2(g)=2CO2(g) ΔH3=ckJ·mol−1
反应CO2(g) + CH4(g)=2CO(g) + 2H2(g) 的ΔH=__ kJ·mol−1。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
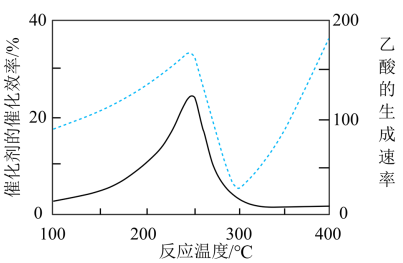
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是___ 。
②为了提高该反应中CH4的转化率,可以采取的措施是___ 。
(3)以CO2为原料可以合成多种物质。
①利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为___ mol。
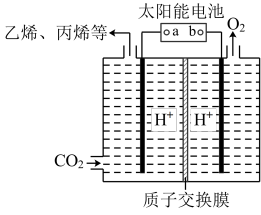
②以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图所示,b是电源的________ (填“正极”或“负极”),写出生成丙烯的电极反应式___ 。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1=akJ·mol−1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2=bkJ·mol−1
2CO(g) + O2(g)=2CO2(g) ΔH3=ckJ·mol−1
反应CO2(g) + CH4(g)=2CO(g) + 2H2(g) 的ΔH=
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。

①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因可能是
②为了提高该反应中CH4的转化率,可以采取的措施是
(3)以CO2为原料可以合成多种物质。
①利用FeO吸收CO2的化学方程式为:6FeO + CO2=2Fe3O4 + C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为
②以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图所示,b是电源的

您最近一年使用:0次
【推荐3】从辉铋矿(主要成分为Bi2S3,含有SiO2、Cu2S、FeS2杂质)回收铋的一种工艺流程如下图所示。
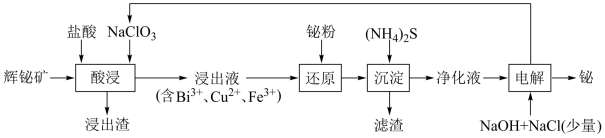
已知:i.氧化性:Cu2+>Bi3+>H+;ii.结合S2-能力:Cu2+>H+>Fe2+
(1)“酸浸”过程,需分批次的加入NaClO3以防生成Cl2。
①“浸出渣”中除硫外,还含有___________ (填化学式)。
②Bi2S3发生反应的化学方程式为___________ 。
(2)“还原”过程中Fe3+发生反应的离子方程式为___________ 。
(3)“净化液”中的阳离子除Bi3+、H+和Fe2+外,还存在有___________ (填离子符号)。
(4)“电解”装置图如下。
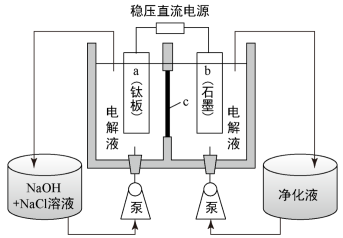
①c为___________ 离子交换膜(填“阳”或“阴”)。
②a极的电极反应式为___________ 。

已知:i.氧化性:Cu2+>Bi3+>H+;ii.结合S2-能力:Cu2+>H+>Fe2+
(1)“酸浸”过程,需分批次的加入NaClO3以防生成Cl2。
①“浸出渣”中除硫外,还含有
②Bi2S3发生反应的化学方程式为
(2)“还原”过程中Fe3+发生反应的离子方程式为
(3)“净化液”中的阳离子除Bi3+、H+和Fe2+外,还存在有
(4)“电解”装置图如下。

①c为
②a极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)AsH3通入AgNO3溶液中可生成Ag、As2O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)改变0.1 mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO 、HAsO
、HAsO 及AsO
及AsO 的物质的量分布分数随pH的变化如图所示:
的物质的量分布分数随pH的变化如图所示:
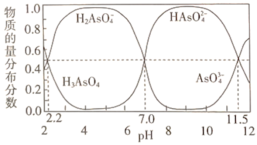
①lgKa1(H3AsO4)=_______ ;用甲基橙作指示剂,用NaOH溶液滴定H3AsO4发生的主要反应的离子方程式为_______ 。
②反应H2AsO4-+AsO
 2HAsO
2HAsO 的lgK=
的lgK=_______ 。
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ∆H1=a kJ·mol-1
As2O3(g)+3C(s)= As4(g)+3CO(g) ∆H2=b kJ·mol-1
As4(g)+3CO(g) ∆H2=b kJ·mol-1
则反应4As(g) As4(g)的∆H=
As4(g)的∆H=_______ kJ·mol-1(用含a、b的代数式表示)。
(4)反应2As2S3(s) 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
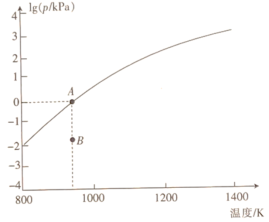
①对应温度下,B点的反应速率v(正)_______ v(逆)(填“>”“<”或“=”)。
②A点处,AsS(g)的分压为_______ kPa,该反应的Kp=_______ kPa5(Kp为以分压表示的平衡常数)。
(1)AsH3通入AgNO3溶液中可生成Ag、As2O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为
(2)改变0.1 mol·L-1三元弱酸H3AsO4溶液的pH,溶液中的H3AsO4、H2AsO
 、HAsO
、HAsO 及AsO
及AsO 的物质的量分布分数随pH的变化如图所示:
的物质的量分布分数随pH的变化如图所示:
①lgKa1(H3AsO4)=
②反应H2AsO4-+AsO

 2HAsO
2HAsO 的lgK=
的lgK=(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ∆H1=a kJ·mol-1
As2O3(g)+3C(s)=
 As4(g)+3CO(g) ∆H2=b kJ·mol-1
As4(g)+3CO(g) ∆H2=b kJ·mol-1则反应4As(g)
 As4(g)的∆H=
As4(g)的∆H=(4)反应2As2S3(s)
 4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:
①对应温度下,B点的反应速率v(正)
②A点处,AsS(g)的分压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)用硫酸分解磷尾矿[主要成分为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____ c(PO43-)(填“>”、“<”、“=”),
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):_____________________________ 。
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq) H2PO4-(aq)+H2O (l)的平衡常数K=
H2PO4-(aq)+H2O (l)的平衡常数K=______ 。
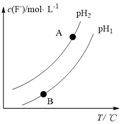
③Ca5(PO4)3F(s) +OH-(aq) Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___ pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____ v(B)(填“>”、 “<”、“=”)。
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。

①电流方向 是_____ (填:a.碳棒→铁棒;b.铁棒→碳棒);
②中间隔室的可以得到的物质X是_______ (填化学式);
③阳极的电极反应式为_______________ ;电解总反应的离子方程式为_______________ 。
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq)
 H2PO4-(aq)+H2O (l)的平衡常数K=
H2PO4-(aq)+H2O (l)的平衡常数K=③Ca5(PO4)3F(s) +OH-(aq)
 Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。

①
②中间隔室的可以得到的物质X是
③阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,在实验研究和化学工业中应用广泛。回答下列问题:
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)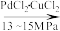 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)
II.(COOC4H9)2(l)+2H2O(l) H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)
①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了___________ ,若5min内c(O2)减少了0.15 mol·L-1,则用CO表示的反应速率为___________ mol·L-1·min-1
②对于反应II,下列能够说明其已经达到平衡状态的是___________ (填序号)。
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为___________ 。
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c( )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)___________ 10 mL(填“>”“=”或“<”),若加入NaOH溶液体积为20 mL,此时溶液中阴离子浓度的大小顺序为___________ ;当pH=2.7时,溶液中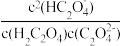 =
=___________ 。
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g)
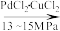 2(COOC4H9)2(l)+2H2O(l)
2(COOC4H9)2(l)+2H2O(l)II.(COOC4H9)2(l)+2H2O(l)
 H2C2O4(l)+2C4H9OH(l)
H2C2O4(l)+2C4H9OH(l)①反应I选择13~15 MPa的高压条件下进行,最主要的原因是为了
②对于反应II,下列能够说明其已经达到平衡状态的是
a.溶液的pH保持不变
b.平衡常数K保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液pH变化如图所示:

①某温度下,测得0.1 mol·L-1 H2C2O4溶液的pH=1.3,此时草酸的电离方程式为
②向10 mL 0.1 mol·L-1 H2C2O4溶液中逐滴加入0.1 mol·L-1 NaOH溶液,当溶液中c(Na+)=2c(
 )+c(
)+c( )时,加入V(NaOH)
)时,加入V(NaOH)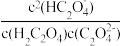 =
=
您最近一年使用:0次



