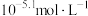滴加相同浓度的盐酸或KOH溶液来调节0.01 mol/LNa2HAsO3溶液的pH,实验测得含As各微粒的分布分数(平衡时含As某种微粒的浓度占各种含As微粒浓度之和的分数)与溶液pH的关系如图所示,下列说法正确的是
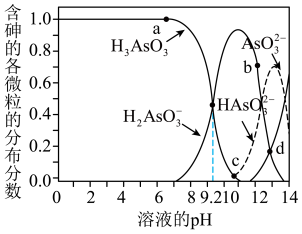

| A.NaH2AsO3溶液呈酸性 |
| B.水的电离程度:a点大于c点 |
C.d点溶液中存在:c(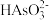 )> c( )> c( )=c( )=c( )> c(H3AsO3) )> c(H3AsO3) |
D.b点溶液中存在:c(Na+)+c(H+)=c(OH-)+c( )+2c( )+2c(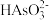 )+3c( )+3c( ) ) |
更新时间:2023-12-13 11:56:18
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知部分弱酸的电离平衡常数如表所示
下列离子方程式正确的是
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A.CO2+H2O +2C1O- =CO32-+2HClO | B.2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O |
| C.SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO | D.SO2+CO32-=CO2+SO32- |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是

A. 溶于水的电离方程式为 溶于水的电离方程式为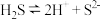 ,向 ,向 溶液中加入少量 溶液中加入少量 固体,电离平衡正向移动 固体,电离平衡正向移动 |
B.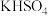 在熔融状态下的电离方程式为 在熔融状态下的电离方程式为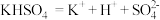 ,向醋酸中加入少量 ,向醋酸中加入少量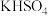 固体,电离平衡逆向移动 固体,电离平衡逆向移动 |
C.向稀氨水中滴加少量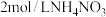 ,溶液, ,溶液, 与 与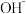 结合生成 结合生成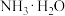 ,使平衡正向移动,电离常数增大 ,使平衡正向移动,电离常数增大 |
| D.常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
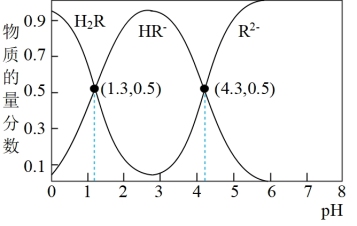
【推荐1】常温下,已知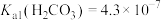 ,
, 。某二元酸
。某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、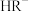 、
、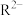 三者的物质的量分数随溶液pH变化关系如图所示。下列叙述正确的是
三者的物质的量分数随溶液pH变化关系如图所示。下列叙述正确的是
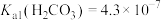 ,
, 。某二元酸
。某二元酸 及其钠盐的溶液中,
及其钠盐的溶液中, 、
、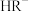 、
、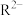 三者的物质的量分数随溶液pH变化关系如图所示。下列叙述正确的是
三者的物质的量分数随溶液pH变化关系如图所示。下列叙述正确的是
A. 的电离平衡常数 的电离平衡常数 |
B.向 溶液中加入少量 溶液中加入少量 溶液,发生的反应是: 溶液,发生的反应是: |
C.等体积、等浓度的NaOH溶液与 溶液混合后,溶液中: 溶液混合后,溶液中: |
D.在 的溶液中: 的溶液中: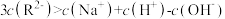 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用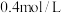 盐酸滴定
盐酸滴定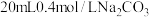 溶液,反应过程中的pH和压强变化如图所示。下列说法
溶液,反应过程中的pH和压强变化如图所示。下列说法错误 的是

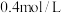 盐酸滴定
盐酸滴定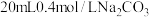 溶液,反应过程中的pH和压强变化如图所示。下列说法
溶液,反应过程中的pH和压强变化如图所示。下列说法
A.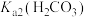 的数量级为 的数量级为 |
B.b点: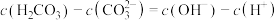 |
C.c→d段主要发生的反应为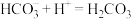 |
| D.e→f段压强增大的主要原因是盐酸的挥发 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】用一定浓度的 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为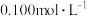 的
的 、
、 和
和 三种溶液,滴定过程中三种溶液的电导率如图所示。(已知:溶液电导率越大,导电能力越强;b点为曲线②上的点)。下列说法不正确的是
三种溶液,滴定过程中三种溶液的电导率如图所示。(已知:溶液电导率越大,导电能力越强;b点为曲线②上的点)。下列说法不正确的是

 溶液分别滴定体积均为
溶液分别滴定体积均为 、浓度均为
、浓度均为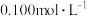 的
的 、
、 和
和 三种溶液,滴定过程中三种溶液的电导率如图所示。(已知:溶液电导率越大,导电能力越强;b点为曲线②上的点)。下列说法不正确的是
三种溶液,滴定过程中三种溶液的电导率如图所示。(已知:溶液电导率越大,导电能力越强;b点为曲线②上的点)。下列说法不正确的是
A.由图可知,①②③曲线分别表示 、 、 、 、 |
B.d点对应的溶液中粒子浓度大小关系: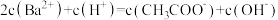 |
C. 浓度为 浓度为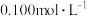 |
D.a、b、c、d四点中水的电离程度: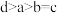 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法中正确的是
| A.NaNO3溶液中:c(Na+)=c(NO3-) |
| B.在Na2CO3溶液中,c(H+)=c(OH-) |
| C.在CH3COOH溶液中,c(CH3COOH)=c(H+) |
| D.K2S溶液中:2c(K+)=c(S2−) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是
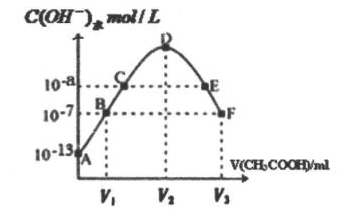

| A.稀Ba(OH)2溶液的浓度为0.1mol・L-1 |
| B.C点溶液的PH=a |
| C.D点溶液中c(OH-)<c(H+)+c(CH3COOH) |
| D.E点溶液中存在c(CH3COO-)>c(Ba2+)>C(OH-)>C(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】现有HA、HB和H2C三种酸.室温下,用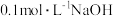 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示(忽略溶液体积变化)。下列说法不正确的是
溶液体积的变化如图所示(忽略溶液体积变化)。下列说法不正确的是

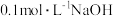 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示(忽略溶液体积变化)。下列说法不正确的是
溶液体积的变化如图所示(忽略溶液体积变化)。下列说法不正确的是
A.a点时的溶液中由水电离出的 |
B. |
C.b点对应溶液中 |
D.已知常温下 的 的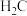 溶液中 溶液中 ,则往 ,则往 溶液中滴入少量 溶液中滴入少量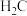 溶液,反应的离子方程式为 溶液,反应的离子方程式为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知 溶液显酸性,溶液中存在以下平衡;
溶液显酸性,溶液中存在以下平衡;
 ①
①
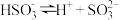 ②
②
向 的
的 溶液中分别加入以下物质,下列有关说法正确的是
溶液中分别加入以下物质,下列有关说法正确的是
 溶液显酸性,溶液中存在以下平衡;
溶液显酸性,溶液中存在以下平衡; ①
①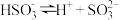 ②
②向
 的
的 溶液中分别加入以下物质,下列有关说法正确的是
溶液中分别加入以下物质,下列有关说法正确的是A.加入少量金属Na,反应①平衡逆向移动,溶液中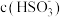 增大 增大 |
B.加入少量 固体,则反应①平衡正向移动, 固体,则反应①平衡正向移动, 的水解程度增大,酸性减弱 的水解程度增大,酸性减弱 |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
D.加入氨水至中性,则 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的CH3COONa、NaClO、NaHCO3三种溶液:c(CH3COONa) > c(NaClO) > c (NaHCO3) |
| B.Na2CO3溶液:c(OH-)—c(H+)=c(HCO3-)+ c(H2CO3) |
| C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.0.1 mol·L-1的KHA溶液,其pH=10:c(HA-)> c(OH-)> c(H+)> c(A2-) |
您最近一年使用:0次


 的变化关系
的变化关系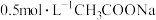 溶液、
溶液、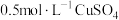 溶液以及
溶液以及 的pH随温度变化的曲线如图所示。下列说法正确的是
的pH随温度变化的曲线如图所示。下列说法正确的是

 溶液的
溶液的 减小
减小 溶液的pH均降低,是因为
溶液的pH均降低,是因为 、
、 水解平衡移动方向不同
水解平衡移动方向不同