 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。下表列出了在不同温度和压强下,反应达到平衡时SO2的转化率。
| 温度/℃ | 平衡时SO2的转化率/% | ||||
| 0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)一定温度下,在容积不变的密闭容器中发生上述反应,能说明反应达到平衡状态的是_______
| A.SO2的体积分数不再变化 | B.混合物的密度不再变化 |
| C.v(SO2)=2v(O2) | D.气体的压强不再变化 |
(3)在实际生产中,选定的温度为400~500 ℃,原因是
(4)在实际生产中,采用的压强为常压,原因是
(5)在实际生产中,通入过量的空气,原因是
(6)尾气中SO2必须回收,原因是
Ⅱ.乙酸甲酯(CH3COOCH3)与氢气制备乙醇主要发生如下反应:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
CH3OH(g)+CH3CH2OH(g) ,一定温度、1.01 MPa下,在恒容容器中以n(CH3COOCH3)∶n(H2)=1∶10的投料比进行反应,乙酸甲酯转化率与气体总压强的关系如图所示:
已知:对于气相反应,某组分的平衡分压=总压×平衡时某组分的物质的量分数
(7)A点时,CH3COOCH3(g)的平衡分压为
(8)此温度下,该反应的化学平衡常数Kp=
相似题推荐
I.利用H2S 制CS2。
(1)热解H2S和CH4的混合气体制H2和CS2。
①2H2S(g) =2H2(g)+S2(g) ΔH1=+170kJmol-1
②CH4(g)+S2(g)=CS2(g)+2H2(g) ΔH2=+64kJmol-1
总反应:2H2S(g)+CH4(g) =CS2 (g)+4H2(g),ΔH=
(2)CH4的电子式为
(3)工业上还可以利用硫(S8) 与CH4为原料制备 CS2,S8受热分解成气态 S2, 发生反应 2S2(g)+CH4(g) =CS2(g)+2H2S(g), 某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与 CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b. 气体总压 c.CH4 与S2体积比 d.CS2的体积分数
③一定条件下,CH4与 S2反应中 CH2的平衡转化率、S8分解产生 S2的体积分数随温度的变化由线如下图所示,据图分析,生成 CS2的反应为
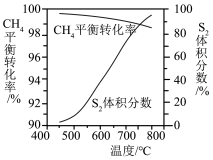
(4)回收单质硫。将三分之一的H2S燃烧。产生的SO2与其余H2S混合反应:2H2S(g)+SO2(g)

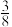 S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=
S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=(5)回收H2S。用一定浓度Na2S溶液吸一定量的H2S,当溶液中c(H2S)=c(S2-)时,溶液pH=
(1)已知下列反应的热化学方程式:
①
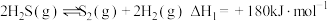
②
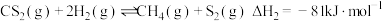
则反应③
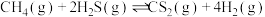 的
的
 ;下列叙述能说明反应③达到平衡状态的是
;下列叙述能说明反应③达到平衡状态的是a.断裂
 的同时生成
的同时生成
B.恒温恒压条件下,混合气体的平均摩尔质量不再变化
C.恒温恒容条件下,混合气体的密度不再变化
D.
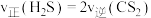
(2)对于上述反应①,在不同温度、压强为
 、进料
、进料 的物质的量分数为
的物质的量分数为 (其余为
(其余为 )的条件下,
)的条件下, 的平衡转化率如图1所示。
的平衡转化率如图1所示。 和
和 的大小关系为
的大小关系为
(3)上述反应①和③的
 随温度的变化如图2所示,已知
随温度的变化如图2所示,已知 (
( 为常数,
为常数, 为温度,
为温度, 为平衡常数),则在
为平衡常数),则在 时,反应的自发趋势:①
时,反应的自发趋势:① 、
、 条件下,
条件下,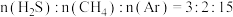 的混合气发生反应,达到平衡时
的混合气发生反应,达到平衡时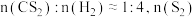 接近于0,其原因是
接近于0,其原因是(4)在恒温恒压
 条件下,
条件下,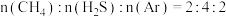 的混合气仅发生反应③,达到平衡时,
的混合气仅发生反应③,达到平衡时, 的分压与
的分压与 的分压相同。则
的分压相同。则 的转化率为
的转化率为
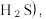 需要回收处理并加以利用,有关反应如下:
需要回收处理并加以利用,有关反应如下:ⅰ.
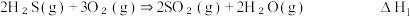
ⅱ.
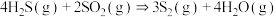 △H₂
△H₂ⅲ.
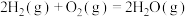
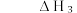
回答下列问题:
(1)H₂S热分解反应
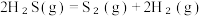 的
的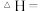
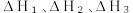 的式子表示);若起始加1molH₂气体在刚性容器中发生该分解反应,下列说法
的式子表示);若起始加1molH₂气体在刚性容器中发生该分解反应,下列说法A.H₂S 与S₂ 的物质的量之比保持2:1不变
B.容器中混合气体平均摩尔质量保持不变
C.
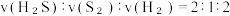 保持不变
保持不变 D.容器中混合气体的颜色保持不变
(2)总压恒定为 100kPa,向密闭容器中充入
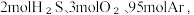 发生反应i和反应ii,反应过程中
发生反应i和反应ii,反应过程中 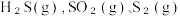 )等含硫物质的分布分数δ随时间变化如图所示。
)等含硫物质的分布分数δ随时间变化如图所示。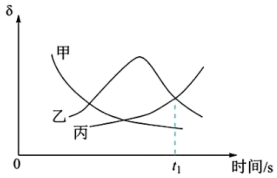
①表示
 分布分数的曲线为
分布分数的曲线为②t₁时测得
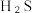 转化率为α,此时体系中
转化率为α,此时体系中 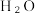 的物质的量为
的物质的量为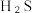 分压表示的平均反应速率为
分压表示的平均反应速率为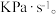
(3)也可采用
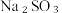 氧化法对
氧化法对 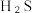 进行处理,过程中发生反应的方程式(均未配平)为:
进行处理,过程中发生反应的方程式(均未配平)为:ⅰ.
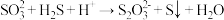
ⅱ.

ⅲ.
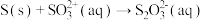
实验测得,在
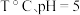 时,
时, 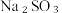 的投加量对平衡体系中部分微粒浓度的影响如图所示。
的投加量对平衡体系中部分微粒浓度的影响如图所示。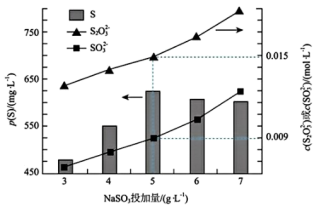
①T℃时,反应iii的平衡常数 K=
②结合三个反应分析,当
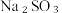 投加量高于
投加量高于 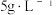 时,单位体积内 S 的质量减小的原因为:
时,单位体积内 S 的质量减小的原因为: 平衡体系进行探究。回答下列问题如图1。
平衡体系进行探究。回答下列问题如图1。
(1)向左侧烧杯中加入
 晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应
晶体,观察甲瓶红棕色变浅,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。则该反应

(2)关闭止水夹,维持温度不变,用注射器向甲瓶中充入一定量
 ,则此时反应
,则此时反应 浓度熵Q
浓度熵Q 的转化率将
的转化率将(3)查阅资料可知,F。Daniels等曾利用测压法在刚性反应器中研究了25℃时
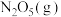 分解反应:
分解反应:Ⅰ、
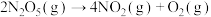 [
[ 时,
时,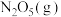 完全分解]
完全分解]Ⅱ、

反应体系的总压强p随时间t的变化如图2所示。
①研究表明,
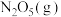 分解的反应速率
分解的反应速率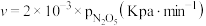 。t=1h时,测得体系中
。t=1h时,测得体系中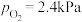 ,则此时
,则此时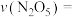
 。
。②若提高反应温度至35℃,则
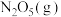 完全分解后体系压强
完全分解后体系压强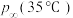
③25℃时
 反应的平衡常数
反应的平衡常数
 为以分压表示的平衡常数,
为以分压表示的平衡常数, 等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
等于平衡时生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压×该物质的物质的量分数计算结果保留1位小数)
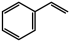
(1)以CO2和乙苯为原料合成苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的两种推测:
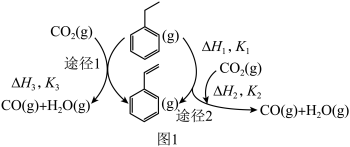
则CO2(g)+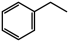 (g)
(g)
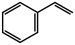 (g)+CO(g)+H2O(g)的平衡常数K3=
(g)+CO(g)+H2O(g)的平衡常数K3=
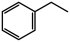 (g)
(g)
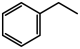
 (g)+CO(g)+H2O(g),在不同温度下测得平衡时各物质的体积分数如图2.可知
(g)+CO(g)+H2O(g),在不同温度下测得平衡时各物质的体积分数如图2.可知
 ,由图象知该反应
,由图象知该反应

 (g)
(g) 
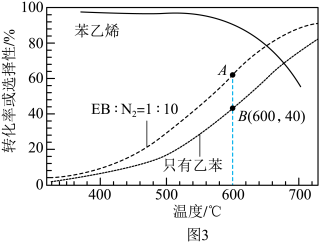
②掺入N2能提高乙苯的平衡转化率,解释说明该事实
③用平衡分压代替平衡浓度计算600℃时的平衡常数

④控制反应温度为600℃的理由是
(4)实验测得,乙苯脱氢的速率方程为
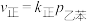 ,
,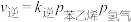 (k正、k逆为速率常数,只与温度有关),图4中③代表lgk逆随
(k正、k逆为速率常数,只与温度有关),图4中③代表lgk逆随 的变化关系,则能代表lgk正随
的变化关系,则能代表lgk正随 的变化关系的是
的变化关系的是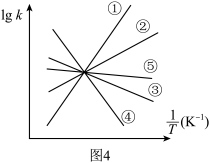
Ⅰ.用其制备环戊烯:
方法一:
反应①: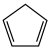 (g)+H2(g)
(g)+H2(g)
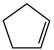 (g) ΔH1=-100.3 kJ·mol-1
(g) ΔH1=-100.3 kJ·mol-1
反应②: (g)+H2(g)
(g)+H2(g)
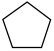 (g) ΔH2=-109.4 kJ·mol-1
(g) ΔH2=-109.4 kJ·mol-1
反应③: (g)+
(g)+ (g)
(g) 2
2 (g) ΔH3
(g) ΔH3
方法二: (g)+2HI
(g)+2HI
 (g)+I2(g) ΔH4=-89.3 kJ·mol-1
(g)+I2(g) ΔH4=-89.3 kJ·mol-1
①平衡时HI的体积分数为
②用平衡分压代替平衡浓度计算压强平衡常数KP=
③保持温度和体积不变,向平衡体系中再充入等物质的量的环戊二烯和环戊烯,平衡
Ⅱ.环戊二烯(C5H6)容易二聚生成双环戊二烯(C10H12):2 (g)
(g)
 (g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。
(g)。不同温度下,溶液中环戊二烯的浓度(初始浓度为1.5mol·L-1)与反应时间的关系如图所示。

(4)一定量的环戊二烯气体在恒温恒压的密闭容器中发生上述反应,可说明一定达化学平衡状态的是
a.容器内混合气体的密度不再变化
b.容器内混合气体的平均相对分子质量不再变化
c.

d.容器内气体压强不再变化
(5)用环戊二烯制备的二茂铁
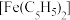 易升华且可溶于有机溶剂中,其晶体类型为
易升华且可溶于有机溶剂中,其晶体类型为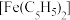 的数目为
的数目为
 转化为甲醚、甲醇等产品.请回答问题:
转化为甲醚、甲醇等产品.请回答问题: 与
与 制甲醚
制甲醚 的主要反应如下:
的主要反应如下:I.
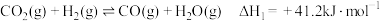
Ⅱ.

Ⅲ.

(1)总反应
 的
的
(2)若在体积恒定的密闭容器内发生上述反应,下列措施可提高总反应速率的是
a.加入催化剂 b.降低温度 c.充入惰性气体 d.同比例的增大
 和
和 的投料
的投料(3)密闭容器中充入
 ,在
,在 条件下测得平衡时
条件下测得平衡时 转化率和
转化率和 选择性随温度的变化如图所示.
选择性随温度的变化如图所示.
已知:
 选择性
选择性
①表示
 选择性的是曲线
选择性的是曲线②温度高于
 时,曲线N随温度升高而升高的原因是
时,曲线N随温度升高而升高的原因是③为同时提高平衡时
 转化率和
转化率和 选择性,应选择的反应条件为
选择性,应选择的反应条件为a.低温、低压 b.高温、高压 c.高温、低压 d.低温、高压
④Q点温度下
 的物质的量为
的物质的量为 ,则该温度下反应Ⅲ的
,则该温度下反应Ⅲ的
(4)研究发现
 双金属氧化物对
双金属氧化物对 加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
加氢制甲醇有良好的催化作用,反应机理如图所示,下列有关叙述正确的是
a.反应①有极性键的断裂和形成 b.氧空位的作用是用于捕获

c.整个过程中,
 元素的化合价未发生变化 d.机理图上中间体有三种
元素的化合价未发生变化 d.机理图上中间体有三种
①

②
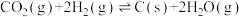
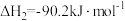
③
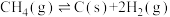
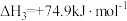
④

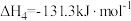
回答下列问题:
(1)

(2)反应体系总压强分别为
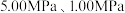 和
和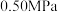 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为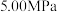 的曲线是
的曲线是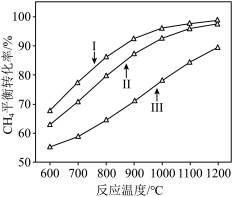
 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是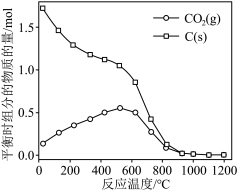
 和
和 反应可制取乙烯,反应的化学方程式为
反应可制取乙烯,反应的化学方程式为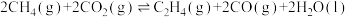 。一定温度下,向某恒容密闭容器中充入
。一定温度下,向某恒容密闭容器中充入 和
和 ,体系的初始压强为
,体系的初始压强为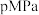 ,若平衡时
,若平衡时 的转化率为
的转化率为 ,不考虑副反应的发生,
,不考虑副反应的发生,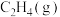 的平衡分压为
的平衡分压为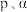 表示,下同),该反应的压强平衡常数
表示,下同),该反应的压强平衡常数
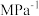 。
。(5)CH4过光电化学转化可制得乙二醇,以乙二醇为燃料的燃料电池工作时,若以
 溶液为电解液,则该电极的电极反应式为
溶液为电解液,则该电极的电极反应式为(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=
②在该温度下反应的平衡常数K=
③关于上述反应,下列叙述正确的是
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:
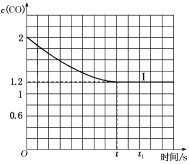
若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:
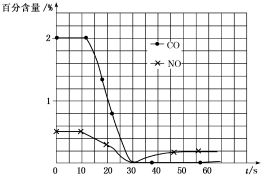
请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是
(1)已知常温常压下下列反应的能量变化如图所示:
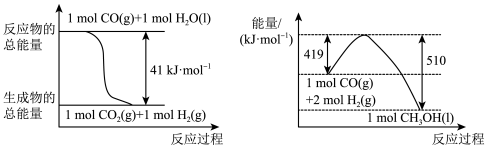
写出由二氧化碳和氢气制备甲醇的热化学方程式:
(2)CO2催化加氢制取甲醇,反应如下:
主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1
CH3OH(g)+H2O(g) ∆H1=-49.5kJ·mol-1副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.2kJ·mol-1
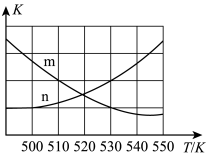
CO(g)+H2O(g) △H2=+41.2kJ·mol-1①在一定条件下,向某1L恒容密闭容器中充入1molCO2和amolH2发生主反应。图中能表示该反应的平衡常数K与温度T之间的变化关系的是曲线
②副反应的反应速率v=v正-v逆=k正c(CO2)·c(H2)k逆cm(CO)·cn(H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K=
 ,则m=
,则m=③在一定温度下,①中的起始总压强为21.2MPa。实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度变化如图所示:
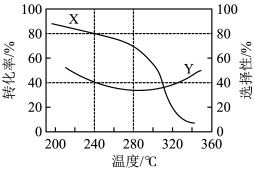
已知:CH3OH的选择性=
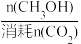 ×100%。图中表示平衡时CH3OH的选择性的曲线为
×100%。图中表示平衡时CH3OH的选择性的曲线为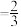 ,初始充入H2的物质的量a=
,初始充入H2的物质的量a=Ⅰ.工业上利用甲醇和水蒸气催化重整法可制备氢气。
(1)已知:反应1:CH3OH(g)
 CO(g)+2H2(g)∆H1=+90.0kJ·mol-1
CO(g)+2H2(g)∆H1=+90.0kJ·mol-1反应2:CO(g)+H2O(g)
 CO2(g)+H2(g)∆H2=-41.0kJ·mol-1
CO2(g)+H2(g)∆H2=-41.0kJ·mol-1则反应3:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g)∆H3=
CO2(g)+3H2(g)∆H3=(2)以CuO-ZnO-Al2O3催化剂进行甲醇重整制氢时,固定其它条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图1所示。[CO选择性=
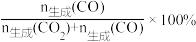 ]
]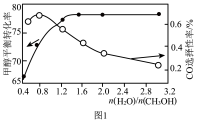
①当水、甲醇比大于0.8时,CO选择性下降的原因是
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是
(3)在t℃下,在1L密闭容器中,当投入的CH3OH和H2O均为1mol时,甲醇平衡转化率为80%、CO选择性为60%,则c(CO)=
Ⅱ.用CO2和H2可以合成甲醇。其主要反应为
反应ⅠCO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)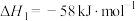
反应ⅡCO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)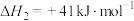
在恒容密闭容器内,充入1molCO2和3molH2,测得平衡时CO2转化率,CO和CH3OH选择性随温度变化如图2所示[选择性
 ]。
]。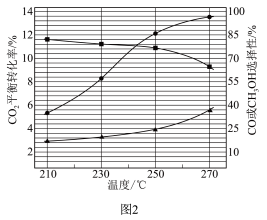
(4)270℃时主要发生的反应是
(5)以下温度中,甲醇产率最高的是___________。
| A.210℃ | B.230℃ | C.250℃ | D.270℃ |
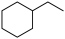
【推荐3】 常用作有机合成与生物化学中间体,可由
常用作有机合成与生物化学中间体,可由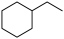 脱氢制得,体系中同时发生如下反应:
脱氢制得,体系中同时发生如下反应:
反应Ⅰ: 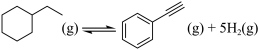

反应Ⅱ: 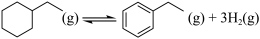

(1)在T℃,恒压密闭容器中只发生反应Ⅰ。初始通入0.2mol
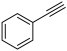 和1mol H2,达平衡时,体系向环境放热a kJ;若初始加入0.8mol
和1mol H2,达平衡时,体系向环境放热a kJ;若初始加入0.8mol  (g),达平衡时,体系向环境吸热b kJ。则
(g),达平衡时,体系向环境吸热b kJ。则
 (用含“a” “b”的代数式表示)。
(用含“a” “b”的代数式表示)。(2)一定温度下,向恒压密闭容器中通入1mol
 (g),发生反应Ⅰ和反应Ⅱ,测得
(g),发生反应Ⅰ和反应Ⅱ,测得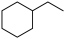 的平衡转化率为
的平衡转化率为 ,
,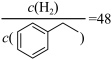 。
。①平衡体系中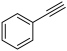 的物质的量为
的物质的量为 的代数式表示,下同),反应Ⅱ的平衡常数
的代数式表示,下同),反应Ⅱ的平衡常数
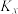 为用各物质的量分数代替浓度表示的平衡常数)。
为用各物质的量分数代替浓度表示的平衡常数)。
②平衡后,保持其他条件不变,再向该容器中通入1mol He,再次达到平衡, 的值将(填“增大”“减小”或“不变”)
的值将(填“增大”“减小”或“不变”)
 (g),不同压强和温度下
(g),不同压强和温度下 的平衡转化率如图所示。
的平衡转化率如图所示。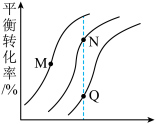
②N点的平衡转化率比M点高,原因可能是



