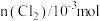在一定体积的密闭容器中,进行化学反应 ,其化学平衡常数K和温度T的关系如表:
,其化学平衡常数K和温度T的关系如表:
(1)该反应的化学平衡常数表达式
______ 。
(2)该反应为______ (填“吸热”或“放热”)反应,判断依据为______ 。
(3)某温度下,各物质的平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为______ 。
(4)若1200℃时,在某时刻平衡体系中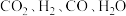 的浓度分别为
的浓度分别为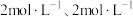 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为______ (填“正反应方向”“逆反应方向”或“不移动”),判断依据为______
 ,其化学平衡常数K和温度T的关系如表:
,其化学平衡常数K和温度T的关系如表:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

(2)该反应为
(3)某温度下,各物质的平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为(4)若1200℃时,在某时刻平衡体系中
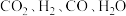 的浓度分别为
的浓度分别为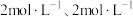 、
、 、
、 ,则此时上述反应的平衡移动方向为
,则此时上述反应的平衡移动方向为
更新时间:2024-03-05 15:16:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。回答下列问题:
(1)结合下表数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_______ 。
(2)对于反应N2(g)+3H2(g) 2NH3(g),在一定条件下氨的平衡含量如下表:
2NH3(g),在一定条件下氨的平衡含量如下表:
①合成氨反应为_______ (填“吸热”或“放热”)反应。
②其他条件不变时,升高温度,氨的平衡含量减小的原因是_______ (填标号)。
A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
B.升高温度,浓度商(Q)增大,平衡常数(K)不变,Q>K,平衡向逆反应方向移动
C.升高温度,活化分子数增多,反应速率加快
D.升高温度,平衡常数(K)减小,平衡向逆反应方向移动
(3)图1表示500°C、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。根据图中M点数据,可计算出平衡时N2的体积分数为_______ 。
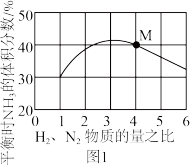
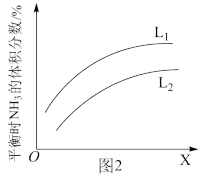
(4)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中X代表的是_______ (填“温度”或“压强”)。判断L1、L2的大小关系并说明理由_______ 。
(1)结合下表数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
| 化学反应 | K(298K)的数值 |
N2(g)+O2(g) 2NO(g) 2NO(g) | 5.0×10-31 |
N2(g)+3H2(g) 2NH3(g) 2NH3(g) | 4.1×106 |
(2)对于反应N2(g)+3H2(g)
 2NH3(g),在一定条件下氨的平衡含量如下表:
2NH3(g),在一定条件下氨的平衡含量如下表:| 温度/°C | 压强/MPa | 氨的平衡含量(体积分数) |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
①合成氨反应为
②其他条件不变时,升高温度,氨的平衡含量减小的原因是
A.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
B.升高温度,浓度商(Q)增大,平衡常数(K)不变,Q>K,平衡向逆反应方向移动
C.升高温度,活化分子数增多,反应速率加快
D.升高温度,平衡常数(K)减小,平衡向逆反应方向移动
(3)图1表示500°C、60.0MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。根据图中M点数据,可计算出平衡时N2的体积分数为

(4)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强,其中X代表的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一
(1)已知:N2(g)+O2(g) 2NO(g) ΔH=+180.5kJ·mol-1
2NO(g) ΔH=+180.5kJ·mol-1
C(s)+O2(g) CO2(g) ΔH=-393.5kJ·mol-1
CO2(g) ΔH=-393.5kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221kJ·mol-1
2CO(g) ΔH=-221kJ·mol-1
若某反应的平衡常数表达式为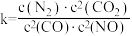 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式_______ 。
(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H<0,一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列
5N2(g)+6H2O(l) △H<0,一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列不能 判断该反应达到平衡状态的是_______ 。
A.c(NH3)︰c(NO)=2︰3 B.n(NH3)︰n(N2)不变
C.容器内压强不变 D.容器内混合气体的密度不变
E.1molN-H键断裂的同时,生成1molO-H键
(3)NO氧化反应:2NO(g)+O2(g) 2NO2(g)分两步进行,其反应历程能量变化如图所示。
2NO2(g)分两步进行,其反应历程能量变化如图所示。

写出决定NO氧化反应速率的化学方程式:_______ 。
(4)实验测得反应2NO(g)+O2(g) 2NO2(g) ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
2NO2(g) ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
①温度为T1时,在1 L的恒容密闭容器中,投入0.6 mol NO和0.3 mol O2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO N2O2快速平衡
N2O2快速平衡
第二步:N2O2 +O2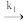 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)。下列叙述正确的是_______ 。
A.同一温度下,平衡时第一步反应的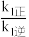 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(5)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) 4CO2(g)+N2(g) ΔH<0,某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应达平衡,若保持温度不变再将CO、CO2气体浓度分别增加一倍,则平衡
4CO2(g)+N2(g) ΔH<0,某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应达平衡,若保持温度不变再将CO、CO2气体浓度分别增加一倍,则平衡_______ (填“右移”或“左移”或“不移动”);若将温度降低,再次平衡后,与原平衡相比体系压强(p总)_______ (填“增大”、“减小”或“不变”),原因是_______ 。
(1)已知:N2(g)+O2(g)
 2NO(g) ΔH=+180.5kJ·mol-1
2NO(g) ΔH=+180.5kJ·mol-1C(s)+O2(g)
 CO2(g) ΔH=-393.5kJ·mol-1
CO2(g) ΔH=-393.5kJ·mol-12C(s)+O2(g)
 2CO(g) ΔH=-221kJ·mol-1
2CO(g) ΔH=-221kJ·mol-1若某反应的平衡常数表达式为
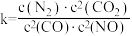 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H<0,一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列
5N2(g)+6H2O(l) △H<0,一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO)=2︰3充入反应物,发生上述反应。下列A.c(NH3)︰c(NO)=2︰3 B.n(NH3)︰n(N2)不变
C.容器内压强不变 D.容器内混合气体的密度不变
E.1molN-H键断裂的同时,生成1molO-H键
(3)NO氧化反应:2NO(g)+O2(g)
 2NO2(g)分两步进行,其反应历程能量变化如图所示。
2NO2(g)分两步进行,其反应历程能量变化如图所示。
写出决定NO氧化反应速率的化学方程式:
(4)实验测得反应2NO(g)+O2(g)
 2NO2(g) ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。
2NO2(g) ΔH<0的即时反应速率满足以下关系式:v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响。①温度为T1时,在1 L的恒容密闭容器中,投入0.6 mol NO和0.3 mol O2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1
②研究发现该反应按如下步骤进行:
第一步:NO+NO
 N2O2快速平衡
N2O2快速平衡 第二步:N2O2 +O2
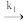 2NO2 慢反应
2NO2 慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)。下列叙述正确的是
A.同一温度下,平衡时第一步反应的
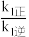 越大反应正向程度越大
越大反应正向程度越大B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(5)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g)
 4CO2(g)+N2(g) ΔH<0,某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应达平衡,若保持温度不变再将CO、CO2气体浓度分别增加一倍,则平衡
4CO2(g)+N2(g) ΔH<0,某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生上述反应达平衡,若保持温度不变再将CO、CO2气体浓度分别增加一倍,则平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在一固定容积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ⇌CO(g)+H2O(g);∆H=QkJ/mol
其化学平衡常数K和温度t的关系如下:
请回答:
(1)上述反应中Q_______ 0(选填“>”或“<”)
(2)其他条件不变,下列条件变化中能使正反应速率加快的是:_______
A.缩小体积使压强增大 B.恒容充入H2(g) C.恒容充入He D.降低温度
(3)能判断该反应已达到化学平衡状态的依据是_______ 。
A.容器中压强不变 B.v正(H2)=v逆(CO)
C.CO2的质量分数不变 D.容器中气体的密度不变
(4)温度为850℃时,可逆反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)在固定容积的密闭容器中进行,850℃时容器内物质的浓度(mol/L)的变化如下表:
①计算:3min时CO的浓度c1=_______ mol/L,H2O(g)的转化率=_______ 。
②反应在4min~5min之间,平衡向逆反应方向移动,下列措施中,可能的原因是_______ ,表中5min~6min之间数值发生变化,可能的原因是_______ 。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
其化学平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)上述反应中Q
(2)其他条件不变,下列条件变化中能使正反应速率加快的是:
A.缩小体积使压强增大 B.恒容充入H2(g) C.恒容充入He D.降低温度
(3)能判断该反应已达到化学平衡状态的依据是
A.容器中压强不变 B.v正(H2)=v逆(CO)
C.CO2的质量分数不变 D.容器中气体的密度不变
(4)温度为850℃时,可逆反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)在固定容积的密闭容器中进行,850℃时容器内物质的浓度(mol/L)的变化如下表:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①计算:3min时CO的浓度c1=
②反应在4min~5min之间,平衡向逆反应方向移动,下列措施中,可能的原因是
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。其中用 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:
反应Ⅰ:

反应Ⅱ:

反应Ⅲ:
(1)根据盖斯定律,反应Ⅰ的
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
_______ eV。并写出该历程的化学方程式_______ 。
(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
(4)加压,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”);若原料二氧化碳中掺混一氧化碳,随一氧化碳含量的增加,甲醇产率将_______ (填“升高”“不变”“降低”或“无法确定”)。
(5)加入新催化剂使1mol 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。_______ (填“473K”“513K”或“553K”)。
②553K时,若反应后体系的总压为p,反应Ⅰ的
_______ (列出计算式)。( 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
 、
、 为原料合成甲醇(
为原料合成甲醇( )过程主要涉及以下反应:
)过程主要涉及以下反应:反应Ⅰ:


反应Ⅱ:


反应Ⅲ:

(1)根据盖斯定律,反应Ⅰ的

(2)我国学者结合实验与计算机模拟结果,研究了
 与
与 在
在 /Cu催化剂表面生成
/Cu催化剂表面生成 和
和 的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。
的部分反应历程,如图所示,其中吸附在催化剂表面的物种用*标注。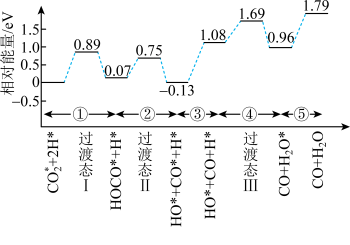

(3)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______(填字母)。
| A.升高温度,反应Ⅱ正向移动,反应Ⅲ逆向移动 |
| B.加入反应Ⅰ的催化剂,可以降低反应的活化能及反应热 |
C.增大 的浓度,有利于提高 的浓度,有利于提高 的平衡转化率 的平衡转化率 |
D.及时分离出 ,可以使得反应Ⅰ的正反应速率增大 ,可以使得反应Ⅰ的正反应速率增大 |
(4)加压,甲醇产率将
(5)加入新催化剂使1mol
 和3mol
和3mol  在1L密闭容器中只发生反应Ⅰ、Ⅱ,
在1L密闭容器中只发生反应Ⅰ、Ⅱ, 平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的
平衡转化率和甲醇选择率(甲醇选择率是指转化生成甲醇的 物质的量分数)与温度的变化趋势如图所示。
物质的量分数)与温度的变化趋势如图所示。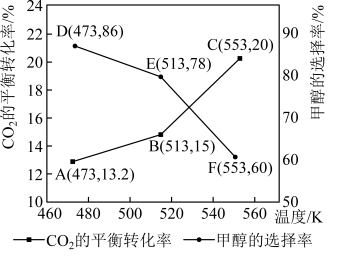
②553K时,若反应后体系的总压为p,反应Ⅰ的

 为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
为压强平衡常数,其表达式写法:在浓度平衡常数表达式中用气体分压代替浓度,气体的分压等于总压乘以物质的量分数。)
您最近一年使用:0次
【推荐2】三氧化二镍(Ni2O3)是重要的电子元件和蓄电池材料,工业上利用含镍废料(主要含金属Ni、A1、Fe及其氧化物、SiO2、C等)回收其中的镍并制备Ni2O3的工艺流程如下所示:

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
Ni2++2HR
(1)“预处理”的操作可以选择用_______ (填标号)来除去镍废料表面的矿物油污。
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是_______ ,实际生产中为了减少杂质离子的引入,可以用来替代NaClO3的试剂是_______ (填化学式)。
(3)利用上述表格数据,计算Al(OH)3的Ksp=_______ (列出计算式),若“氧化”后的溶液中Ni2+浓度为0.1mol·L-1,则“调pH”应控制的pH范围是_______ 。
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为_______ (结合平衡移动原理解释)。
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是_______ 。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为_______ 。

已知:①在该实验条件下NaClO3、Fe3+不能氧化Ni2+。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | A13+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010 mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5 mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
 Ni2++2HR
Ni2++2HR(1)“预处理”的操作可以选择用
A.纯碱溶液浸泡 B.NaOH溶液浸泡 C.酒精清洗
(2)“氧化”时主要反应的离子方程式是
(3)利用上述表格数据,计算Al(OH)3的Ksp=
(4)向有机相中加入H2SO4溶液能进行反萃取的原因为
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
(6)有机相提取的Ni2+再生时可用于制备镍氢电池,该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:2 CrO42-(黄色)+2H+ Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
(1)若第①步中平衡体系的pH=2,则该溶液显_________ 色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4
为黄色沉淀)则平衡_________ 移动(填“向左”或“向右”或“不变”),溶液颜色将_________ 。
(2)能说明第①步反应达平衡状态的是_________ (选填编号)
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应_________ (选填编号)
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要_________ mol的FeSO4•7H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_________ 。
方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为________ 。
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)_________ ,溶液中同时生成的沉淀还有________ 。
方法1:还原沉淀法。
该法的工艺流程为:

其中第①步存在平衡:2 CrO42-(黄色)+2H+
 Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O(1)若第①步中平衡体系的pH=2,则该溶液显
为黄色沉淀)则平衡
(2)能说明第①步反应达平衡状态的是
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面方法由氨气得到氢气。
方法:氨热分解法制氢气
反应2NH3(g) N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
(2)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=___________ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ ;
③在该温度下,反应的标准平衡常数Kθ=___________ 。(已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
方法:氨热分解法制氢气
反应2NH3(g)
 N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;
N2(g)+3H2(g) ΔH=+90.8 kJ·mol-1;(1)已知该反应的ΔS=198.9 J·mol-1·K-1,在下列哪些温度下反应能自发进行?___________(填字母);
| A.25 ℃ | B.125 ℃ | C.225 ℃ | D.325 ℃ |

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
③在该温度下,反应的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】近年来,随着聚酯工业的快速发展,Cl2的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化法(称作Deacon反应):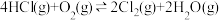 。
。
用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=_______ (用△H1和△H2表示)
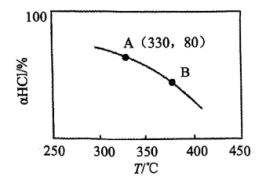
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。
①下列说法能说明Deacon反应在此条件下到达平衡状态的有________ 。
A.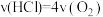 B.H2O的质量分数不变
B.H2O的质量分数不变
C. 不变 D.
不变 D. 不变
不变
②Deacon反应的△H________ 0(填“>”、“=”或“<”,下同),A、B两点的平衡常数K(A)与K(B)的大小关系是K(A)________ K(B)。
③Deacon反应在A点的平衡常数K=________ 。
④保持温度及投料比不变,提高HCl的平衡转化率的方法有________ 。(写出2种)
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图__________ 。
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
2.0~6.0min内以HCl的物质的量变化表示的反应速率为_______ mol·min-1。
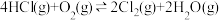 。
。用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。

①下列说法能说明Deacon反应在此条件下到达平衡状态的有
A.
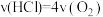 B.H2O的质量分数不变
B.H2O的质量分数不变C.
 不变 D.
不变 D. 不变
不变②Deacon反应的△H
③Deacon反应在A点的平衡常数K=
④保持温度及投料比不变,提高HCl的平衡转化率的方法有
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| 0 | 1.8 | 3.7 | 5.4 | 7.2 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应I:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH1
2CO(g)+2H2(g)ΔH1
在反应过程中还发生反应II:H2(g)+CO2(g) H2O(g)+CO(g)ΔH2=+41kJ·mol‑1
H2O(g)+CO(g)ΔH2=+41kJ·mol‑1
(1)已知部分化学键的键能数据如表所示:
则ΔH1=__ kJ·mol-1,反应I在一定条件下能够自发进行的原因是___ 。
(2)在密闭容器中加入CO2与CH4发生反应,下列能够判断反应I达到平衡状态的是___ (填标号)。
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量保持不变
D.一定温度和容积固定的容器中,H2和H2O物质的量之和保持不变
(3)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
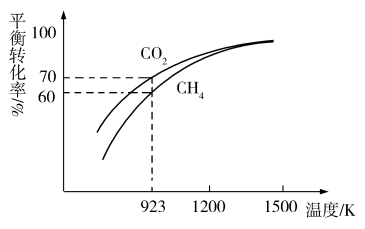
①923K时CO2的平衡转化率大于CH4的原因是___ 。
②计算923K时反应II的化学平衡常数K=___ (计算结果保留小数点后两位)。
③1200K以上CO2和CH4的中衡转化率趋于相等的原因可能是__ 。
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___ 。
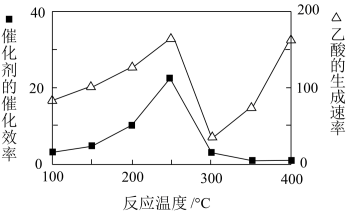
②为了提高该反应中CH4的转化率,可以采取的措施是___ (写出一条即可)。
工业上CO2与CH4发生反应I:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH1
2CO(g)+2H2(g)ΔH1在反应过程中还发生反应II:H2(g)+CO2(g)
 H2O(g)+CO(g)ΔH2=+41kJ·mol‑1
H2O(g)+CO(g)ΔH2=+41kJ·mol‑1(1)已知部分化学键的键能数据如表所示:
| 化学键 | C-H | H-H | C=O | C≡O |
| 键能(kJ·mol-1) | 413 | 436 | 803 | 1076 |
(2)在密闭容器中加入CO2与CH4发生反应,下列能够判断反应I达到平衡状态的是
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量保持不变
D.一定温度和容积固定的容器中,H2和H2O物质的量之和保持不变
(3)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是
②计算923K时反应II的化学平衡常数K=
③1200K以上CO2和CH4的中衡转化率趋于相等的原因可能是
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CH4的转化率,可以采取的措施是
您最近一年使用:0次